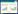文章信息
- 陈林, 霍红娜, 孙立丽, 任德飞, 刘亚男, 任晓亮, 戚爱棣
- CHEN Lin, HUO Hong-na, SUN Li-li, REN De-fei, LIU Ya-nan, REN Xiao-liang, QI Ai-di
- Fe3O4磁性纳米粒子对花旗松素的吸附性能研究
- Study on the adsorption of Fe3O4 magnetic nanoparticles for Taxifolin
- 天津中医药大学学报, 2017, 36(1): 49-53
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(1): 49-53
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.01.12
-
文章历史
收稿日期: 2016-09-11
花旗松素(Taxifolin),又名紫杉叶素、黄杉素、双氢槲皮,是生物类黄酮,来自于蓼科植物(Polygounumorientale L.)的干燥成熟果实水红花子[1]。花旗松素具有多种重要的生物学活性,能够抑制和激活多种酶,此外,还具有抗病毒和抗肿瘤活性[2-5]。花旗松素的抗氧化特性和对不同酶活性的影响,为其在调节脂代谢、抗脂质过氧化、抗病毒、抗肿瘤等医学领域和食品添加剂领域广泛应用提供了前提条件[6-7]。同时,多酚羟基结构的花旗松素(结构式见图 1)也具有溶解度小,容易氧化,稳定性差的特点,很大程度上限制了其临床应用。
|
| 图 1 花旗松素的化学结构式 |
近年来,Fe3O4磁性纳米粒子(以下简称Fe3O4)因其独特的性质,超顺磁性、低居里温度、较高的矫顽磁性而备受关注[8-9]。目前对其的研究热点主要集中在医学应用领域,因磁性微球作为高分子材料,他小到足够穿过毛细血管而不产生血管性闭塞,具有较好的生物相容性,同时可以在外磁场影响下进入周边组织[10-11]。
目前,国内外对于花旗松素的代谢方式及代谢物都有相关研究[12-15],但关于花旗松素的纳米粒制剂研究鲜见报道。本实验利用Fe3O4作为吸附载体,对花旗松素进行吸附考察研究,为花旗松素的进一步开发利用奠定基础。
1 实验材料Shimadzu LC-20AT高效液相色谱仪(日本岛津公司),THZ-82水浴恒温振荡器(江苏省金坛市荣华仪器制造有限公司),Sartorius BT125D十万分之一天平(赛多利斯科仪器有限公司),KH3200B型超声波清洗器(昆山禾创超声仪器有限公司),傅立叶变换红外光谱仪(铂金埃尔默仪器有限公司),纳米粒度及Zeta电位分析仪(马尔文仪器有限公司)。
花旗松素(98%,南京泽朗医药公司),甲醇(色谱纯,美国Sigma公司),甲酸(色谱纯)。FeCl3·6H2O(CAS:10025-77-1,国药集团化学试剂有限公司),无水醋酸钠(CAS:127-09-3,国药集团化学试剂有限公司),聚乙二醇(M.W.=1 000,CAS:127-09-3,天津科密欧试剂有限公司),乙二醇(分析纯)。
2 实验方法 2.1 Fe3O4的制备Fe3O4的制备根据文献方法[16]制得,称取1.35 g FeCl3·6H2O于烧杯中,量取乙二醇40 mL,室温搅拌至黄色澄清,再加入3.6 g无水醋酸钠和1.0 g聚乙二醇,搅拌30 min使溶液混合均匀,按比例分配到1个50 mL反应釜,在烘箱中200 ℃溶剂热反应20 h。反应结束后,得到黑色悬浮液,分别用去离子水和乙醇洗涤3次,60 ℃真空干燥。
2.2 对照品溶液的制备精密称定花旗松素对照品4.01 mg,置于10 mL棕色量瓶中,加甲醇定容至刻度线,即得401 mg/L花旗松素储备液。
2.3 花旗松素色谱条件色谱柱Waters SymmetryShieldTMRP18(150 mm×3.9 mm,5 μm);流动相:甲醇-0.2%甲酸水溶液(4:6);检测波长:290 nm;流速:1 mL/min;进样量10 μL。
2.4 标准曲线取401 mg/L的花旗松素标准储备液,以甲醇稀释至80.2、40.1、20.05、12.3、8.02、4.01、2.005 g/L的系列溶液,用0.45 μm微孔滤膜过滤,分别取10 μL进样分析,记录色谱峰面积,以质量浓度为横坐标,峰面积为纵坐标,得到回归方程Y=3×107X-21 479,r=0.999 7,表面在2.005~80.2 mg/L范围内线性关系良好。
2.5 精密度取2.4项下60.15 mg/L花旗松素溶液,分别重复进样6次,结果花旗松素峰面积的RSD值为1.23%。
2.6 吸附动力学实验精密量取5 mL,24.16 mg/L花旗松素水溶液于10 mL离心管中,置于298 K温度下的恒温振荡器中振荡,每隔一段时间将离心管置于磁铁上,吸取适量的上清液,按2.4项下方法检测溶液中花旗松素浓度。
2.7 吸附热力学实验精密量取24.16 mg/L花旗松素水溶液,各取5 mL于4支10 mL离心管中,另取4支作为空白对照,分别于298、308、318、328 K温度下的恒温振荡器中振荡,每隔一段时间将离心管置于磁铁上,吸取适量的上清液,按2.4项下方法检测溶液中花旗松素浓度。
2.8 其他因素对吸附过程影响的研究 2.8.1 溶剂对吸附性能的影响分别用0、10%、30%、50%、70%、90%、100%的甲醇水溶液稀释花旗松素储备液,分别得到同浓度的花旗松素溶液,各取1.5 mL,加入适量的Fe3O4,于25 ℃下的恒温振荡器中振荡24 h,将离心管置于磁铁上,静置20 min,吸取上清液,按2.4项下方法检测溶液中花旗松素浓度。
2.8.2 氯化钠(NaCl)离子浓度对吸附性能的影响分别用0、10、20、30、40、50、100 mmol/L的NaCl溶液稀释花旗松素储备液,得到385 mg/L的花旗松素水溶液,各取1.5 mL,加入适量的Fe3O4,于25 ℃下的恒温振荡器中振荡24 h,将离心管置于磁铁上,静置20 min,吸取上清液,按2.4项下方法检测溶液中花旗松素浓度。
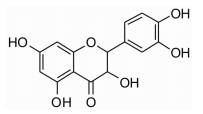
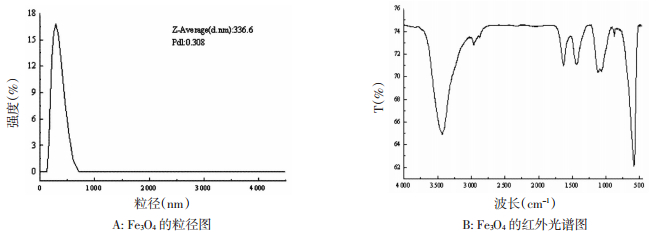
3 结果与讨论 3.1 Fe3O4的制备和表征利用红外光谱仪(FTIR)、动态光散射粒度仪(DLS)方法对Fe3O4进行表征。Fe3O4的粒径分布图,见图 2。由图 2A可见,Fe3O4的粒径大小主要集中在336.6 nm,分布系数(Pdl)为0.308,表明该体系为适中分散度的体系。Fe3O4的红外光谱图见图 2B,Fe3O4在590 cm-1处为Fe-O-Fe键的特征吸收峰,可以判断产物为Fe3O4。在3 436 cm-1处的吸收峰是由O-H的伸缩振动产生的,在1 650 cm-1处的吸收峰是由O-H的弯曲振动产生的,说明Fe3O4表面存在一些-OH基团。
|
| 图 2 Fe3O4的形态表征 |
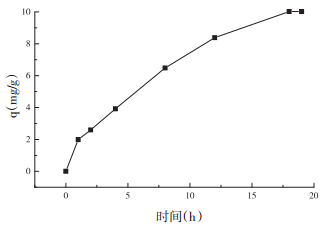
本实验研究了Fe3O4对花旗松素的吸附时间曲线。从图 3中可以看出,Fe3O4对花旗松素的吸附容量随着时间的增加而增大,在18 h时达到最大吸附平衡。
|
| 图 3 在298 K温度条件下,吸附时间对花旗松素吸附的影响 |
为了考察吸附过程的特性,用准一级动力学方程和准二级动力学方程描述吸附花旗松素的动力学特征。其相应线性形态如下:
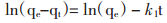
|
(1) |
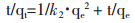
|
(2) |
式中,qe(mg/g)和qt(mg/g)分别为吸附平衡和吸附时间t时的单位吸附剂吸附花旗松素的量(mg/g)。k1(1/min) 与k2[g/(mg/min)]分别代表准一级和准二级速率常数。表给出了准一级和准二级动力学模型拟合的动力学参数和相关系数。可见准一级动力学模型的r值远高于准二级动力学模型,而且依据准二级模型计算的qe值与实验值较接近。见表 1。
| 准一级动力学 | 准二级动力学 | |||||
| k1(h-1) | qe(mg/g) | r | k2[g (/mg·h)] | qe(mg/g) | r | |
| 0.125 9 | 9.681 3 | 0.999 0 | 0.014 6 | 12.500 0 | 0.939 5 | |
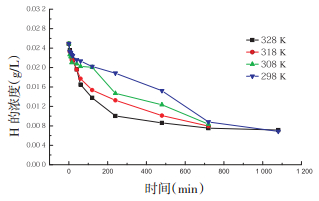
不同温度条件下,溶液中花旗松素溶液剩余浓度的变化曲线结果见图 4。
|
| 图 4 温度对吸附过程的影响 |
吸附过程的热力学参数如吉布斯自由能(ΔGθ)、焓变(ΔHθ)和熵变(ΔSθ)可以由以下公式计算得出。
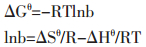
|
式中,R为气体常数[8.314 J/(mol·K)],b为Langmuir吸附常数。ΔHθ和ΔSθ可以从lnb对1/T作图的曲线斜率和截距计算得到,热力学参数列于表 2中,负的ΔGθ值表明Fe3O4对花旗松素是在有利和自发的状况下进行的。吸附过程中的ΔSθ和ΔHθ值分别为66.24 J/(mol·K)和6.58 kJ/mol。ΔSθ > 0说明反应是不可逆的,解吸附不易发生;ΔHθ>0表明吸附为吸热过程,且该值在-20~40 kJ/mol,可判断为物理吸附。Yue等[17]测定了吸附中可能存在的相互作用力,即范德华力4~10 kJ/mol,氢键结合力2~40 kJ/mol,配位体交换力约40 kJ/mol,偶极力2~29 kJ/mol,化学键力大于60 kJ/mol,根据实验结果计算ΔHθ,发现该材料吸附的过程中,存在着范德华力、氢键结合力及其他相互作用力。
以溶液中花旗松素浓度与初始浓度比值(Ct/C0)的对数ln(Ct/C0)为纵坐标,用时间(t)为横坐标作图,可以看出:在吸附花旗松素的反应过程中,ln(Ct/C0)与t之间呈负线性相关。这是一级反应的特征。因此,Fe3O4对水溶液中的花旗松素的吸附过程符合一级反应动力学过程。可以用ln(Ct/C0)=-k·t+B来表示,其中k为反应速率常数,B是与溶液浓度有关的积分常数。经过数据拟合计算得各温度条件下的拟合曲线。以1/T为横坐标,lnk为纵坐标作图,并进行线性拟合得lnk=-987.48/T-3.473 9,线性相关系数r=0.979 2。根据阿仑尼乌斯公式,lnk=-Ea/RT+B,可得吸附反应活化能为Ea=8.21 kJ/mol。见表 2。
| 温度(K) | b/(L·mg) | ΔGθ(kJ/mol) | ΔSθ[J/(mol·K)] | ΔHθ(kJ/mol) | k | B | r | Ea (kJ/mol) |
| 328 | 0.260 4 | -15.168 | 66.24 | 6.58 | 0.001 5 | -0.114 4 | 0.996 3 | 8.21 |
| 318 | 0.236 5 | -14.451 | 0.001 4 | -0.147 2 | 0.995 3 | |||
| 308 | 0.220 4 | -13.816 | 0.001 3 | -0.106 2 | 0.997 6 | |||
| 298 | 0.203 4 | -13.168 | 0.001 1 | -0.083 6 | 0.995 3 |
采用Freundlich等温吸附模型研究Fe3O4对花旗松素的吸附行为。Freundlich等温模型基于异相表面上的多层吸附,如式所示:

|
式中,KF和n是对应于吸附容量和吸附强度的Freundlich常数。
在298、308、318、328 K不同温度下,等温模型的拟合结果见表 3。结果表明,采用Freundlich等温方程拟合后的线性相关系数见图 5。
| 温度(K) | KF(mg/g) | n | r |
| 328 | 0.550 6 | 0.996 5 | 0.996 8 |
| 318 | 0.564 5 | 1.023 3 | 0.999 4 |
| 308 | 0.568 9 | 1.030 0 | 0.964 4 |
| 298 | 0.645 8 | 1.163 3 | 0.995 3 |
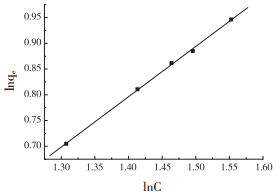
|
| 图 5 Freundlich等温拟合相关系数 |
溶液中的离子可能改变溶液中的静电引力和扩散作用,从而影响吸附过程。为了更全面地了解吸附过程中的影响因素,实验考察了NaCl离子浓度对Fe3O4吸附花旗松素的饱和吸附量的影响。结果如图 6所示,水溶液中无离子存在时,吸附量达最大值,存在一定量的NaCl离子会影响吸附,但是与离子浓度无明显相关性。离子强度对吸附过程的影响较小,表明花旗松素与Fe3O4吸附时形成的作用力远大于表面静电作用力。
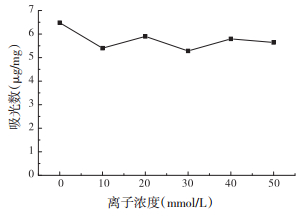
|
| 图 6 NaCl离子浓度对吸附量的影响 |
溶剂是吸附过程的一个重要因素,为了优化吸附条件,本实验以不同浓度的乙醇水溶液为考察对象,比较不同溶剂对Fe3O4吸附花旗松素的饱和吸附量影响。如图 7所示,在纯水溶液条件下,饱和吸附量达到最大。
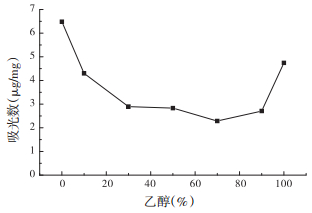
|
| 图 7 乙醇浓度对吸附量的影响 |
黄酮类化合物是一类多酚化合物,广泛存在于蔬菜水果以及药用植物中,毒副作用小,具有多种生理活性和药用价值[18-21]。本文以难溶性多羟基黄酮类化合物花旗松素为模型,Fe3O4作为吸附载体,考察了溶剂、温度、时间、浓度等因素对吸附性能的影响。通过动力学和热力学实验发现,Fe3O4吸附花旗松素为多层吸附,属吸热、自发的过程。同时,红外结果显示Fe3O4粒子表面存在羟基,吸附热力学也提示吸附过程中存在氢键作用力,可见吸附过程中Fe3O4粒子表面的羟基和花旗松素中的羟基形成了氢键。对溶剂和NaCl离子因素考察的结果显示,在纯水溶液中吸附量达最大值,溶液中加入NaCl离子和一定浓度的乙醇均会吸附性能产生负面影响。而传统中药多采用纯水作为提取溶剂,考虑Fe3O4适合从中药提取液中进行中药成分的吸附和分离。此外,该材料合成方法简便、费用低、原料易得,并且通过外加磁场即可实现吸附载体与原料液的快速分离,整个分离过程省时省力,操作简单易控。综上所述,Fe3O4有望成为中药水提液中难溶性多羟基黄酮类化合物的吸附物质,继而作为中药难溶性多羟基黄酮类化合物快速分类的材料。
| [1] | 王明华, 王辰, 高云涛, 等. 花旗松素的电化学行为及其测定的研究[J]. 药物分析杂志, 2010, 30(3): 534–537. |
| [2] | Kandaswami C, Perkins E, Soloniuk DS, et al. Antiproliferative effects of citrus flavonoids on a human squamous cell carcinoma in vitro[J]. Cancer Lett, 1991, 56(2): 147–152. DOI:10.1016/0304-3835(91)90089-Z |
| [3] | Makena PS, Pierce SC, Chung KT, et al. Comparative mutagenic effects of structurally similar flavonoids quercetin and taxifolin on tester strains Salmonella typhimurium TA102 and Escherichia coli WP-2 uvrA[J]. Environ Mol Mutagen, 2009, 50(6): 451–459. DOI:10.1002/em.v50:6 |
| [4] | Plotnikow MB, Plotnikov DM, Aliev OI, et al. Hemorheological and antioxidant effects of Ascovertin in patients with sclerosis of cerebral arteries[J]. Clin Hemorheol Microcirc, 2004, 30(3-4): 449–452. |
| [5] | 程飞, 翟延君, 初正云, 等. 花旗松素对人宫颈癌Hela细胞形态及DNA片段的影响[J]. 中药材, 2011, 34(3): 441–442. |
| [6] | 付警辉, 柴婧, 韩佳彤, 等. 落叶松中花旗松素对酪氨酸酶的抑制作用[J]. 日用化学工业, 2014, 44(4): 218–221. |
| [7] | 乔华, 谢鋆, 张晓云. 花旗松素的生物活性及其应用[J]. 中草药, 2003, 34(8): 112–114. |
| [8] | 秦润华, 姜炜, 刘宏英, 等. Fe3O4纳米粒子的制备与超顺磁性[J]. 功能材料, 2007, 38(6): 902–903. |
| [9] | Wu W, He QG, Jiang CZ. Magnetic iron oxide nanoparticles:synthesis and surface functionalization strategies[J]. Nanoscale Res Lett, 2008, 11(3): 397–415. |
| [10] | 杜益群, 张东生, 倪海燕, 等. 肿瘤热疗用Fe3O4磁性纳米粒子的生物相容性研究[J]. 南京大学学报:自然科学版, 2006, 42(3): 324–330. |
| [11] | Chandna A, Batra D, Kakar S, et al. A review on target drug delivery:magnetic microspheres[J]. Journal of Acute Disease, 2013, 2(3): 189–195. DOI:10.1016/S2221-6189(13)60125-0 |
| [12] | Nielsen SE, Breinholt V, Justesen U, et al. In vitro biotransformation of flavonoids by rat liver microsomes[J]. Xenobiotica, 1998, 28(4): 389–401. DOI:10.1080/004982598239498 |
| [13] | Schoefer L, Mohan R, Schwiertz A, et al. Anaerobic degradation of flavonoids by Clostridium orbiscindens[J]. Appl Environ Microbiol, 2003, 69(10): 5849–5854. DOI:10.1128/AEM.69.10.5849-5854.2003 |
| [14] | Blaut M, Schoefer L, Braune A. Transformation of flavonoids by intestinal microorganisms[J]. Int J VitamNutr Res, 2003, 73(2): 79–87. DOI:10.1024/0300-9831.73.2.79 |
| [15] | Kim BG, Lee Y, Hur HG, et al. Flavonoid 3'-O-methytransferase from rice:cDNA cloning, characterization and functional expression[J]. Phytochemistry, 2006, 67(4): 387–394. DOI:10.1016/j.phytochem.2005.11.022 |
| [16] | Deng H, Li XL, Peng Q, et al. Mondisperse Magnetic Single-Crystal Ferrite Microspheres[J]. Anmqewandte Chemie International Edition, 2005, 44(18): 2782–2785. DOI:10.1002/(ISSN)1521-3773 |
| [17] | Yue QY, Li Q, Gao BY. Formation and characteristics of cationicpolymer/bentonitecomplexes as adsorbents for dyes[J]. Applied Clay Science, 2007, 35(3-4): 268–275. DOI:10.1016/j.clay.2006.09.008 |
| [18] | 于晶, 郝再彬, 苍晶, 等. 黄酮类化合物的活性研究进展[J]. 东北农业大学学报, 2008, 39(12): 125–130. |
| [19] | 刘娜, 王文平, 康倩, 等. 银杏叶黄酮类成分体外及经肠吸收后抗氧化活性比较[J]. 天津中医药, 2015, 32(1): 42–45. |
| [20] | 易文实. 黄酮类化合物的生物活性研究进展[J]. 广州化工, 2012, 40(2): 47–50. |
| [21] | 周新, 李宏杰. 黄酮类化合物的生物活性及临床应用进展[J]. 中国新药杂志, 2007, 16(5): 350–355. |
 2017, Vol. 36
2017, Vol. 36