文章信息
- 徐增梅徐增梅, 丁伟伟丁伟伟, 李泽庚李泽庚
- XU Zeng-mei, DING Wei-wei, LI Ze-geng
- 麻芍平喘汤对哮喘大鼠气道重塑及TGF-β1、PDGF-BB的影响
- The impact of the Mashao Pingchuan decoction to the airway remodeling of asthma rats and TGF-β1, PDGF-BB
- 天津中医药大学学报, 2017, 36(2): 123-127
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2): 123-127
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.02.12
-
文章历史
收稿日期: 2016-10-31
2. 安徽省中医院, 合肥 230031
2. Anhui Provincial Hospital of TCM, Hefei 230031, China
气道重塑是哮喘的重要病理特征之一,近年来大量研究表明,气道重塑一旦形成难以可逆, 目前临床上尚缺乏简单可行的检测和治疗方法, 所以气道重塑成为哮喘防治的难点和重点[1]。其主要病理学改变包括气道平滑肌增厚、基底膜增厚、胶原沉着、平滑肌细胞增生、肥大、炎症细胞浸润、黏液腺增生等。有研究认为,转化生长因子-β1(TGF-β1)是哮喘气道重塑的主要调控因子, 直接或间接的参与并促进哮喘的气道重塑,有促进纤维化的形成和抗炎作用,也可造成平滑肌细胞的永久性表型改变,使气道壁增厚,气道狭窄,通气受限[2]。哮喘发作时气道炎症细胞(嗜酸性细胞、巨噬细胞)和气道结构细胞(成纤维细胞、平滑肌细胞和上皮细胞)均可表达TGF-β1。关于血小板源性生长因子(PDGF)与哮喘气道重塑的最新研究较少。血小板源性生长因子BB型(PDGF-BB)作为PDGF家族中的主要成员之一,它能够增加气道成纤维细胞前胶原I的表达, 并且它的表达程度与肺功能负相关[3]。杜建新等[4]观察大鼠哮喘模型时,采用PDGF-BB中和抗体可显著抑制气道壁增厚和乙酰胆碱激发的持续性气道高反应性,但不能抑制炎性反应,提示PDGF-BB参与哮喘气道重塑。TGF-β1和PDGF是引起气道平滑肌细胞增殖的关键因子,两者异常均可导致气道平滑肌细胞的增殖而诱导气道重塑的发生。本实验通过观察中药麻芍平喘汤对致敏大鼠肺组织TGF-β1、PDGF-BB的蛋白表达和肺组织病理学的影响,探讨该药对哮喘气道重塑的作用。现将实验结果报道如下。
1 材料与方法 1.1 实验材料健康SD雄性大鼠70只,体质量180~220 g,由安徽省实验动物中心提供。许可证编号:SCXK(皖)2011-002。卵蛋白(OVA),美国Sigma公司。链酶素和素-生物复合素(SABC)免疫组化染色试剂盒、二氨基联苯胺(DAB)显色试剂盒,北京天来生物医学科技有限公司。山羊抗小鼠IgG,北京康为世纪生物科技有限公司。山羊抗兔IgG,北京中杉金桥。一抗,bioworld公司。JEM-1230型透射电子显微镜,日本产。徕卡2135型切片机,德国徕卡公司。麻芍平喘汤(麻黄10 g,细辛3 g,五味子9 g,钩藤12 g,赤芍7 g),由安徽中医药大学第一附属医院中药制剂室生产,按照浓度0.5 g/L制成溶液。阳和平喘颗粒,安徽省中医院院内制剂;醋酸地塞米松片,浙江仙琚制药股份有限公司。
1.2 动物分组、模型制备及标本采集模型制备参照文献[5]。雄性SD大鼠按随机数字表法随机分为正常组(A)、模型组(B)、麻芍平喘低剂量组(C)、麻芍平喘中剂量组(D)、麻芍平喘高剂量组(E)、地塞米松组(F)、阳和平喘组(G),每组10只。适应性喂食观察1周后,除正常对照组外,其余各组于实验的第0天、第7天和第14天, 以10%卵白蛋白加氢氧化铝10 mg,分3次在腹腔注射0.5 mL及两侧腹股沟皮下各0.25 mL 3点注射致敏。实验第21天, 将大鼠放入不完全封闭的玻璃雾化箱内,除正常对照组外的各组每日任动物自行吸入1%卵白蛋白生理盐水20 min左右,每日激发1次,诱发其哮喘发作。各组均从激发阶段的第7天开始给药,每次激发前30 min灌胃。C组、D组、E组分别灌胃3.69、7.38、14.76 g/kg,分别相当于成人日常治疗量的1、2、4倍,F组用地塞米松片0.5 mg(/ kg· d)灌胃、G组用6.4 g(/ kg·d)灌胃,A组和B组灌胃10 mL/kg生理盐水,各组灌胃,连续14 d。模型制备成功后,末次激发24 h后,予以6%水合氯醛6 mL/kg腹腔麻醉,打开腹腔取腹主动脉血之后,无菌打开胸腔,取右肺中叶置于10%甲醛固定,用于苏木精-伊红(HE)染色及免疫组化。
1.3 实验方法 1.3.1 HE染色大鼠右肺中叶置于10%甲醛中固定24 h以上,常规石蜡包埋,切片行HE染色。
1.3.2 气道形态学观察取HE染色图片, 以图像分析软件测定支气管基底周径(Pbm),总管壁面积(WAt)和平滑肌面积(WAm),并用Pbm将测量值标准化, 分别以WAt/Pbm,WAm/Pbm表示,代表支气管管壁厚度、平滑肌厚度(μm2/μm)。1.3.3免疫组化检测方法取部分肺组织中性甲酸固定,按链酶素和素-生物复合素(SABC)免疫组化染色试剂盒说明书操作。1)石蜡切片(厚度4 μm)脱水。2)使用新配制的3%双氧水(H2O2)溶液,室温条件灭活内源性酶持续5 min,自来水洗涤3 min并重复3次。3)热修复抗原,将切片置于0.01 mol/L的pH6.0拘椽酸钾缓冲液中,室温冷却10 min,重复操作1~2次。4)冷却后用磷酸盐缓冲液(PBS)洗涤2次。滴加正常山羊血清封闭液,室温保持20 min,除去多余液体。滴加适当的稀释一抗(l:50),于37 ℃保温1 h。PBS洗涤2 min并重复操作3次。5)于7 ℃保温20 min后,滴加试剂SABC,于37 ℃保温20 min。6)PBS洗5 min并重复操作4次。7)DAB显色, 室温显色7 min,结束后自来水洗涤。8)用苏木精素复染1 min。9)常规型脱水、透明、封片。10)显微镜拍照。
1.4 统计学分析光镜下观察各标本TGF-β1、PDGF-BB阳性染色情况,即每张切片在(×200)视野内选择阳性表达高的区域,计数5个视野(即0.l mm2),测定每个视野阳性表达区的积分光密度值,取其均值为TGF-β1、PDGF-BB的相对含量。数据统计分析采用SPASS19.0统计软件进行计算,多组间两两比较采用LSD-t法,结果以均数±标准差(x±s)表示,以P < 0.05为差异有统计学意义,P>0.05为无统计学意义。
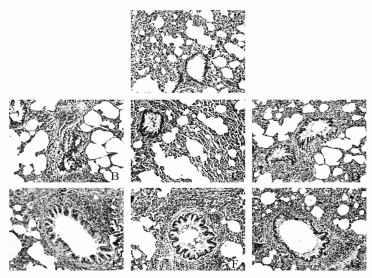
2 结果 2.1 大鼠病理学改变见图 1。镜下观察B组大鼠气道壁及气道平滑肌明显增厚,黏膜皱褶水肿增多,管腔狭窄,可见黏液栓堵塞,部分气道上皮细胞脱落,黏膜下及气管周有大量的炎性细胞浸润,以嗜酸粒细胞、浆细胞和淋巴细胞为主。E组、G组较上述的病理变化明显好转。F组与上述病理变化相比亦有改善。D组病理改变介于C组和E组之间。A组几乎无上述病理变化。
|
| 图 1 大鼠各组病理学变化 A:正常组;B:模型组;C:麻芍低剂量组;D:麻芍中剂量组;E:麻芍高剂量组;F:地塞米松组;G:阳和平喘组 |
根据医学图像分析软件进行指标测量分析,分别测量Pbm、WAt、WAm,并用Pbm将测量值标准化, 分别以WAt/ Pbm, WAm/ Pbm表示支气管管壁厚度和平滑肌厚度。实验结果显示,各药物干预组支气管管壁厚度和平滑肌厚度与模型组比较差异有统计学意义(P < 0.05),见表 1。
| μm2/μm | |||
| 组别 | n | WAt/Pbm | WAm/Pbm |
| A组 | 10 | 18.95±1.81 | 3.55±0.85 |
| B组 | 10 | 29.24±0.96* | 8.74±1.41* |
| C组 | 10 | 26.53±0.95# | 5.46±0.84# |
| D组 | 10 | 23.58±1.18# | 5.54±0.71# |
| E组 | 10 | 18.61±0.58#△▲ | 3.44±0.46#△▲ |
| F组 | 10 | 19.86±0.68# | 4.33±0.30# |
| G组 | 10 | 18.22±0.22#△ | 3.37±0.64#△ |
| 注:与正常组相比,*P < 0.01;与模型组相比,#P < 0.05;与地塞米松组相比,△P < 0.05;与阳和平喘组比较,▲P>0.05。 | |||
TGF-β1、PDGF-BB免疫组化反映阳性细胞的部位主要在气道上皮细胞、平滑肌细胞和肺泡上皮细胞等。各组TGF-β1、PDGF-BB阳性反应强弱不同,阳性染色情况亦有差异:模型组最强呈深棕色,阳性表达最明显;药物组阳性稍弱,渐呈棕黄色至浅黄色;正常组阳性反应进一步减弱,呈淡浅黄色。见表 2。
| 组别 | n | TGF-β1平均光密度 | PDGF-BB平均光密度 |
| A组 | 6 | 0.32±0.05 | 0.33±0.01 |
| B组 | 6 | 0.58±0.07* | 0.55±0.03* |
| C组 | 6 | 0.46±0.05# | 0.40±0.03# |
| D组 | 6 | 0.40±0.08# | 0.38±0.03#△ |
| E组 | 6 | 0.34±0.03#△▲ | 0.25±0.04#△▲ |
| F组 | 6 | 0.49±0.07# | 0.37±0.03# |
| G组 | 6 | 0.48±0.08#△ | 0.30±0.03# |
| 注:与正常组相比,*P < 0.01;与模型组相比,#P < 0.01;与地塞米松组相比,△P < 0.05;与阳和平喘相比,▲P < 0.01。 | |||
从表 2中可以看出,大鼠肺组织TGF-β1阳性表达区的平均光密度值:模型组与其他各组比较差异有统计学意义(P < 0.01),地塞米松组与麻芍高剂量及阳和平喘组大鼠肺组织TGF-β1的平均光密度值相比差异有统计学意义(P < 0.01),麻芍高剂量组与阳和平喘组比较差异有统计学意义(P < 0.01)。
大鼠肺组织PDGF-BB的平均光密度值:模型组与其他各组比较均有显著性差异(P < 0.01)。
3 讨论近年来研究发现,仅仅用气道炎症不足以解释哮喘病程的慢性进行性发展,对于哮喘气道壁重塑本质的研究日益受到重视。气道炎症和气道重塑是哮喘的两个重要的病理特征,呼吸道炎症的反复损伤和修复易导致哮喘气道的重塑,也是哮喘难治的重要原因。如白介素-6(IL-6)、白介素-8(IL-8)、细胞间黏附分子-1(ICAM-1)、TGF-β1、PDGF、肿瘤坏死因子、干扰素等,这些细胞因子能趋化炎症细胞进入气道,并在炎症的发生和发展过程中起到相应的作用[6]。对哮喘的治疗,目前临床上多是以吸入性糖皮质激素为主要药物,疗效可但不良反应大,而且尚有部分患者即使吸入激素仍无好转,其原因可能是已发生了气道重塑。因此,从气道重塑的调控因子入手,用药物干预这些细胞因子从而缓解气道重建,应是目前治疗难治性哮喘的一个新思路[7]。
TGF-β1的生物学效应十分广泛,包括调节多种细胞增殖和分化、促进细胞外基质形成、抑制免疫反应等,是目前所知最强的促纤维化因子之一,对气道壁增厚及纤维化的形成有直接影响,是导致哮喘气道重塑的主要调控因子[8]。TGF-β1可以促进气道平滑肌细胞、成纤维细胞的增殖,引起支气管下层增厚与胶原沉积,最终导致哮喘患者支气管狭窄[9]。其在正常环境下可促进组织修复和抑制炎症的进展;如果再次抗原刺激引起的气道慢性炎症, 会导致TGF-β1过度不断增加, 从而导致组织纤维化和慢性气道阻塞和气道重建[10]。赵欣欣等[11]亦认为TGF-β1不仅仅会刺激气道上皮细胞发生重塑,还会形成一个随TGF-β1刺激时间加长和剂量增加而逐渐加重气道重塑严重性的可能。Lee等[12]发现,通过调控TGF-β1信号通路的表达,可以改善气道重塑,减少平滑肌厚度。有研究认为PDGF-BB是一种纵所周知的有效的促细胞分裂剂,主要在巨噬细胞、内皮细胞、血管平滑肌细胞和神经细胞中表达,具有强烈的促进气道平滑肌增值、促进成纤维细胞的增生及胶原蛋白的合成作用。气道上皮损伤后PDGF释放增多,并能促进共培养体系中肌成纤维细胞增生,被认为与哮喘过程中气道平滑肌增生肥厚、气道痉挛及气道上皮纤维化有关[13]。转化生长因子-β、血管生成素-1均可抑制PDGF-BB的表达,且两者共同作用时,抑制作用更强[14]。杨季国等[15]研究认为,气道平滑肌细胞增殖的细胞内信号传导过程与PDGF-BB诱导有关,其可以通过激活哮喘ERK信号通路而诱发气道重塑。PDGF和TGF-β1可通过络氨酸蛋白激酶(PTK)活化ERK促进c-fos、cfun(两者均为ERK信号途经的下游底物)表达,从而刺激气道平滑肌的增生,进而诱发并加重哮喘气道重建[16]。因此,抑制TGF-β1和PDGF-BB的表达可阻止或减轻哮喘的气道重塑。
本课题组以中医理论为指导,经过长期的临床观察,采用疏风散邪的治疗原则,拟订麻芍平喘汤治疗哮喘。该方由麻黄、细辛、五味子、钩藤、赤芍组成,方中以麻黄为君,发汗散寒、宣肺平喘;细辛辛散温通,温肺化饮、五味子酸涩收敛,敛肺滋肾,共为臣药;佐以钩藤轻清疏泄之性,可清热透邪;赤芍清热凉血,诸药合用,可达化痰、降气、平喘之效。现代药理研究表明,麻黄能够缓解支气管平滑肌痉挛[17],以麻黄为主药的复方,如麻黄汤、射干麻黄汤、小青龙汤等具有诱导哮喘气道内嗜酸性粒细胞凋亡,减少血管渗出,从而减轻气道炎症呢个,降低气道高反应,机制可能与抑制p38MAPK蛋白的表达有关[18]。吴建兵等[19]认为,五味子-细辛药对的平喘活性部位为五味子挥发油和细辛挥发油,镇咳及祛痰活性部位可能为五味子挥发油、五味子水提液、五味子总酸、细辛挥发油。而五味子挥发油有较强的镇咳作用, 其镇咳效力是可待因的75%[20];赤芍所含的芍药苷具有镇静、抗炎止痛作用;钩藤可缓解气管痉挛,亦可明显抑制组胺所致的哮喘。本实验结果表明,哮喘大鼠的血清和肺组织中存在高水平的TGF-β1和PDGF-BB,而麻芍平喘汤可抑制其表达,其作用强度与剂量多少呈正相关。通过观察肺组织病理学发现,B组大鼠气道壁明显增厚,黏膜皱褶水肿增多,肺泡壁明显增厚、充血,管腔狭窄,黏膜下及气管周有大量的炎性细胞浸润。而使用麻芍平喘汤干预后上述病理表现得到缓解,其中E组和G组疗效优于F组。在测量气道形态学方面,E组能很好的减轻支气管管壁厚度和平滑肌厚度。通过本研究发现,麻芍平喘汤和地塞米松组疗效相当,提示麻芍平喘汤通过下调TGF-β1和PDGF-BB的蛋白表达,使大鼠Wat和Wam得到减轻,控制炎性细胞浸润,从而达到改善气道管腔狭窄和延缓气道重塑的目的。但其发挥作用的具体机制尚不清楚,有待进一步探讨。
| [1] | 朱艳芬, 宋泽庆. 哮喘小鼠气道重塑中平滑肌肌动蛋白的表达[J]. 中国免疫学杂志, 2011, 27(10): 934–941. DOI:10.3969/j.issn.1000-484X.2011.10.016 |
| [2] | 戴欢, 张维溪, 贺孝良, 等. 黄芪在哮喘大鼠气道重塑模型中对TGF-β1/Smad3信号通路的调控[J]. 中华中医药学刊, 2010, 28(12): 2494–2498. |
| [3] | 巩雪芳, 薄建萍. 生长因子与气道重塑-生长因子在支气管哮喘气道重塑过程中作用的新进展[J]. 中华哮喘杂志 (电子版), 2010, 4(5): 364–367. |
| [4] | 杜建新, 蒋悍东, 杜春华, 等. 血清血小板衍生生长因子叉头型基因3和基质金属蛋白酶9在支气管哮喘气道重塑中的意义[J]. 中国实用内科杂志, 2011, 31(9): 719–720. |
| [5] | 刘莉, 余可斐, 穆敬平, 等. 地塞米松对哮喘大鼠气道重建、肥大细胞及IL-10的影响[J]. 中华肺部疾病杂志:电子版, 2012, 5(1): 17–23. |
| [6] | 袁斌, 徐建亚, 于希忠, 等. 清肺口服液含药血清对小鼠肺上皮细胞TGF-β1及PDGF-BB mRNA基因表达的影响[J]. 中华中医药杂志, 2011, 26(1): 174–177. |
| [7] | 陈静, 赵文娟, 李玉卿, 等. TGF-β1、MMP-9在哮喘大鼠气道重建模型中的表达及丹参的干预作用[J]. 世界中医药, 2016, 11(3): 479–482. |
| [8] | Kenyon NJ, Ward RW, McGrew G, et al. TGF-β1 causes airway fibrosis and increased collagen Ⅰand Ⅲ mRNA in mice[J]. Thorax, 2003, 58(9): 772–777. DOI:10.1136/thorax.58.9.772 |
| [9] | 杨能力, 梁亚峰, 李吕崇. 姜黄素抑制大鼠气道平滑肌细胞TGF-β1表达的研究[J]. 中国现代医生, 2016, 54(19): 34–37. |
| [10] | 蔺鹏翔, 张焕萍, 张爱芝. TGF-β1对不同阶段哮喘模型大鼠气道平滑肌细胞增殖的作用[J]. 中国比较医学杂志, 2010, 20(7): 44–48. |
| [11] | 赵欣欣, 万力生, 李佳曦, 等. 基于TGF-β1/Smads信号通路中医药防治哮喘气道重塑研究进展[J]. 辽宁中医药大学学报, 2016, 18(1): 160–163. |
| [12] | Lee SY, Kim JS, Lee JM, et al. Inhaled corticosteroid prevents the thickening of airway smooth muscle in murine model of chronic asthma[J]. Pulm Pharmacol Ther, 2008, 21(1): 14–19. DOI:10.1016/j.pupt.2006.10.009 |
| [13] | 张朝蔷, 薄建萍, 李江波. 地塞米松对大鼠支气管哮喘气道重塑及PDGF-BB表达的影响[J]. 当代医学, 2010, 16(30): 10–11. DOI:10.3969/j.issn.1009-4393.2010.30.006 |
| [14] | 冒慧敏, 史大桌, 刘秀华. 血小板源性生长因子对血管平滑肌细胞效应的机制研究进展[J]. 生理科学进展, 2015, 46(5): 359–364. |
| [15] | 杨季国, 马慧娟, 徐缨, 等. 平喘Ⅰ号对呼吸道合胞病毒哮喘大鼠气道重塑PDGF-B与ERK信号通路的影响[J]. 中华中医药学刊, 2014, 32(11): 2697–2699. |
| [16] | Henderson WRr, Chi EY, Teo JL, et al. A small molecule inhibitor of redox-regulated NF-kaPPaB and activator Protein-1 transcription blocks allergic airway inflammation in a mouse asthma model[J]. J Immunol, 2002, 169: 5294–5299. DOI:10.4049/jimmunol.169.9.5294 |
| [17] | 高晔珩, 党力纳. 麻黄研究进展[J]. 陕西中医学院学报, 2003, 26(6): 60–61. |
| [18] | 许杰红, 曹厚然, 陈玉兴. 中药单剂炙麻黄、麻黄对哮喘大鼠气道炎症反应的影响[J]. 新中医, 2014, 46(12): 197–199. |
| [19] | 吴建兵, 诸襄萍, 张永煜, 等. 五味子-细辛药对抗哮喘活性部位筛选[J]. 中华中医药学刊, 2013, 31(1): 121–123. |
| [20] | 王文燕, 陈建光. 五味子的药理作用及开发研究[J]. 北华大学学报:自然科学版, 2007, 8(2): 128–133. |
 2017, Vol. 36
2017, Vol. 36