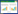文章信息
- 陈贵兵陈贵兵, 李荣李荣, 夏绍友夏绍友
- CHEN Gui-bing, LI Rong, XIA Shao-you
- 蟾皮华蟾毒配基组分体外对肿瘤及正常细胞株的抑制作用
- Inhibitory effect of cinobufagin fraction of the skin of Bufo bufo gargarizans cantor on tumor and normal cell lines in vitro
- 天津中医药大学学报, 2017, 36(2): 128-131
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2): 128-131
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.02.13
-
文章历史
收稿日期: 2016-10-21
2. 解放军总医院普通外科, 北京 100853
2. Department of General Surgery, General Hospital of PLA, Beijing 100853, China
蟾皮(中华大蟾蜍的干燥皮)性辛、凉,微毒,主治痈疽肿毒,临床上被广泛用于治疗肿瘤及心脏病等疾病[1-2]。尽管其对多种肿瘤具有治疗作用,但是也表现出明显的毒副作用[3]。为了解决疗效与毒副作用之间的矛盾,尝试在组分中药理论指导下采用高效液相色谱法分离纯化蟾皮的蟾蜍二烯内酯类化合物的活性组分,经过前期工作已完成组分分离纯化及部分组分的活性筛选[4-7]。本文将在已有工作基础上进一步研究蟾皮第18组分(F18)的化学成分及其在体外对肿瘤和正常细胞株的抑制作用。
1 材料和方法 1.1 仪器与试剂酶标分析仪(北京普朗)、流式细胞仪(美国BD公司)、质谱仪(美国Agilent公司)。噻唑蓝(MTT,美国Sigma公司)、细胞周期试剂盒、CCK-8试剂盒(南京凯基生物)、RPMI-1640、DMEM培养基(美国Sigma公司);蟾皮蟾蜍二烯内酯类系列组分由中国科学院大连化物所提供。
1.2 细胞株人结直肠腺癌SW480、SW620细胞株、人胃腺癌BGC823细胞株和小鼠结肠癌C26、CT26细胞株、小鼠乳腺癌4T1细胞株由解放军总医院普外研究所保存;人正常肝细胞L02细胞株购于中科院上海生化细胞所。人细胞因子诱导性杀伤T细胞(CIK细胞)参照已有方法分离培养获得[8]。
1.3 药液配制将已分离纯化的蟾皮F18经甲醇充分溶解,过0.22 μm滤膜,待质谱分析。另外,称取适量蟾皮F18以二甲基亚砜(DMSO)溶解,待组分充分溶解后,用无血清培养液配制贮存液并用0.22 μm过滤器除菌后,-20 ℃避光保存,控制DMSO终浓度小于0.05%。
1.4 质谱条件离子源:电喷雾正离子模式(+ESI);多反应检测(MRM)模式;喷雾电压4 000 V,碎裂电压175 V,雾化气压276 kPa,扫描质量范围:m/z 200~800。
1.5 细胞培养人SW480、SW620、BGC823细胞株和L02细胞株使用高糖DMEM(含10%FBS)完全培养基培养,小鼠C26、CT26、4T1细胞株使用RPMI-1640(含10%FBS)完全培养基培养(恒温培养箱条件37 ℃、5% CO2),取对数生长期细胞进行实验或冻存。人CIK细胞参照文献方法获得[8],实验前经台芬蓝染色计数确定活细胞数>90%。
1.6 MTT检测F18对细胞增殖的影响选取对数生长期SW480、SW620、BGC823、C26、CT26和4T1细胞,分别消化后调整细胞浓度为2×105/mL;L02细胞浓度调整至5×105/mL;CIK细胞调整细胞浓度至2×106/mL。以上细胞分别接种至96孔培养板(100 μL /孔,留空白对照孔)。培养24 h吸弃培养基再加入不同浓度的待测药物,同时每孔补充相应新鲜培养基200 μL,并对CIK细胞补液时同时加入白细胞介素(IL-2)1 000 U/mL。实验分为空白对照组、无药对照组、6个浓度梯度(0.02、0.1、0.5、1、2、12 mg/L)药物组,每组均设3个复孔。培养72 h后,每孔加入20 μL MTT溶液(浓度5 g/L),继续培养4 h,小心吸弃上清液(CIK细胞弃液前需平板离心1 500 r/min,5 min),每孔加入150 μL DMSO,摇床避光震荡10 min。在酶标分析仪492 μm处测定各孔的吸光度A492值。实验重复3次。按下例公式计算细胞增殖抑制率:
抑制率=[1-(药物组A值-空白对照组A值)/(无药对照组A值-空白对照组A值)]×100%
1.7 CCK-8法检测F18对3种细胞体外存活的影响选择对数生长期SW620、L02、CIK3种细胞,按照上述方法接种至96孔板,培养24 h后加入蟾皮F18 2 mg/L,每组设3个复孔。分别于加药后第1、3、5天取相应96孔板进行CCK-8检测,每孔加入10 μL CCK-8试剂检测溶液,置于37 ℃孵育4 h,在酶标分析仪450 μm波长处检测各孔的吸光度A450值。实验重复3次。按下例公式计算细胞存活率:
细胞存活率=(药物组A值-空白对照组A值)/(无药对照组A值-空白对照组A值)×100%
1.8 流式细胞术检测F18对SW620细胞周期的影响选择指数生长期SW620细胞消化后以5×106/孔接种于6孔板,培养24 h。实验组给予F18 2 g/L处理后,继续培养24 h,弃上清,消化收集贴壁细胞。然后按试剂盒说明操作,在上机前200目网筛过滤1次,检测记录488 μm波长处红色荧光。
1.9 统计分析采用SPSS 21.0统计软件进行数据分析。计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间比较选用LSD法,半数抑制浓度(IC50)由Probit分析计算获得。P < 0.05认为差异有统计学意义。
2 结果 2.1 蟾皮F18的化学成分鉴定通过分析质谱图的精确质荷比(m/z)以及一级高分辨质谱提供的精确分子量信息,并与文献比较[9-12],推测出蟾皮F18主要化学成分可能为华蟾毒配基(Cinobufagin),故将蟾皮F18命名为蟾皮华蟾毒配基组分(CFSB)。见图 1。
|
| 图 1 蟾皮F18的质谱图 |
随CFSB浓度增加肿瘤细胞和正常细胞生长均受到抑制,见表 1。从CFSB干预8种细胞IC50值的结果显示人肿瘤细胞SW480、SW620、BGC823增殖最易受影响,其IC50值均小于2 mg/L,而小鼠肿瘤细胞C26、CT26、4T1的IC50值均大于20 mg/L。人L02、CIK的IC50值约为人SW480、SW620、BGC823的2~4倍。另外,从表 1可见人源细胞株对CFSB的敏感性明显高于鼠源细胞株。
| % | ||||||||
| 细胞 | n | 浓度梯度(mg/L) | IC50值(95%CI) (mg/L) |
|||||
| 0.02 | 0.1 | 0.5 | 1 | 2 | 12 | |||
| SW480 | 3 | 7.40±0.48 | 13.74±2.02 | 37.03±3.16 | 52.44±2.47 | 64.11±3.73 | 74.97±2.63 | 1.10(00.68~01.77) |
| SW620 | 3 | 6.27±1.50 | 13.99±2.04 | 36.07±3.95 | 51.17±2.74 | 66.03±2.21 | 72.83±4.79 | 1.15(00.72~01.87) |
| BGC823 | 3 | 5.96±1.11 | 12.21±2.33 | 29.77±2.66 | 43.50±4.47 | 62.04±1.95 | 70.44±2.69 | 1.55(00.96~02.53) |
| C26 | 3 | 0.11±0.11 | 0.14±0.16 | 1.73±1.19 | 7.03±2.00 | 20.13±2.65 | 44.89±3.88 | 21.22(11.11~42.98) |
| CT26 | 3 | 0.03±0.06 | 0.06±0.06 | 1.40±0.46 | 6.67±1.53 | 9.83±2.53 | 41.40±3.42 | 31.39(15.65~67.26) |
| 4T1 | 3 | 0.07±0.12 | 0.15±0.16 | 1.83±0.38 | 4.00±2.00 | 22.73±2.68 | 46.59±3.50 | 20.75(10.88~41.94) |
| L02 | 3 | 0.05±0.06 | 0.20±0.13 | 11.70±3.52 | 39.30±3.04 | 40.60±1.45 | 57.83±2.57 | 4.85(02.88~08.42) |
| CIK | 3 | 0.01±0.10 | 0.10±0.10 | 16.30±4.86 | 52.44±2.47 | 52.73±3.16 | 69.07±3.69 | 2.63(01.60~04.42) |
CFSB在不同时间点对3种细胞存活率的影响,见表 2。CFSB对3种细胞的杀伤作用呈现时间依赖性;与SW620比较,在第3天时CFSB对L02细胞的存活影响较小(P= 0.001)。随时间延长CFSB对L02细胞的杀伤性逐渐强于SW620细胞(P=0.021)。而CIK细胞与SW620比较无明显差异。
| % | ||||
| 细胞 | n | 第1天 | 第3天 | 第5天 |
| SW620 | 3 | 83.83±4.09 | 40.97±2.00 | 29.20±2.57 |
| L02 | 3 | 82.30±3.22 | 58.77±3.01* | 21.63±2.47* |
| CIK | 3 | 77.30±3.63 | 46.97±3.15 | 28.43±1.94 |
| 注:与SW620比较,*P < 0.05。 | ||||
从细胞周期图可见CFSB对SW620细胞的周期有明显影响,见图 2。与对照组比较,CFSB组SW620的S期、G2/M期细胞比例增加,分别由36.41%增至55.73%、10.89%增至16.95%。以上结果说明CFSB主要作用在细胞周期的S-G2/M阶段。
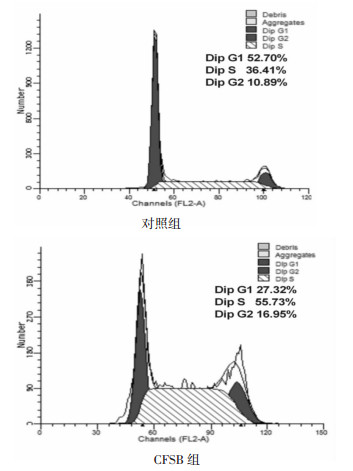
|
| 图 2 CFSB对SW620细胞周期的影响 |
组分中药学是近年来为促进中药现代化在传统中药理论基础上发展而来的新理论[13]。蟾皮所含化合物众多,利用中药组分理论对其主要活性物蟾蜍二烯内酯类化合物分离纯化出不同组分,通过一系列组分活性筛选,确定出蟾皮F18具有抗肿瘤和免疫调节作用,但是未能明确其具体化合物以及对正常细胞的影响[5-6]。为此,通过质谱检测初步分析出蟾皮F18的主要化合物华蟾毒配基、去乙酰基华蟾毒配基。尽管在实验中未应用标准化合物进行参照及确认,但是参考已有文献可以初步判断质谱中分子量所对应的化合物[9-12]。然而,从质谱图中可以看出该组分的混杂化合物较多,据中药组分分离思想(指导药效筛选指导组分细化),在初步确定该组分有应用价值的基础上,在后续实验中进一步细化组分构成并完善化合物确认。
通过IC50值可以初步评估,当1 mg/L时,CFSB对SW480、SW620细胞的抑制已达敏感范围。但前期筛选结果认为0.5 mg/L时即已达敏感范围[5],这可能因肿瘤细胞种类不同造成结果不一致性。另外,由于之前实验浓度梯度少,未能更深入分析IC50值进而造成结果可能有一定偏倚。
CFSB对细胞存活率的影响中总结出其在一定时间范围内对肿瘤及正常细胞(尤其L02细胞)的作用有明显区别。例如L02细胞第5天存活率较第3天急剧下降,可能与正常细胞代谢代偿障碍有关,也可能正常细胞长期处于CFSB毒性环境下,细胞代谢及增值减弱。而肿瘤细胞的耐受性强于正常细胞,以至于第5天存活率高于正常细胞。
通过对CFSB干预的SW620细胞周期检测,发现CFSB主要干扰SW620细胞的S期和G2/M期,说明干扰了DNA的合成及细胞分裂。已有研究证实蟾皮成分能干扰肿瘤细胞S期和G2/M期[14-15]。通过细胞周期分析初步了解了CFSB作用于肿瘤细胞的机制。
通过本研究初步明确了CFSB的主要化合物以及其对肿瘤细胞和正常细胞的抑制作用。发现CFSB对L02、CIK有一定毒性。以上结果为预通过组分中药配伍进一步对CFSB实现增效减毒奠定了基础。
| [1] | 曹伟, 刘聪燕, 陈彦, 等. 蟾皮活性组分的分离与体外抗肿瘤活性考察[J]. 中国实验方剂学杂志, 2013, 19(24): 17–20. |
| [2] | 何国平. 蟾皮中抗肿瘤小分子化合物的获取和抗肿瘤作用机制的研究[D]. 上海: 第二军医大学, 2009. |
| [3] | 于垂亮, 侯惠民. 蟾酥抗肿瘤有效成分的活性追踪分离及急性毒性研究[J]. 中草药, 2011, 42(2): 307–311. |
| [4] | Li X, Guo Z, Wang C, et al. Purification of bufadienolides from the skin of Bufo bufo gargarizans Cantor with positively charged C18 column[J]. J Pharm Biomed Anal, 2014, 92: 105–113. DOI:10.1016/j.jpba.2014.01.002 |
| [5] | 邹振玉. 蟾皮抗肿瘤活性组分筛选及荷人结肠癌裸鼠淋巴道化疗的实验研究[D]. 北京: 中国人民解放军医学院, 2013. |
| [6] | 陈贵兵. 复方蟾皮组分注射液的制备及治疗结肠癌的实验研究[D]. 天津: 南开大学, 2015. |
| [7] | Li X, Liu Y, Shen A, et al. Efficient purification of active bufadienolides by a class separation method based on hydrophilic solid-phase extraction and reversed-phase high performance liquid chromatography[J]. J Pharm Biomed Anal, 2014, 97: 54–64. DOI:10.1016/j.jpba.2014.04.015 |
| [8] | 陈贵兵, 徐迎新, 梁凯, 等. 雷公藤生物碱系列组分对人CIK、HCT116及HepG2细胞的增殖抑制作用[J]. 现代中医药, 2014, 34(3): 76–78. |
| [9] | Ye M, Guo DA. Analysis of bufadienolides in the Chinese drug ChanSu by high-performance liquid chromatography with atmospheric pressure chemical ionization tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2005, 19(13): 1881–1892. DOI:10.1002/(ISSN)1097-0231 |
| [10] | 曹阳, 梁琼麟, 章弘扬, 等. 中药复方六神丸中多类成分的多维液质系统筛查和鉴定[J]. 分析化学, 2008, 36(1): 39–46. |
| [11] | 王薇, 刘明东, 颜有仪, 等. 高效液相色谱-串联质谱法测定肝组织中华蟾酥毒基和酯蟾毒配基[J]. 法医学杂志, 2013, 29(4): 268–272. |
| [12] | 陈建新, 邓洁薇, 陈红, 等. 高效液相色谱-静电场轨道阱质谱鉴定大鼠血浆中蟾蜍二烯内酯及其代谢物[J]. 分析化学, 2011, 39(12): 1858–1863. |
| [13] | Zhang X, Liu Y, Guo Z, et al. The herbalome-an attempt to globalize Chinese herbal medicine[J]. Anal Bioanal Chem, 2012, 402(2): 573–581. DOI:10.1007/s00216-011-5533-y |
| [14] | Xie RF, Li ZC, Gao B, et al. Bufothionine, a possible effective component in cinobufocini injection for hepatocellular carcinoma[J]. J Ethnopharmacol, 2012, 141(2): 692–700. DOI:10.1016/j.jep.2011.12.018 |
| [15] | Lee DY, Yasuda M, Yamamoto T, et al. Bufalin inhibits endothelial cell proliferation and angiogenesis in vitro[J]. Life Sci, 1997, 60(2): 127–134. |
 2017, Vol. 36
2017, Vol. 36