文章信息
- 张培丽张培丽, 陈雪香陈雪香, 王群王群, 刘果刘果, 张泳张泳, 杨异杨异, 曹庸曹庸
- ZHANG Pei-li, CHEN Xue-xiang, WANG Qun, LIU Guo, ZHANG Yong, YANG Yi, CAO Yong
- 桑葚多糖T3-3分离及秀丽隐杆线虫抗衰老活性研究
- Optimization of the extracting parameters of mulberry polysaccharide and its anti-aging activity study
- 天津中医药大学学报, 2017, 36(2): 136-141
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2): 136-141
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.02.15
-
文章历史
收稿日期: 2016-10-30
秀丽隐杆线虫(简称秀丽线虫)生命周期短,与其寿命相关的遗传和环境背景较清晰,非常适合进行衰老干预效果的评价和机制研究[1-2]。目前,对秀丽线虫衰老的研究逐渐超过了果蝇和小鼠,成为抗衰老研究的首选生物模式[3-5]。Chuang等人[6]发现灵芝多糖经TIR-1受体和MAPK通道,可以激活寿命相关因子DAF-16的表达,大大延长了秀丽线虫的寿命。
根据本课题组前期从对细胞氧化损伤保护作用的角度,研究利用桑葚多糖T2分离纯化得到的组分T3-1、T3-2、T3-3、T3-4的抗氧化性结果,表明600 mg/L的T3-3对PC-12细胞氧化损伤具有最强保护作用[7]。基于前期研究基础,采用秀丽线虫为动物模型来探究T3-3组分的抗衰老活性以确定桑葚多糖的功能成分,为其日后在医药及保健品行业中的运用研究提供理论依据。
1 材料与方法 1.1 实验材料桑葚果实,购自浙江江山(烘干,粉碎备用)。N2野生型秀丽线虫,雌雄同体,由北京生命科学研究所惠赠。大肠杆菌OP50,由华南农业大学资环学院惠赠。
1.2 药品与试剂葡萄糖、无水乙醇、苯酚、硫酸、硫酸镁、氯化钙、磷酸二氢钾、磷酸氢二钠、磷酸氢二钾、胰蛋白胨、琼脂粉、氯化钠、甘油、次氯酸钠、氢氧化钠、考马斯亮蓝G-250等均为国产分析试剂;DEAE-52纤维素,英国Whatman公司,参照说明书进行预处理;3500 Da透析袋,广州威佳科技有限公司;结晶体牛血清白蛋白,美国Sigma公司。
1.3 主要仪器BinderFD热风循环烘箱,Binder公司;BS200S电子天平,德国Sartorous;F-90粉碎机,浙江台州粮仪厂;HH-S数显恒温水浴锅,江苏省金坛市医疗仪器厂;KDC-40低速离心机,安徽科大创新股份有限公司;SHZ-D真空泵,深圳瑞鑫达仪器有限公司;R204B3旋转蒸发器,上海申生科技有限公司;UV3010紫外可见分光光谱仪,日本日立高科技公司;FD-1冷冻干燥机,北京博医康技术公司;Φ2.6×40 cm层析柱,上海精科实业有限公司;Gl6-2二氧化碳恒温培养箱,美国Shellab公司;LRH生化培养箱,上海一恒科技有限公司;TTL-16B高速台式离心机,上海安亭科学仪器厂;YSQ-LS-18SI不锈钢手提式压力蒸汽灭菌器,上海博速实验有限公司医疗设备厂;SW-CJ-2FD双人单面净化工作台,苏州净化设备有限公司;HQ45恒温摇床,中国科学院武汉科学仪器厂。
2 实验方法 2.1 桑葚预处理和提取桑葚半干品→60 ℃烘干、粉碎→过60目筛→桑葚样品→100 ℃,1:30料液比,浸提2 h,提取3次→离心除渣(4 000 r/min,20 min)→乙醇沉淀(1:3,6 h,4 ℃)→离心、留沉淀(4 000 r/min,20 min)→干燥→定容→T2→测定多糖。
2.2 桑葚多糖提取工艺研究单因素实验:研究不同浸提温度(40、80、100 ℃)、浸提时间(1、2、3、4 h)、料液比(1:10、1:30、1:50)和浸提次数(1、2、3、4次)等单因素对桑葚多糖提取率的影响。正交实验:在单因素实验的基础上进行正交设计实验,优化桑葚多糖的提取工艺[8]。
2.3 桑葚多糖含量的测定1)总糖含量苯酚-硫酸法测定[9-10]。标准曲线回归方程为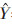
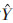
对桑葚多糖T2用质量分数为4%的硫酸锌(ZnSO4)盐析法去除桑葚多糖T2中的蛋白质,从而得到T3,然后将T3过DEAE-52纤维素层析柱,装柱方法参照文献方法[12]。层析柱中填料高度30 cm,0、0.1、0.3、0.5、1 mol/L氯化钠(NaCl)溶液梯度洗脱,流速2.5 mL/min,每1管收集10 mL。收集0.3 mol/L NaCl溶液洗脱得到的峰,经透析后冻干备用得桑甚多糖T3-3。
2.5 桑甚多糖T3-3抗衰老活性用M9缓冲溶液将年轻成虫洗至无菌EP管中,加适量裂解液裂解秀丽线虫,离心(3 000 r/min,1 min)弃上清液,重复2次,用移液枪吸取秀丽线虫沉淀滴于NGM无菌区,约48 h后裂解的秀丽线虫体内的受精卵基本发育成L4期幼虫,完成同步化。
2.6 寿命、吞咽频率、产卵量、肠脂褐质测定采用上述实验设定5组进行测定。
2.6.1 寿命测定按同期化方法处理秀丽线虫,挑取同期化的L4秀丽线虫到各组培养基中,每组60条,每板15条,20 ℃培养。秀丽线虫存活天数从转移时刻起开始计算,转移当天记为寿命实验第0天,注意在产卵期每天将线虫挑至新的涂有OP50和药物的NGM板,以保证药物的浓度。每次转移秀丽线虫时,记录秀丽线虫存活、死亡及剔除条数,直至所有秀丽线虫死亡,实验结束。秀丽线虫死亡判断标准:无移动及吞咽动作,轻触后仍无任何反应。剔除标准:1)逃离至平皿壁或盖上而干死;2)虫卵在体内孵化而成袋样虫;3)钻入琼脂中;4)意外死亡、逃逸和囊样线虫。
2.6.2 吞咽频率测定随机挑选15条秀丽线虫为1组,在显微镜下观测秀丽线虫咽部肌肉1 min内抽动的次数,2d测定1次。
以此上2项秀丽线虫抗衰老实验为依据,选择出最佳的T3-3浓度;用最佳T3-3浓度为药物,再进行产卵量和肠脂褐质的测定,以进一步确定其抗衰老的有效性。
2.6.3 产卵量测定设定为对照组和最佳桑葚多糖浓度组。每组挑取10条处于L4期的秀丽线虫,每板1条秀丽线虫。每隔1 d将秀丽线虫转移至新平板中(经过4~5次转移后,线虫基本不再产卵),20 ℃培养,待子代线虫孵化而未进入产卵期之前(24 h)对秀丽线虫数目进行计数,计算每条母秀丽线虫的总产卵量。
2.6.4 肠脂褐质测定用麻醉剂将虫龄为2 d和6 d的秀丽线虫麻醉,然后放置在显微镜载玻片上,盖上盖玻片。通过荧光显微镜使用100倍的放大倍数和适合的滤片设置(激发波长:365 nm,发射波长:420 nm)、单色数码相机以及Image Pro Plus software获取落射式荧光图像。通过光密度来检测秀丽线虫的荧光强度。
3 统计学处理用Excel 2007和SPSS 19.0软件对数据进行统计分析,组间采用单因素方差分析,模型采用回归分析,以P < 0.05为差异具有统计学意义。
4 结果与分析 4.1 温度对桑葚多糖T2提取率的影响在40~ 100 ℃提取范围内,桑葚多糖T2的提取率随提取温度的升高而提高,表明高温有利于多糖物质从桑葚粉末中扩散出来,在体积无变化的条件下,随着温度的升高,分子运动速度加快,分子平均动能增加,大分子链的活动力在高温条件下加大,多糖的扩散运动加快。但提取温度过高和时间过长同样也会破坏多糖的结构。故桑葚多糖T2的提取温度以100 ℃为宜。见图 1。
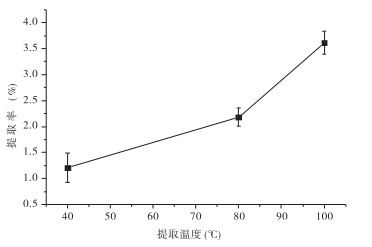
|
| 图 1 提取温度对桑葚多糖T2提取率的影响 |
提取开始阶段,由于外界环境中多糖浓度低,随着提取时间的延长,多糖分子由桑葚粉末中逐渐扩散到溶液中,并且在多糖溶液未饱和之前,溶液中的糖浓度呈逐步增大的趋势,在2 h左右,达到糖浓度扩散的最大值;浸提2 h以后,部分多糖结构破坏和降解,桑葚中其他杂质溶解出来,降低多糖的提取率。超过3 h后,桑葚多糖T2的提取率趋于稳定,溶剂中的多糖浓度与固体原料粉末中的多糖浓度变小,糖的降解和杂质的溶出等各种条件基本达到平衡,扩散速度减慢。因此,在较高的提取率前提下,考虑多糖稳定性和能耗问题,桑葚多糖T2的浸提时间以2 h为宜。见图 2。

|
| 图 2 浸提时间对桑葚多糖T2提取率的影响 |
在料液比1:10至1:30时,提取率由2.32%增加至2.59%;在料液比1:30至1:50时,提取率增加至2.65%,仅增加2.32%,呈平稳状态。在料液比1:10至1:30时,提取率提高,随着溶剂量的加大,提取液浓度降低,桑葚多糖T2越容易从桑葚粉末中扩散出去。在料液比l:30至1:50时,提取率变化较小,通过增加溶剂量来提高桑葚多糖T2提取率的效果已不显著,且料液比太大,在回收、过滤、转移、后期浓缩等方面成本增加,造成浪费。故在提取效果较好,并节约浓缩成本的前提下,料水比1:30为宜。见图 3。
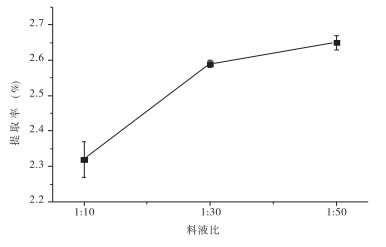
|
| 图 3 料液比对桑葚多糖T2提取率的影响 |
随着提取次数的增加,提取率呈增加趋势。因水提法对植物细胞壁的破坏不是太剧烈,故提取桑甚多糖T2的效率较低,需多次释放在桑葚细胞壁内的多糖,在提取1~3次时,多糖的提取率呈上升趋势,3次时提取率已达到3.14%。提取4次时,T2含量(3.15%)和3次时无统计学差别,可能是因为随着提取次数的增加,回收、过滤、转移等操作过程也增加,增加了造成多糖的损失,致使提取率变化不大,结合实际生产效益,提取次数以3次为宜。见图 4。
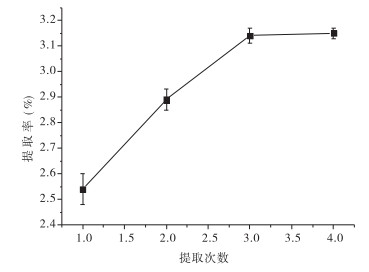
|
| 图 4 提取次数对桑葚多糖T2提取率的影响 |
由单因素实验可知,最佳提取温度为100 ℃,最佳提取时间为2 h,最佳料液比为1:30,最佳提取次数为3次。在此基础上,每个因素选定3个水平,以多糖含量为指标,采用L9(34)正交表优化实验,选取最佳工艺。见表 1。L9(34)正交实验结果见表 2。
| 实验号 | A温度(℃) | B时间(h) | 含量(%) |
| 1 | 60 | 1 | 1.60 |
| 2 | 60 | 2 | 4.65 |
| 3 | 60 | 3 | 3.51 |
| 4 | 80 | 1 | 3.82 |
| 5 | 80 | 2 | 6.33 |
| 6 | 80 | 3 | 3.47 |
| 7 | 100 | 1 | 5.44 |
| 8 | 100 | 2 | 5.20 |
| 9 | 100 | 3 | 5.26 |
根据各列各水平对应数据之和K1、K2、K3及其平均值k1、k2、k3,求出各列平均值的极差R,结果如表 3所示。
| A温度(℃) | B时间(h) | C次数 | D料液比 | |
| K1 | 9.76 | 10.86 | 10.27 | 13.19 |
| K2 | 13.62 | 16.18 | 13.73 | 13.56 |
| K3 | 15.90 | 12.24 | 15.28 | 12.53 |
| k1 | 3.25 | 3.62 | 3.42 | 4.40 |
| k2 | 4.54 | 5.39 | 4.58 | 4.52 |
| k3 | 5.30 | 4.08 | 5.09 | 4.18 |
| R | 2.05 | 1.77 | 1.67 | 0.34 |
| 主次顺序 | A>B>C>D | |||
| 最优组合 | A3B2C3D2 | |||
由表 3可知,KA1=∑ KA=1.6+4.65+3.51=9.76,kA1=KA1/3=9.76/3=3.25,RA=kAmax-kAmin=5.30-3.25= 2.05。同理,可知:RA>RB>RC>RD,即主次顺序为A> B>C>D,即提取温度>提取时间>提取次数>料液比;KA3>KA2>KA1,15.90>13.62>9.76,即A的最佳工艺为KA3,同理,最佳组合为A3B2C3D2,即提取温度100 ℃,提取时间2 h,提取次数为3次,料液比为1:30。对正交实验结果进行方差分析和显著性检验,结果见表 4、表 5。
| A温度(℃) | B时间(h) | C次数 | D料液比 | 含量(%) | |
| K1j | 9.76 | 10.86 | 10.27 | 13.19 | T=39.28 |
| K2j | 13.62 | 16.18 | 13.73 | 13.56 | |
| K3j | 15.90 | 12.24 | 15.28 | 12.53 | |
| K1j2 | 95.26 | 117.94 | 105.47 | 173.98 | |
| K2j2 | 185.50 | 261.79 | 188.51 | 183.87 | |
| K3j2 | 252.81 | 149.82 | 233.48 | 157.00 |
| 因素 | 偏差平方和 | 自由度 | 均方 | F | P |
| 温度 | 6.422 | 2 | 3.211 | 35.481 | 0.027* |
| 时间 | 5.082 | 2 | 2.541 | 28.072 | 0.034* |
| 次数 | 4.386 | 2 | 2.193 | 24.232 | 0.040* |
| 料液比 | 0.182 | 2 | 0.091 | 1 | |
| 误差 | 0.180 | 2 | |||
| 注:显著性*P < 0.05。 | |||||
由表 5可知,FA >FB >FC >FD,35.481 >28.072 > 24.232>1,因素A、B、C显著,因素D不显著,故因素主次顺序为A>B>C,即提取温度>提取时间>提取次数,料液比对提取影响不显著。结合提取率综合分析:最优水平组合为A3B2C3D2,即提取温度100 ℃,提取时间2 h,提取次数为3次,料液比为1:30。
5 抗衰老活性研究 5.1 秀丽线虫寿命测定从秀丽线虫的全程生存情况看,与对照组(0 mg/L)比较,低剂量组(50 mg/L)、中剂量组(150 mg/L)、高剂量组(300 mg/L)均能使秀丽线虫的存活率显著提高,生存曲线右移,以中剂量组(150 mg/L)效果最为显著,效果与阳性对照组(50 mg/L)相当。与对照组比较,对照组秀丽线虫平均寿命为21.86 d,最大寿命为28.23 d,50%存活率对应天数为22 d;中剂量组秀丽线虫平均寿命为24.13 d,延长了10.38%,最大寿命为36.11 d,延长了28.57%,50%存活率对应天数为22.2 d,延长了0.91%。见图 5。
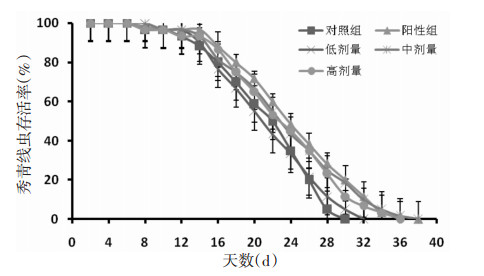
|
| 图 5 秀丽线虫生存曲线 |
随着秀丽线虫的生长,其吞咽频率随之下降;阳性药组和桑葚多糖T3-3中剂量组对延缓秀丽线虫吞咽频率的下降程度有效。不同剂量喂养的秀丽线虫吞咽频率排序为:阳性药组>中剂量组>高剂量组≈低剂量组>对照组,桑葚多糖T3-3中剂量组和香菇多糖阳性的组在实验期间内能有效提高秀丽线虫的吞咽频率。在实验后期,阳性药组、中剂量组的吞咽频率分别比对照组高21.13%、18.78%;对照组比中剂量组和阳性药组的下降率高12.72%和12.29%。
通过秀丽线虫第一阶段寿命和吞咽频率实验综合分析可知,150 mg/L桑葚多糖T3-3在抗衰老活性上效果显著。选取桑葚多糖T3-3中剂量组(150 mg/L)通过秀丽线虫产卵量和肠脂褐质的实验,进一步验证其抗衰老活性。见图 6。
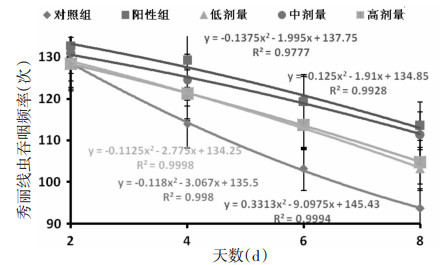
|
| 图 6 不同剂量桑葚多糖T3-3对秀丽线虫吞咽频率影响 |
桑葚多糖T3-3不会影响秀丽线虫的产卵量。饲喂桑葚多糖T3-3和对照组生殖高峰期一致,集中在前3 d,以第2天最多,前3 d的产卵量两者仅相差7.14%~9.70%。对照组及中剂量组的线虫平均产卵总量分别为184.8和205.1,相差9.90%,根据t检验分析,P>0.05,并无统计学意义。说明桑葚多糖T3-3不会通过影响生殖能力来间接影响衰老速度。见图 7。
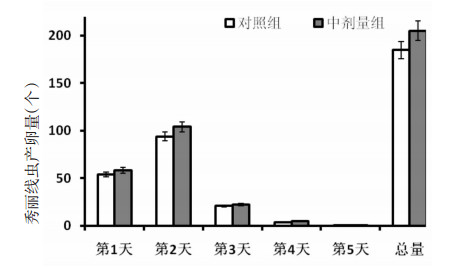
|
| 图 7 桑葚多糖T3-3对秀丽线虫产卵量的影响 |
在实验期内,桑葚多糖T3-3中剂量组能有效减少秀丽线虫肠脂褐质的产生量。第2天时,中剂量组比对照组平均荧光强度低1.81%,强度相当;第6天时,中剂量组比对照组低11.14%(P < 0.05), 达到显著水平。从第2天至第6天,对照组的平均荧光强度增大了12.47%;中剂量组仅增长3.03%,两者相差9.44%。这表明桑葚多糖T3-3中剂量组(150 mg/L)比对照组平均荧光强度低11.14%,能够明显抑制秀丽线虫肠脂褐质形成,延缓秀丽线虫衰老。见图 8、图 9。
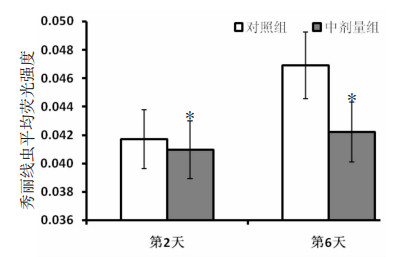
|
| 图 8 秀丽线虫平均荧光强度 与对照组比较,*P < 0.05。 |
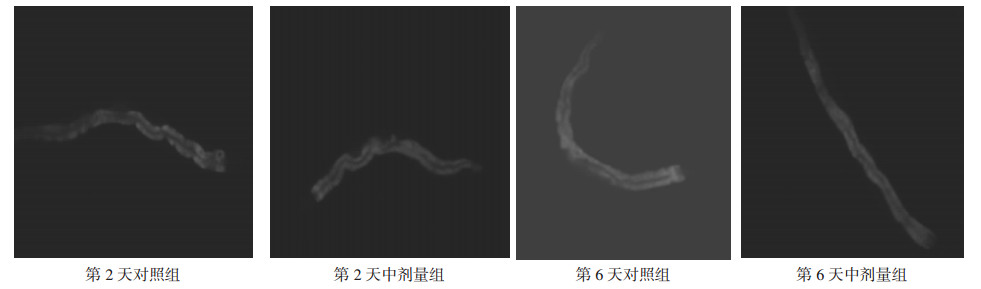
|
| 图 9 秀丽线虫肠褐质实验荧光图 |
桑葚多糖T2的最佳提取工艺为提取温度100 ℃、提取时间2 h、提取次数3次、料液比1:30,此结果与某些学者的研究结果接近[1]。因素对桑葚多糖T2提取率影响的排列是:提取温度>提取时间>提取次数,料液比对提取影响不显著。
抗衰老活性:用秀丽线虫抗衰老模型确定桑葚多糖T3-3抗衰老活性的有效性,中剂量(150 mg/L)桑葚多糖T3-3有效延长了秀丽线虫的寿命,增强了秀丽线虫的运动能力及吞咽频率, 减少秀丽线虫肠脂褐质的产生量但并不影响其产卵量。从实验结果中可以看出在饲喂桑葚多糖T3-3后,秀丽线虫的寿命有所提高,但不是以“利弊权衡”的机制即牺牲或丧失生殖能力作为代价的。这与蓝莓、儿茶素、淫羊藿总黄酮、香椿叶总黄酮等延长了秀丽线虫的寿命,但并没有影响到其产卵量的结果是一致的。另外,肠脂褐质是机体衰老的标志性物质,它的出现改变了物质的结构和功能,使细胞的结构和功能受到损伤,甚至凋亡,最终导致衰老。肠脂褐质平均荧光强度越大,衰老越严重。通过桑葚多糖T3-3降低秀丽线虫的平均荧光强度,说明桑葚多糖T3-3能够明显抑制秀丽线虫肠脂褐质形成,延缓秀丽线虫衰老。
| [1] | 胡海梅. 桑椹多糖提取工艺优化、组分分析及降血糖活性鉴定[D]. 合肥: 合肥工业大学, 2009. |
| [2] | Alam N, Gupta PC. Structure of a water-soluble polysaccharide from the seeds of Cassia angustifolia[J]. Plantamedica, 1986, 52(4): 308–310. |
| [3] | Wang L, Zhang HB, Zhang XY, et al. Purification and identification of a novel Hetero polysaccharide RBPS2a with anti-complementary activity from defatted rice bran[J]. Food Chemistry, 2008, 110(1): 150–155. DOI:10.1016/j.foodchem.2008.01.041 |
| [4] | 王艳菊, 马建伟, 王曦茁, 等. 葡萄籽原花青素对秀丽隐杆线虫抗衰老的影响[J]. 食品工业科技, 2014, 35(20): 369–373. |
| [5] | 陆沛, 夏世金, 孙涛, 等. 白藜芦醇对秀丽线虫衰老的影响[J]. 成都医学院学报, 2012, 7(3): 359–363. |
| [6] | Chuang MH, Chiou SH, Huang CH, et al. The lifespan-promoting effect of acetic acid and Reishi polysaccharide[J]. Bioorganic & Medicinal Chemistry, 2009, 17(22): 7831–7840. |
| [7] | 张培丽, 张帅, 陈雪香, 等. 桑葚多糖对H2O2诱导PC-12细胞氧化损伤的保护作用[J]. 现代食品科技, 2015, 31(11): 24–25. |
| [8] | Chaiklahan R, Chirasuwan N, Triratana P, et al. Polysaccharide extraction from Spirulina sp. and its antioxidant capacity[J]. International journal of biological macromolecules, 2013, 58(7): 73–78. |
| [9] | Chen JG, Bu WL, Lai WQ, et al. Hypoglycemic effects and mechanism of mulberry leaves polysaccharide[J]. Chinese Traditional and Herbal Drugs, 2011, 42(3): 515–520. |
| [10] | Wang F, Li J, Jiang Y. Polysaccharides from mulberry leaf in relation to their antioxidant activity and antibacterial ability[J]. Journal of food process engineering, 2010, 33(1): 39–50. DOI:10.1111/jfpe.2010.33.issue-1 |
| [11] | Goncalves C, Rodriguez-Jasso RM, Gomes N, et al. Adaptation of dinitrosalicylic acid method to microtiter plates[J]. Analytical Methods, 2010, 2(12): 2046–2048. DOI:10.1039/c0ay00525h |
| [12] | Peng F, Ren JL, Xu F, et al. Comparative studies on the physico-chemical properties of hemicelluloses obtained by DEAE-cellulose-52 chromatography from sugarcane bagasse[J]. Food Research International, 2010, 43(3): 683–693. DOI:10.1016/j.foodres.2009.10.020 |
 2017, Vol. 36
2017, Vol. 36