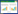文章信息
- 严治学严治学, 何永志何永志, 王颖王颖
- YAN Zhi-xue, HE Yong-zhi, WANG Ying
- 黄芪HPLC-ELSD指纹图谱的建立及分析
- Establishment and analysis of HPLC-ELSD fingerprint of Radix Astragali
- 天津中医药大学学报, 2017, 36(2): 142-145
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2): 142-145
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.02.16
-
文章历史
收稿日期: 2016-12-26
中药黄芪为豆科(Leguminosae)植物蒙古黄芪[Astragalusmembranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao]和膜荚黄芪[A. membranaceus(Fisch.)Bge.]的干燥根,其味甘,性微温,归肺、脾经,具有补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌之功效[1]。现代药理学研究表明,黄芪具有增强免疫系统功能、抗肿瘤、抗心肌缺血、双向调节血糖,抗菌,抗衰老等活性[2-9]。
2010版《中华人民共和国药典》黄芪皂苷类的测定为黄芪甲苷的含量测定,采用蒸发光散射检测器[10]。单一的含量测定方法已经难以全面评价药材的质量,近年来,黄芪指纹图谱的研究取得了一定进展[11-16],采用超高效液相色谱/四极杆飞行时间串联质谱仪(UPLC /Q-TOF-MS)[17]、核磁共振氢谱(1HNMR)[18]、傅里叶红外光谱(FTIR)[19]等分析技术能更快,更精准的用于药材质量的鉴别,为黄芪药材及其制剂的质量提供了保证。
为考察黄芪药材质量,本文收集不同批次的黄芪药材,采用2010版药典中的药材提取方法及高效液相-蒸发光散射检测法(HPLC-ELSD)分析技术,选择5种黄芪皂苷作为对照品,建立黄芪指纹图谱。文章建立的方法60 min内出共有峰16个,分离度良好,根据对照品指认了5种黄芪皂苷,并对指纹图谱的相似度分析和匹配分析进行研究,从而为提升蒙古黄芪的质量控制水平提供科学依据。
1 实验仪器与材料Waters e2695高效液相色谱仪,Waters 2424 ELSD etector检测器;KQ-500E型超声波清洗器(昆山市超声仪器有限公司);Sartorius LE225D型电子分析天平(德国Sartorius公司);FW80型粉碎机,购自天津泰斯特仪器有限公司;ZDHW型电热套,购自河北黄骅中兴仪器有限公司。黄芪皂苷Ⅰ(H-038-130123)、黄芪皂苷Ⅱ(H-037-120528)、黄芪皂苷Ⅲ(H-036-130123)对照品购自于成都瑞芬思生物科技有限公司;黄芪甲苷(110781-200613)购自于中国药品生物制品鉴定所;异黄芪皂苷Ⅱ为本实验室自制,质量分数均大于98%。黄芪药材由天津市中新药业提供(批号:1005098、08070801、10120303、11041804、11062601、Y1001005、Y1110236、Y1202048、Y1202050、Y1210219、Y1210227、Y1212017)。经天津中医药大学马琳教授鉴定为蒙古黄芪[Astragalus membranaceus(Fisch.)Bge. var. mongholicus(Bge.)Hsiao]。乙腈为色谱纯(美国Tedia公司);水为娃哈哈纯净水,其余试剂为分析纯。
2 实验方法 2.1 色谱条件Waters e2695高效液相色谱仪,色谱柱为Grace Apollo C18(250 mm×4.6 mm,5 μm),检测器为Waters 2424 ELSD etector;流动相:A纯水-B乙腈梯度洗脱。体积流量1.0 mL/min;漂移管温度60 ℃,雾化器cooling,气压30 psi(2.07 slpm),增益100。见表 1。
| 编号 | 时间 | A | B | C | D |
| 1 | 00.01 | 85.0 | 15.0 | 0.0 | 0.0 |
| 2 | 10.00 | 60.0 | 40.0 | 0.0 | 0.0 |
| 3 | 20.00 | 60.0 | 40.0 | 0.0 | 0.0 |
| 4 | 30.00 | 20.0 | 80.0 | 0.0 | 0.0 |
| 5 | 45.00 | 10.0 | 90.0 | 0.0 | 0.0 |
| 6 | 52.00 | 10.0 | 90.0 | 0.0 | 0.0 |
| 7 | 60.00 | 85.0 | 15.0 | 0.0 | 0.0 |
精密称取黄芪甲苷4.92 mg、黄芪皂苷Ⅰ9.84 mg、黄芪皂苷Ⅱ5.10 mg、黄芪皂苷Ⅲ4.88 mg、异黄芪皂苷Ⅱ5.12 mg,定容于10 mL甲醇中,以0.22 μm微孔滤膜过滤,作为对照品母液,备用。
2.3 供试品溶液的制备黄芪药材60 ℃干燥2 h,粉碎,过60目筛,混合均匀,称取样品4 g,置于索式提取器中,加一定量甲醇浸泡过夜,次日精密加入甲醇至160 mL,加热回流4 h,甲醇减压回收至干,分散于20 mL水中,水饱和正丁醇萃取3次,每次40 mL,合并萃取液,减压回收至干,甲醇复溶,定溶于10 mL容量瓶中,0.22 μm微孔滤膜过滤,取续滤液,待测[5-6]。
2.4 指纹图谱方法学考察 2.4.1 精密度考察取同一供试品溶液,连续进样6次,检测指纹图谱,结果表明,测得各共有峰相对保留时间和相对峰面积的RSD均小于5%。表明仪器的精密度良好。
2.4.2 稳定性考察精密称取同一批黄芪粉末4 g,按“ 2.3”项下方法制备供试品溶液,并在“ 2.1”项下色谱条件分别于0、2、4、8、12、16、24 h进样,测定峰面积,计算。测定各共有峰相对保留时间和相对峰面积RSD均小于5%。结果表明黄芪供试品溶液在24 h内稳定。
2.4.3 重复性实验取同一批黄芪样品(11041804)6份,按“ 2.2”项下方法制备供试品溶液,并在“ 2.1”项下色谱条件,重复连续进样6次,测定峰面积,计算。测得各共有峰相对保留时间和相对峰面积的RSD均小于5%。表明其重现性良好,符合指纹图谱的要求。
2.5 黄芪指纹图谱的建立按“2.3”项下方法制备12个不同产地的供试品溶液,进样测定,记录色谱图。运用中药色谱指纹图谱相似度评价系统2004A版,对12批黄芪样品进行了指纹图谱相似度分析和匹配分析研究,归纳出12批样品的高效液相色谱法(HPLC)指纹图谱具有30个共有的特征指纹峰,其中17个共有指纹峰的总面积占总峰面积的90%以上并被依次标定,其中7号峰为黄芪甲苷、8号峰为黄芪皂苷Ⅲ、10号峰为黄芪皂苷Ⅱ、11号峰为异黄芪皂苷Ⅱ、12号峰黄芪皂苷Ⅰ,见图 1、图 2。
|
| 图 1 黄芪药材HPLC-ELSD指纹图谱图 |
|
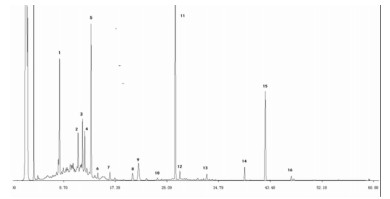
| 图 2 12批黄芪样品匹配分析图 |
以12号峰(黄芪皂苷Ⅰ)为内标参照峰(要求峰面积相对较大、较稳定的共有峰)的峰面积为1,计算其他各共有指纹峰峰面积的比值。见表 2。
| 峰号 | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | S11 | S12 | x±s |
| 1 | 14.959 | 8.703 | 7.389 | 12.831 | 8.097 | 4.972 | 88.789 | 9.343 | 8.180 | 10.533 | 11.136 | 19.164 | 17.008±22.918 |
| 2 | 0.006 | 0.003 | 0.006 | 0.010 | 0.004 | 0.013 | 0.156 | 0.012 | 0.003 | 0.012 | 0.023 | 0.035 | 0.024±00.043 |
| 3 | 0.015 | 0.008 | 0.022 | 0.031 | 0.013 | 0.003 | 0.085 | 0.007 | 0.007 | 0.021 | 0.012 | 0.014 | 0.020±00.020 |
| 4 | 0.291 | 0.018 | 0.080 | 0.126 | 0.266 | 0.018 | 0.624 | 0.116 | 0.154 | 0.268 | 0.050 | 0.089 | 0.175±00.170 |
| 5 | 0.102 | 0.010 | 0.144 | 0.142 | 0.119 | 0.004 | 3.321 | 0.085 | 0.028 | 0.271 | 0.027 | 0.092 | 0.362±00.935 |
| 6 | 0.339 | 0.457 | 0.767 | 0.315 | 0.141 | 0.508 | 0.494 | 0.246 | 0.224 | 0.305 | 0.825 | 1.014 | 0.470±00.270 |
| 7 | 0.021 | 0.026 | 0.054 | 0.015 | 0.025 | 0.007 | 1.054 | 0.011 | 0.011 | 0.067 | 0.014 | 0.026 | 0.111±00.298 |
| 8 | 0.021 | 0.012 | 0.026 | 0.010 | 0.009 | 0.002 | 0.039 | 0.008 | 0.009 | 0.011 | 0.010 | 0.015 | 0.015±00.010 |
| 9 | 0.025 | 0.056 | 0.026 | 0.026 | 0.010 | 0.089 | 0.018 | 0.006 | 0.030 | 0.014 | 0.060 | 0.079 | 0.037±00.027 |
| 10 | 0.088 | 0.230 | 0.184 | 0.148 | 0.104 | 0.105 | 0.191 | 0.090 | 0.138 | 0.102 | 0.125 | 0.126 | 0.136±00.045 |
| 11 | 0.009 | 0.011 | 0.015 | 0.008 | 0.012 | 0.005 | 0.029 | 0.011 | 0.008 | 0.012 | 0.009 | 0.009 | 0.012±00.006 |
| 12 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000 | 1.000±00.000 |
| 13 | 0.024 | 0.035 | 0.038 | 0.039 | 0.019 | 0.029 | 0.027 | 0.010 | 0.024 | 0.025 | 0.027 | 0.022 | 0.027±00.008 |
| 14 | 0.039 | 0.011 | 0.025 | 0.064 | 0.021 | 0.011 | 0.131 | 0.015 | 0.026 | 0.022 | 0.0498 | 0.057 | 0.039±00.034 |
| 15 | 0.169 | 0.029 | 0.009 | 0.023 | 0.001 | 0.209 | 0.002 | 0.001 | 0.003 | 0.004 | 0.021 | 0.026 | 0.041±00.070 |
| 16 | 0.856 | 0.399 | 0.203 | 0.228 | 0.016 | 1.406 | 0.053 | 0.009 | 0.034 | 0.053 | 0.308 | 0.571 | 0.345±00.423 |
| 17 | 0.038 | 0.026 | 0.014 | 0.030 | 0.006 | 0.025 | 0.024 | 0.006 | 0.008 | 0.009 | 0.031 | 0.052 | 0.023±00.014 |
应用中药色谱指纹图谱相似度评价系统2004A版对12批黄芪药材的指纹图谱进行相似度分析,以中位数法生成12批药材的对照图谱,相似度评价结果均大于0.94,证明不同批次间药材比较稳定,结果见表 3。其中6号药材的相似度均比较低,6号药材的3、5、7、8、11号峰含量远远低于其他药材。
| S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | S11 | S12 | R | |
| S1 | 1.000 | 0.997 | 0.994 | 0.998 | 0.996 | 0.965 | 0.996 | 0.991 | 0.997 | 0.997 | 0.997 | 0.998 | 0.999 |
| S2 | 0.997 | 1.000 | 0.996 | 0.998 | 0.993 | 0.970 | 0.990 | 0.992 | 0.998 | 0.993 | 0.998 | 0.998 | 0.999 |
| S3 | 0.994 | 0.996 | 1.000 | 0.994 | 0.995 | 0.966 | 0.987 | 0.989 | 0.996 | 0.995 | 0.996 | 0.993 | 0.997 |
| S4 | 0.998 | 0.998 | 0.994 | 1.000 | 0.996 | 0.958 | 0.996 | 0.993 | 0.999 | 0.996 | 0.998 | 0.999 | 0.999 |
| S5 | 0.996 | 0.993 | 0.995 | 0.996 | 1.000 | 0.954 | 0.992 | 0.991 | 0.997 | 0.999 | 0.993 | 0.992 | 0.997 |
| S6 | 0.965 | 0.970 | 0.966 | 0.958 | 0.954 | 1.000 | 0.940 | 0.951 | 0.959 | 0.952 | 0.964 | 0.959 | 0.967 |
| S7 | 0.996 | 0.990 | 0.987 | 0.996 | 0.992 | 0.940 | 1.000 | 0.989 | 0.992 | 0.994 | 0.992 | 0.996 | 0.994 |
| S8 | 0.991 | 0.992 | 0.989 | 0.993 | 0.991 | 0.951 | 0.989 | 1.000 | 0.994 | 0.990 | 0.992 | 0.992 | 0.994 |
| S9 | 0.997 | 0.998 | 0.996 | 0.999 | 0.997 | 0.959 | 0.992 | 0.994 | 1.000 | 0.996 | 0.998 | 0.996 | 0.999 |
| S10 | 0.997 | 0.993 | 0.995 | 0.996 | 0.999 | 0.952 | 0.994 | 0.990 | 0.996 | 1.000 | 0.994 | 0.994 | 0.997 |
| S11 | 0.997 | 0.998 | 0.996 | 0.998 | 0.993 | 0.964 | 0.992 | 0.992 | 0.998 | 0.994 | 1.000 | 0.998 | 0.999 |
| S12 | 0.998 | 0.998 | 0.993 | 0.999 | 0.992 | 0.959 | 0.996 | 0.992 | 0.996 | 0.994 | 0.998 | 1.000 | 0.998 |
| R | 0.999 | 0.999 | 0.997 | 0.999 | 0.997 | 0.967 | 0.994 | 0.994 | 0.999 | 0.997 | 0.999 | 0.998 | 1.000 |
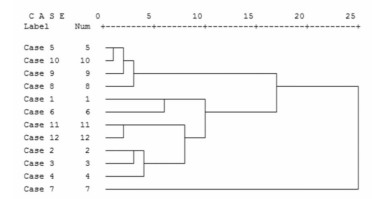
应用SPSS18.0统计软件对12批药材的17个共有峰峰面积进行聚类分析,以17个共有峰为指标,采用Ward Method,利用Euclidean distance作为样品的测度,对数据进行Z得分标准化处理,得到树状聚类图见图 3。从中可以看到,在15处,12批样品分为3大类,样品5,8,9,10为一类,1、2、3、4、6、11、12为一类,7为一类。7号药材1号色谱峰明显高于其他药材的相应色谱峰,2-5,7号色谱峰也略高于其他药材的相应色谱峰,故区别于其他药材,单独聚为一类。
|
| 图 3 黄芪聚类分析树状图 |
实验中采用药典中的提取方法,便于平行考察不同批次的黄芪药材质量。实验中考查了甲醇-水、乙腈-水、甲醇-0.05%甲酸溶液、乙腈-0.05%甲酸溶液系统,发现甲醇-水系统洗脱时,色谱峰有拖尾现象,乙腈-水系统洗脱时指纹图谱色谱峰多,分离度好,综合考虑乙腈-水系统可以更好的清洗和保护色谱,所以本实验采用乙腈-水系统作为流动相。
中药指纹图谱广泛运用于中药质量研究,常用的分析方法有薄层色谱法(TLC)、HPLC、红外线(IR)等,其中HPLC法应用较广泛。黄芪中的皂苷类成分存在紫外末端吸收的影响,主要采用蒸发光检测器进行测定[10]。本实验主要针对不同批次黄芪药材进行了研究,其中HPLC-ELSD指纹图谱标定共有峰17个,占总峰面积的90%以上。本实验结果与文献相比[14, 16, 20],同时结合聚类分析,可以更加直观地对不同批次黄芪药材进行质量评价。文章对黄芪质量标准的建立提供了可靠的依据,且前处理方法简便易行,便于推广。
| [1] | 国家药典委员会. 中华人民共和国药典 (一部)[M]. 北京: 化学工业出版社, 2005: 212 |
| [2] | 刘德丽, 包华音, 刘杨. 近5年黄芪化学成分及药理作用研究进展[J]. 食品与药品, 2014, 16(1): 68–70. |
| [3] | 陈国辉, 黄文凤. 黄芪的化学成分及药理作用研究进展[J]. 中国新药杂志, 2008, 17(17): 1482–1485. DOI:10.3321/j.issn:1003-3734.2008.17.006 |
| [4] | 张李峰. 红芪和黄芪的免疫调节作用及抗免疫老化机制比较研究[D]. 兰州: 兰州大学, 2012. |
| [5] | Qiu HH, Cheng GL, Xu JQ, et al. Effects of astragalus polysaccharides on associated immune cells and cytokines in immunosuppressive dogs[J]. Procedia Vaccinol, 2010, 2(1): 26–33. DOI:10.1016/j.provac.2010.03.006 |
| [6] | 刘明华, 任美萍, 陈健平, 等. 黄芪皂苷抗肿瘤活性研究[J]. 中药药理与临床, 2009, 25(2): 68–70. |
| [7] | 米红, 李燕舞, 王晓燕, 等. 黄芪总苷对脾虚大鼠胃黏膜保护机制探讨[J]. 中药药理与临床, 2012, 28(5): 61–63. |
| [8] | 米志勇, 李永新, 张代碧. 黄芪注射液治疗急性心肌梗死并发心源性休克疗效观察[J]. 中国中医急症, 2009, 18(10): 1621–1647. DOI:10.3969/j.issn.1004-745X.2009.10.032 |
| [9] | 李亮, 杨萍, 蒋俊, 等. 黄芪化学成分及对神经系统作用的研究概况[J]. 湖南中医药大学学报, 2012, 32(5): 79–81. |
| [10] | 国家药品典委员会. 中国药典 (一部)[J]. 北京:化学工业出版社, 2010: 181–182. |
| [11] | 田兰, 程海燕, 陈晓辉, 等. 黄芪药材的HPLC指纹图谱[J]. 沈阳药科大学学报, 2008, 25(12): 979–982. |
| [12] | 聂磊, 仲红波, 向兰, 等. 粗糙集方法选取相关特征峰用于黄芪药材的产地鉴别[J]. 中药材, 2006, 29(10): 1020–1023. DOI:10.3321/j.issn:1001-4454.2006.10.009 |
| [13] | 赵慧辉, 赵平, 吴刚, 等. 不同产地黄芪HPLC指纹图谱的聚类分析及相似度评价[J]. 世界科学技术:中医药现代化, 2011, 13(4): 681–687. |
| [14] | 覃红萍, 鲁静, 林瑞超. HPLC-ELSD法测定黄芪药材中黄芪皂苷Ⅰ, Ⅱ, Ⅲ, Ⅳ[J]. 中草药, 2009(3): 471–473. |
| [15] | 王宗权, 贾继明, 宋剑, 等. 不同产地黄芪中黄芪皂苷Ⅰ、黄芪皂苷Ⅱ和黄芪皂苷Ⅳ含量测定[J]. 药物分析杂志, 2010, 30(7): 1191–1194. |
| [16] | 赵灵芝, 朱丹妮. HPLC-ELSD法测定黄芪中黄芪甲苷的含量[J]. 药物分析杂志, 1999, 19(6): 403–406. |
| [17] | 芮雯, 冯毅凡, 石忠峰, 等. 不同产地黄芪药材的UPLC/Q-TOF-MS指纹图谱研究[J]. 药物分析杂志, 2012, 32(4): 607–611. |
| [18] | 曲婷丽, 魏玉海, 李爱平, 等. 黄芪注射液1H-NMR指纹图谱研究[J]. 药学学报, 2016, 51(5): 780–785. |
| [19] | 李洪泽, 闫海涛, 韩风雨, 等. 黄芪药材红外指纹图谱研究[J]. 中国现代药物应用, 2015, 9(4): 242–243. |
| [20] | 梁瑾, 刘小花, 任远, 等. 黄芪药材的HPLC-DAD-ELSD指纹图谱研究[J]. 中国实验方剂学杂志, 2012, 18(17): 70–74. DOI:10.3969/j.issn.1005-9903.2012.17.021 |
 2017, Vol. 36
2017, Vol. 36