文章信息
- 王月玲王月玲, 李沛霖李沛霖, 李洁李洁, 王建玲王建玲, 华丹丹华丹丹, 王倩男王倩男, 王璀王璀
- WANG Yue-ling, LI Pei-lin, LI Jie, WANG Jian-ling, HUA Dan-dan, WANG Qian-nan, WANG Cui
- 人子宫内膜腺上皮细胞的体外分离培养及纯化
- Isolation, culture and purification of human endometrial glandular epithelial cells in vitro
- 天津中医药大学学报, 2017, 36(4): 291-294
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(4): 291-294
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.04.14
-
文章历史
收稿日期: 2017-03-16
2. 天津中医药大学第二附属医院, 天津 300150
2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300150, China
子宫内膜异位症(简称内异症,EMS)是指子宫内膜组织错误地出现在卵巢、子宫直肠陷凹、宫骶韧带等盆腔组织和器官中并继续种植生长的现象。少数病例也可种植在腹腔、胸腔、四肢等处。异位的子宫内膜侵袭和转移到不同的组织和器官,影响其正常功能,并表现出类似恶性肿瘤的特性[1-2]。EMS为正值生育年龄妇女常见的、多发的、难治性疾病。EMS引发的痛经、慢性盆腔疼痛、性交痛、月经异常和不孕等症状,不但严重影响着患者的生活质量,而且增加患者的财产负担和精神负担[3-4]。目前国内外多采用酶消化法、二次筛网过滤法[5-6]、离心法等方法,以获得子宫内膜腺上皮细胞。但是获得的腺上皮细胞纯度低、活性差,影响后续的研究。本实验的目的是为了获得更多纯度高活性好的子宫内膜腺上皮细胞,为EMS的研究提供可靠的体外模型,从而对子宫内膜腺上皮细胞的培养进行优化改进。
1 实验材料 1.1 主要仪器恒温细胞培养箱(Thermo, USA)、超净工作台(Airtech,德国)、倒置显微镜、台式高速离心机(Thermo,USA)、75 cm2细胞培养瓶、25 cm2细胞培养瓶、移液器(Eppendorf,德国)、12孔细胞培养板。
1.2 主要试剂胎牛血清(FBS, Corning, USA)、磷酸盐缓冲液(PBS,Corning,USA)、青霉素100 U/mL(Hyclone, USA)、链霉素100 U/mL(Hyclone,USA)、细胞培养基DMEM/F12(Corning,USA)、胰蛋白酶(Corning,USA)、Ⅰ型胶原酶(Corning,USA)、细胞角蛋白(CK)、抗体(Abcam,USA)、聚乙二醇辛基苯基醚(Triton)x-100(Solarbio,北京)、封闭性正常山羊血清(Solarbio,北京)、罗丹明标记山羊抗小鼠IgG(中杉金桥,北京)、防荧光淬灭剂(碧云天,上海)。
2 实验方法 2.1 标本来源及处理 2.1.1 病例选择选择天津中医药大学第二附属医院2016年3月—2016年10月行诊断性刮宫的患者(病理证实非子宫内膜性病变)。入选患者均为生育年龄(25~45岁),经期规律,无其他免疫、内分泌或代谢性疾病人群。
排除标准:合并恶性肿瘤、子宫内膜恶性病变、激素依赖性疾病、严重的心脑血管疾病、急慢性盆腔炎性疾病、6个月内应用过激素类药物等。
2.1.2 标本采集和处理1)患者子宫内膜采集:在无菌条件下,无菌小纱布放置于阴道后穹隆,避免刮取的内膜与阴道接触污染,自宫底刮取子宫内膜组织。2)标本浸没于装有含5%胎牛血清、1%双抗和94%的DMEM/F12全培的无菌离心管中,离心管放置在冰盒中,维持低温,尽快送至实验室(2 h内)进行原代培养。
2.2 腺上皮细胞原代培养、纯化1)提前30 min将高压灭菌的原代培养器械(玻璃皿、剪刀、镊子)、移液器、吸头等细胞培养用具置于超净工作台上,紫外线照射最少30 min。2)冰袋上操作:PBS清洗组织3遍,至组织变白净,无血污。加入1~2 mL全培,眼科剪剪碎至1 mm3大小,成糊状。离心,800 r/min,3 min,加入PBS洗1遍,重复离心1次。3)加入量为组织量2~3倍的复合酶(胰蛋白酶:Ⅰ型胶原酶=1:1),在37 ℃环境下消化,每隔15 min终止1次;剩余组织块继续消化,至沉淀消失,呈云雾状飘起,加入等量的全培终止消化。4)混合液经80目筛网单次过滤,滤掉未消化完全的组织块。5)滤液离心500 r/min,1 min,收集沉淀,重复离心3~5次。6)沉淀重悬,105个/mL,接种于细胞培养瓶中于37 ℃,5% CO2条件下培养。7)培养2 h后吸出未贴壁的细胞和悬液,离心800 r/min,5 min,按105个/mL接种于12孔细胞培养板中,3 d后换液,随后进行细胞形态观察及纯度鉴定。
2.3 子宫内膜腺上皮细胞鉴定1)倒置光学显微镜下观察子宫内膜腺上皮细胞形态学变化。2)免疫细胞学鉴定:无菌处理过的盖玻片放置于12孔细胞培养板上,子宫内膜腺上皮细胞按105个/mL接种于盖玻片上,培养72 h,此时腺上皮细胞完全贴壁,且特异性形态明显。吸弃上清,PBS轻柔晃洗3次,每次3 min。4%多聚甲醛室温固定20 min,PBS晃洗3次,每次5 min。0.3% Triton x-100室温透化15 min,PBS洗涤。加入5%的山羊血清,于37 ℃条件下,封闭5 min。吸去多余液体,实验组滴加一抗(鼠抗人角蛋白工作液1:200稀释),PBS作为阴性对照,于湿盒中4 ℃过夜。次日,将爬片转移至室温,PBS洗涤。避光,滴加异硫氰酸荧光素(FITC)标记山羊抗小鼠抗体(1:200稀释),于37 ℃环境下,温育1 h。PBS洗去液体,4’,6-二脒基-2-苯基吲哚(DAPI)染核5 min,PBS洗去染核液,加入防荧光淬灭剂,激光共聚焦显微镜下观察。低倍镜下选取10个不同视野进行细胞计数,计算细胞纯度。
3 结果 3.1 细胞分离及培养结果经诊断性刮宫获取的19例子宫内膜标本中,18例腺上皮细胞培养成活,1例失败。培养成功率:94.73%,1例因组织少培养失败。
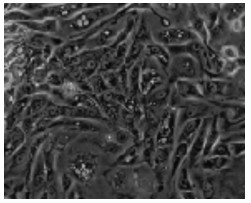
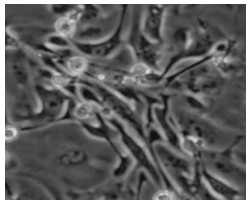
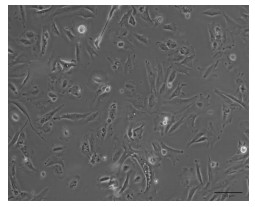
3.2 细胞形态学变化及生长规律结果子宫内膜腺上皮细胞贴壁缓慢,一般24 h左右开始贴壁,第3天贴壁完全,细胞呈蝌蚪状或玫瑰花状,涡旋排列。细胞聚集生长现象明显,见图 1。第4~6天,细胞进入对数生长期,细胞伸展,尾足伸出,尾足呈现拉丝状,细胞失去明显玫瑰花状结构,细胞仍聚集生长,肉眼观察排列混乱,见图 2。第7~8天,腺上皮细胞完全铺展开来,逐渐融合成片,见图 3。
|
| 图 1 子宫内膜腺上皮细胞第3天(100×) |
|
| 图 2 子宫内膜腺上皮细胞第4~6天(200×) |
|
| 图 3 子宫内膜腺上皮细胞第7~8天(100×) |
子宫内膜腺上皮细胞的特异性标记分子是细胞角蛋白,免疫细胞学结果发现,94%以上的细胞角蛋白阳性表达。即本实验方法下,进行子宫内膜腺上皮细胞培养,子宫内膜腺上皮细胞纯度达94%以上,见图 4。在倒置荧光显微镜低倍镜下进行细胞观察,选取低倍镜下10个不同视野进行细胞计数,计算腺上皮细胞的纯度,腺上皮细胞纯度高达94.2%。

|
| 图 4 子宫内膜腺上皮细胞免疫组化染色结果(100×) |
EMS是一种良性疾病,却具有恶性肿瘤侵袭、异位种植、复发的特点[7],因该病病因及发病机制不明,治疗棘手而缓慢,成为了临床的难题与科研界的长久挑战。1979年人子宫内膜细胞首次成功实现了培养与分离,其后国内外学者不断向原代子宫内膜细胞培养发起挑战。现有的方法因获取细胞数较少、纯度低、活性差等问题而难以实现子宫内膜腺上皮细胞的广泛应用。本研究在消化、过滤、离心、换液时间等培养方面进行了优化,以获得经济、量多、纯度高、活性更好的腺上皮细胞。子宫内膜原代细胞能否成功培养与以下因素密切相关:细胞的活力和细胞的纯度[8-9]。
经阴道取材,于阴道后穹窿部放置无菌小纱布,以防刮取的组织和阴道接触,造成污染,同时,实验器械提前高压灭菌,共同起到了防止污染的目的[10]。全培浸泡,低温运输,有利于保存组织的活性,营造一个适合细胞生长存活的环境,提供细胞生长所需的基本营养,有利于细胞的进一步存活。此外,有研究表明,适当增加冲洗组织标本的次数有利于将血污及黏液进一步去除,并可清除病原体[11]。采用含二乙烯四乙酸二钠(EDTA)的胰酶和Ⅰ型胶原酶按1:1配制的混合酶在37 ℃环境下,轻轻晃动进行消化。消化酶采用复合酶,因胶原酶作用温和,对细胞损伤稍小,消化所获得的细胞活力较强[12],但其价格较高。早在20世纪90年代就有胰蛋白酶使用的相关报道,胰蛋白酶消化能力较强,因而较多地在细胞传代中使用。胰蛋白酶是专一作用于有碱性氨基酸——精氨酸及赖氨酸羧基所组成的肽键,具有较强的消化分离细胞的能力,是一种有利于分解上皮细胞间较多紧密连接的消化方式[13-14]。胰蛋白酶作用峻猛,对细胞损伤稍大,获得的细胞活力较胶原酶低。而EDTA能通过螯合细胞间质中的二价阳离子使细胞分离[15],因此,课题组选取胶原酶及含EDTA的胰蛋白酶消化液,既保证了细胞的活力,又在一定程度上节约了实验成本。37 ℃轻轻摇动消化,保证酶和组织充分接触,增加接触面积,减少消化时间。消化过程采用复合酶多次消化,以防先消化下来的细胞消化太过,损伤细胞,同时还能增加酶和未消化下来的细胞的接触机会,直至组织呈云雾状,加入全培终止消化;仅采用80目滤网单次过滤,除去未消化完全的组织,同时也防止了经直径更小的筛网过滤反冲收集腺上皮细胞所造成的细胞损失。因细胞黏留于筛网上,难以彻底冲洗下来,导致细胞数量减少;同时,因个体差异,部分腺上皮细胞可以通过400目筛网,也就导致了腺上皮细胞的流失与损失。与此同时,也降低了因反复冲洗筛网造成的污染风险及细胞损伤的可能,采用低速离心的方法,减小高速长时间离心对细胞的损伤[15]。因腺上皮细胞较大,易形成细胞聚集,其他细胞较小,低速短时间离心后,腺上皮细胞先沉淀,从而去除混杂的其他细胞。原代细胞种植2 h后换液,待先贴壁的夹杂的间质细胞贴壁后,吸出贴壁缓慢的腺上皮细胞,重悬,培养,从而大大提高了腺上皮细胞的纯度。但因技术还没有完全成熟,无法培养出可以稳定传代的人子宫内膜腺上皮细胞。
综上,本实验从快速低温运输、混合酶重复消化、大孔径筛网单次过滤,低速离心、差时换液等多个方面提高细胞活性、减小细胞损伤、减少细胞损失,提高细胞纯度,从而达到有效培养的目的,得到较好的细胞模型。本实验在学习总结前人经验的基础上,不断进行改良得出了安全、高效、经济的可行方案。通过本实验,可以得到纯度为94%以上的腺上皮细胞,并且从很多方面避免了细胞的流失,从而为EMS的研究提供了可靠的体外细胞基础模型。
| [1] | 杨眉, 蒋春樊, 哈春芳, 等. 雌激素介导骨桥蛋白/基质金属蛋白酶9通路调节子宫内膜异位症腺上皮细胞侵袭性的研究[J]. 中国全科医学, 2016, 19(5): 554–559. |
| [2] | 李望舒, 白治苗, 王瑞, 等. NF-κB p65对子宫内膜异位症腺上皮细胞OPN, MMP-9表达及细胞侵袭性的影响[J]. 现代妇产科进展, 2016, 25(7): 518–521. |
| [3] | 王菲, 刘丽学, 孟文斌, 等. 诱导子宫内膜异位症患者子宫内膜上皮细胞调亡研究[J]. 现代生物学进展, 2016, 16(3): 529–532. |
| [4] | 白志苗, 卢玉凤, 杨眉, 等. OPN干预子宫内膜异位症腺上皮细胞中NF-κB p65表达及其对细胞侵袭性的影响[J]. 重庆医学, 2016, 45(9): 1163–1166. |
| [5] | Shimizu Y, Mita S, Takeuchi T, et al. Dienogest, a synthetic progestin, inhibits prostaglandin E2 production and aromatase expression by human endometrial epithelial cells in a spheroid culture system[J]. Steroids, 2011, 76(1): 60–67. |
| [6] | Crosignani P, Olive D, Bergqvist A, et al. Advances in the managementof endometriosis:an update for clinicians[J]. Hum Reprod Update, 2006, 12(2): 179–189. |
| [7] | 刘妍, 李卫红, 韦尉元, 等. 原代人子宫内膜细胞分离及培养鉴定[J]. 重庆医学, 2015, 44(35): 4904–4909. DOI:10.3969/j.issn.1671-8348.2015.35.003 |
| [8] | Bleharski JR, Kiessler V, Buonsanti C, et al. A role for triggering receptor expressed on myeloid cells -1 in host defence during the early-induced and adaptive phases of the immune response[J]. The Journal of Immunology, 2003, 170(7): 3812–3818. DOI:10.4049/jimmunol.170.7.3812 |
| [9] | 谢润桂, 林洋洋, 娄季武, 等. 240例绒毛细胞培养过程中的母体细胞污染情况分析[J]. 广东医学院学报, 2015, 33(1): 108–110. |
| [10] | 陆立仁, 张良清, 卢燕. 异丙酚对内毒素诱导人单核细胞系THP-1细胞TREM-1表达的影响[J]. 天津医药, 2014, 42(8): 759–761. |
| [11] | 张婷婷, 张瑞晓, 林明媚, 等. 胶原酶分离及低速离心结合筛网过滤法纯化子宫内膜细胞的研究[J]. 生殖与避孕, 2014, 34(1): 12–15. DOI:10.7669/j.issn.0253-357X.2014.01.0012 |
| [12] | 谢伟, 秦雯, 蒋凌云, 等. 优化胰蛋白酶消化强度进行人子宫内膜上皮细胞培养技术探讨[J]. 现代医药卫生, 2016, 32(11): 1606–1608. DOI:10.3969/j.issn.1009-5519.2016.11.002 |
| [13] | Kim NS, Yu HY, Chung ND, et al. High-level production of recombinant trypsin in transgenic rice cell culture through utilization of an alternative carbon source and recycling system[J]. Enzyme Microbial Technology, 2014, 63: 21–27. DOI:10.1016/j.enzmictec.2014.04.010 |
| [14] | 符蓉, 赵犇鹏, 杨洁, 等. 采用EDTA-胰酶处理难消化细胞株在凋亡检测分析中的可行性[J]. 上海交通大学学报, 2015, 35(5): 1422–1425. |
| [15] | 刘玉锋, 哈春芳, 马远, 等. 室温酶解结合差速离心法分离子宫内膜腺上皮细胞及活性评估[J]. 宁夏医科大学学报, 2014, 36(2): 133–135. |
 2017, Vol. 36
2017, Vol. 36