文章信息
- 陈莹陈莹, 李晋李晋, 曹君曹君, 何俊何俊, 关秀伟关秀伟, 张纲张纲, 李志刚李志刚, 常艳旭常艳旭
- CHEN Ying, LI Jin, CAO Jun, HE Jun, GUAN Xiu-wei, ZHANG Gang, LI Zhi-gang, CHANG Yan-xu
- HPLC柱前衍生法测定舒血宁注射液中四种氨酸的含量
- Determination of four amino acids in Shuxuening injection by HPLC coupled with precolumn derivatization
- 天津中医药大学学报, 2017, 36(4): 295-298
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(4): 295-298
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.04.15
-
文章历史
收稿日期: 2017-04-23
2. 杭州师范大学材料与化学化工学院, 杭州 310036;
3. 河北神威药业有限公司, 廊坊 065200;
4. 河北省中药注射液工程技术研究中心, 廊坊 065200;
5. 中药注射剂新药开发技术国家地方联合工程实验室, 廊坊 065200
2. College of Material Chemistry and Chemical Engineering, Hangzhou Normal University, Hangzhou 310036, China;
3. Hebei Shineway Pharmaceutical Co., Ltd., Langfang 065200, China;
4. Hebei Province Engineering Research Center for TCM Injection, Langfang 065200, China;
5. Chinese medicine injection new drug development technology national local joint engineering laboratory, Langfang 065200, China
银杏叶是一种常用中药,具有促进血液循环,抗氧化及抗血凝的作用[1]。化学成为主要含有黄酮类成分、萜内酯类、酚类、氨基酸、维生素、亚油酸、奎宁酸等化合物[2]。舒血宁注射液是银杏叶提取物经灭菌加工制成的水溶液[3],临床多用于冠心病、心绞痛、脑血管痉挛等心脑血管疾病的治疗[4]。现代医学研究表明舒血宁注射液能够改善血液流变学,抑制血小板聚集,对于急性脑梗死也具有一定治疗作用[5]。氨基酸作为必需营养成分之一,不仅是生物代谢过程中的重要物质,也是组成酶的重要物质[6]。近年来,随着人们对舒血宁注射液的药效物质认识深入,对其质量的研究也越来越受到关注。有学者测定了舒血宁注射液中原型黄酮醇苷、银杏总黄酮苷、5-羟甲基糠醛的含量[7-9],然而有关舒血宁注射液中氨基酸的含量还未见报道。
测定氨基酸的方法有氨基酸自动分析仪,衍生高效液相色谱法、光谱分析法、毛细管电泳分析法、色谱分析法等[10]。氨基酸分析仪分析时间长,设备要求专用,具有一定的局限性[11]。衍生高效液相色谱法,包括柱前、在柱、柱后衍生高效液相检测法。由于在柱衍生必须配备搅拌装置,柱后衍生又存在反应室死体积小, 反应速率要快的缺点,现主要采用柱前衍生高效液相色谱法分析氨基酸[12]。其优点是灵敏度高,检测限低和操作简便,使得该方法在氨基酸分析方面广泛使用[13]。氨基酸的柱前衍生化试剂主要有异硫氰酸苯酯、邻苯二甲醛、丹磺酰氯等[14-17]。在氨基酸衍生化试剂中,异硫氰酸苯与氨基酸反应后,产物稳定,具有紫外吸收,是氨基酸常用的柱前衍生试剂[17]。
本文采用异硫氰酸苯酯柱前衍生法对舒血宁注射液中的天门冬氨酸、苏氨酸、丙氨酸、甲硫氨酸进行定性定量,为舒血宁注射液的质量评价提供一定的依据。
1 材料与试药 1.1 仪器Waters 2695高效液相色谱系统(型号:F04BLS145C);waters 2487检测器(型号:C04BLS014C);万分之一天平(德国赛托利斯公司);离心机(德国Sigma公司);超声仪(宁波新芝生物科技股份有限公司);十万分之一电子天平(METTLER TOLEDO)。
1.2 试药天门冬氨酸、苏氨酸、丙氨酸、甲硫氨酸对照品均购自于中国食品药品检定所;醋酸钠(天津市风船化学试剂科技有限公司);三乙胺(天津市光复精细化工研究所);甲醇、乙腈为色谱纯(天津市康科德科技有限公司);实验用水为Milli-Q超纯水(Millipore公司,Mill-QⅡ型);其余试剂均为分析纯;30批舒血宁注射液为河北神威药业股份有限公司提供。
1.3 色谱条件Accurasil C18柱(4.6×250 mm,5 μm);流动相:乙腈-水(5:1)(A)-pH 6.5的乙酸铵(0.10 mol/L)水溶液(B),梯度洗脱;流速为1 mL/min;温度:35 ℃;进样量:5 μL。梯度洗脱程序如下:0~5 min,6%A;5~6 min,6%~10%A;6~8min,10%~13%A;8~11 min,13%A;11~13 min,13%~13.5%A;13~20 min,13.5%~28%A;20~25 min,28%~30%A;25~35 min,30%~36%A;35~40 min,36%~100%A。
1.4 衍生剂的制备异硫氰酸苯酯(PITC)衍生化试剂的配置方法:精密量取PITC 0.6 mL置于50 mL容量瓶中,加乙腈混匀,定容,即得。三乙胺(TEA)溶液的配置方法:精密量取TEA 7 mL置于50 mL容量瓶中,加入乙腈混匀,定容,即得。
1.5 对照品储备液的制备精密称取天门冬氨酸、苏氨酸、丙氨酸、甲硫氨酸对照品,加0.1 mol/L的盐酸配成对照品储备液,依次稀释至不同的浓度,分别取不同浓度的对照品溶液200 μL,加入600 μL的PITC,600 μL的TEA,超声衍生60 min,正己烷萃取,取下层溶液14 000 r/min离心10 min。置4℃冰箱中保存备用。
1.6 样品溶液的制备精密量取200 μL舒血宁注射液,加入600 μL的PITC,混匀后,加入600 μL的TEA,混匀,超声衍生60 min,取溶液,用正己烷萃取,取下层溶液,离心,取上清液,作为样品溶液。
2 结果 2.1 方法学验证 2.1.1 标准曲线、线性范围、检验限(LOD)和定量限(LOQ)将上述对照品按照确定的色谱条件分别进样,记录峰面积,以浓度为横坐标、峰面积为纵坐标,绘制标准曲线,求得回归方程。天门冬氨酸、苏氨酸、丙氨酸、甲硫氨酸标准曲线的回归方程、线性范围、LOD和LOQ见表 1。
| 氨酸类型 | 回归方程 | 线性范围 (μg/mL) | r2 | LOD (μg/mL) | LOQ (μg/mL) |
| 天门冬氨酸 | Ŷ=2035.5X+7517 | 0.094~146 | 0.9989 | 0.014 | 0.053 |
| 苏氨酸 | Ŷ=10764X-49864 | 0.469~293 | 0.9977 | 0.018 | 0.469 |
| 丙氨酸 | Ŷ=14203X-1037.8 | 0.127~158 | 0.9997 | 0.035 | 0.117 |
| 甲硫氨酸 | Ŷ=28146X+21368 | 0.914~286 | 0.9999 | 0.071 | 0.214 |
吸取200 μL舒血宁注射液,加入600 μL的PITC,混匀,再加入600 μL的TEA,混匀,超声60 min,取溶液,用正己烷萃取,取下层溶液,离心,得上清液,按色谱条件进样5 μL,连续进样6次。结果峰面积RSD分别为1.51%、2.83%、2.01%、2.01%。实验结果表明所建立的方法精密度良好。
2.1.3 重复性吸取200 μL舒血宁注射液,加入600 μL的PITC,混匀,再加入600 μL的TEA,混匀,超声60 min,取溶液,用正己烷萃取,取下层溶液,离心,得上清液,按色谱条件进样5 μL,连续进样6次。重现性RSD实验结果分别为0.75%、2.55%、1.49%和2.18%。实验结果表明测定方法重现性良好。
2.1.4 稳定性取同一样品溶液,分别在0、2、4、8、12、24 h后进样5 μL,测定天门冬氨酸、苏氨酸、丙氨酸、甲硫氨酸的峰面积。结果峰面积RSD分别为1.99%、3.47%、2.37%、2.75%。可见样品在24 h内稳定性良好。
2.1.5 加样回收率取舒血宁注射液100 μL,加入100 μL的对照品溶液,加入600 μL的PITC衍生,600 μL的TEA扫尾,超声提取60 min,正己烷萃取,取下层溶液离心,平行6次,按色谱条件进样5 μL。另取样品200 μL,加入600 μL的PITC衍生,600 μL的TEA扫尾,室温下超声提取60 min,正己烷萃取,取下层溶液离心,平行6次,按色谱条件进样5 μL。
按公式:(测得量-样品中的含量)/加入量=回收率,计算加样回收率,见表 2。
| 氨酸类型 | 测得量 (μg/mL) | 加入量 (μg/mL) | 样品中的含量 (μg/mL) | 回收率 (%) | 平均回收率 (%) | RSD (%) | |
| 天门冬氨酸 | 1 | 104.24 | 56.84 | 50.19 | 95.1 | 98.6 | 2.84 |
| 2 | 107.79 | 56.84 | 49.41 | 103.0 | |||
| 3 | 105.76 | 56.84 | 49.70 | 98.6 | |||
| 4 | 107.95 | 56.84 | 50.77 | 101.0 | |||
| 5 | 106.61 | 56.84 | 50.82 | 98.2 | |||
| 6 | 106.43 | 56.84 | 51.77 | 96.2 | |||
| 苏氨酸 | 1 | 88.71 | 45.31 | 45.42 | 95.6 | 95.6 | 0.62 |
| 2 | 87.69 | 45.31 | 44.21 | 96.0 | |||
| 3 | 87.82 | 45.31 | 44.66 | 95.3 | |||
| 4 | 89.62 | 45.31 | 45.90 | 96.5 | |||
| 5 | 89.05 | 45.31 | 46.10 | 94.8 | |||
| 6 | 87.50 | 45.31 | 44.10 | 95.8 | |||
| 丙氨酸 | 1 | 9.01 | 5.13 | 3.68 | 104.0 | 98.5 | 2.97 |
| 2 | 8.34 | 5.13 | 3.34 | 97.5 | |||
| 3 | 8.86 | 5.13 | 3.84 | 98.0 | |||
| 4 | 8.56 | 5.13 | 3.55 | 97.7 | |||
| 5 | 8.22 | 5.13 | 3.34 | 95.3 | |||
| 6 | 8.90 | 5.13 | 3.84 | 98.7 | |||
| 甲硫氨酸 | 1 | 1 444.45 | 677.79 | 760.72 | 101.0 | 98.9 | 1.34 |
| 2 | 1 460.86 | 677.79 | 794.10 | 98.4 | |||
| 3 | 1 426.53 | 677.79 | 765.88 | 97.5 | |||
| 4 | 1 451.01 | 677.79 | 773.59 | 100.0 | |||
| 5 | 1 454.53 | 677.79 | 792.21 | 97.7 | |||
| 6 | 1 444.09 | 677.79 | 771.22 | 99.3 |
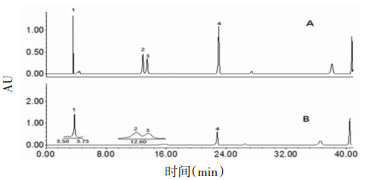
按照上述色谱条件进样,测得峰面积,计算天门冬氨酸、苏氨酸、丙氨酸、甲硫氨酸的含量。色谱图见图 1,样品测定结果见表 3。
|
|
(A)4种氨基酸对照品;(B)舒血宁注射液样品色谱图 1:天门冬氨酸;2:苏氨酸;3:丙氨酸;4:甲硫氨酸 图 1 典型色谱图 |
| μg/mL | |||||
| 批次 | 天门冬氨酸 | 苏氨酸 | 丙氨酸 | 甲硫氨酸 | 总含量 |
| 1 | 169.46 | 54.52 | 3.91 | 1 589.37 | 1 817.26 |
| 2 | 86.95 | 51.71 | 3.15 | 1 555.82 | 1 697.63 |
| 3 | 138.60 | 60.49 | 5.31 | 1 827.54 | 2 031.95 |
| 4 | 77.36 | 53.53 | 5.00 | 1 596.54 | 1 732.43 |
| 5 | 93.42 | 49.06 | 4.10 | 1 537.76 | 1 684.34 |
| 6 | 89.49 | 50.41 | 4.48 | 1 625.61 | 1 770.00 |
| 7 | 84.75 | 46.99 | 3.96 | 1 590.16 | 1 725.86 |
| 8 | 78.32 | 48.42 | 4.76 | 1 747.86 | 1 879.37 |
| 9 | 168.08 | 49.21 | 2.36 | 1 511.39 | 1 731.04 |
| 10 | 116.00 | 50.08 | 2.40 | 1 537.89 | 1 706.37 |
| 11 | 159.86 | 50.72 | 2.54 | 1 578.61 | 1 791.72 |
| 12 | 128.53 | 53.83 | 3.37 | 1 549.66 | 1 735.39 |
| 13 | 108.29 | 52.54 | 3.68 | 1 547.54 | 1 712.05 |
| 14 | 114.06 | 52.76 | 3.34 | 1 521.44 | 1 691.59 |
| 15 | 114.66 | 54.96 | 3.84 | 1 588.20 | 1 761.66 |
| 16 | 101.44 | 54.52 | 3.55 | 1 531.75 | 1 691.26 |
| 17 | 95.37 | 52.76 | 3.34 | 1 547.18 | 1 698.65 |
| 18 | 102.12 | 54.96 | 3.84 | 1 584.42 | 1 745.33 |
| 19 | 109.83 | 54.52 | 3.55 | 1 542.44 | 1 710.34 |
| 20 | 83.35 | 52.90 | 3.26 | 1 560.90 | 1 700.41 |
| 21 | 103.83 | 52.11 | 3.57 | 1 542.62 | 1 702.13 |
| 22 | 97.25 | 51.64 | 3.41 | 1 534.23 | 1 686.53 |
| 23 | 91.15 | 52.70 | 3.21 | 1 533.25 | 1 680.30 |
| 24 | 103.82 | 53.17 | 2.99 | 1 561.50 | 1 721.48 |
| 25 | 60.42 | 54.49 | 3.36 | 1 574.68 | 1 692.96 |
| 26 | 92.37 | 52.00 | 1.16 | 1 562.13 | 1 707.65 |
| 27 | 90.96 | 52.00 | 1.16 | 1 533.09 | 1 677.20 |
| 28 | 86.83 | 54.86 | 0.59 | 1 591.76 | 1 734.03 |
| 29 | 211.00 | 51.73 | 0.03 | 1 525.45 | 1 788.21 |
本研究分别考察了流动相组成[乙腈-水,乙腈-水(5:1)-乙酸钠缓冲溶液(pH 6.5)]对4种氨基酸色谱分离的影响,研究结果表明采用梯度洗脱方式,以乙腈-水(5:1)-乙酸钠缓冲溶液(pH 6.5)为流动相,4种氨基酸分离效果较好,且峰形较佳。本研究最终确定了乙腈-水(5:1)-乙酸钠缓冲溶液为分离舒血宁注射液中氨基酸的最佳流动相。
由于氨基酸没有紫外吸收,不能用紫外直接检测,需要衍生后在紫外下才可检测。异硫氰酸苯酯是常用氨基酸测定的衍生试剂, 与氨基酸衍生化反应迅速,所得产物稳定,同时柱前衍生高效液相色谱法具有分析时间短,选择性强,节约成本等特点。因此,本文采用PITC柱前衍生高效液相色谱检测方法,对舒血宁注射液中的4种氨基酸进行定量分析,结果表明这种方法稳定、准确、快速,能够准确测定舒血宁注射液中的4种氨基酸含量。
通过对舒血宁注射液中的氨基酸进行检测,4种氨基酸的总含量为1 738.47 μg/mL。其中,甲硫氨酸含量最高,其原因可能与甲硫氨酸是舒血宁注射液的辅料有关。丙氨酸的含量较低,在0.03~5.31 μg/mL范围内,含量波动较大。30批舒血宁注射液各批次间4种氨基酸总含量方差分析结果表明,各批次间4种氨基酸的总含量几乎没有显著的差异(P > 0.05)。本文建立了同时测定舒血宁注射液天门冬氨酸、苏氨酸、丙氨酸、甲硫氨酸4种氨基酸柱前衍生高效液相色谱方法,为舒血宁注射液中氨基酸的含量测定提供了技术支撑。
4 结论本文建立了PITC柱前衍生同时分离并测定了舒血宁注射液中4种游离氨基酸的分析方法,具有操作简便,准确快速的特点,可用于舒血宁注射液中氨基酸的质量控制。
| [1] | 刘娜, 王文平, 康倩, 等. 银杏叶黄酮类成分体外及经肠吸收后抗氧化活性比较[J]. 天津中医药, 2015, 32(1): 42–45. DOI:10.11656/j.issn.1673-9043.2015.01.12 |
| [2] | 史勇, 王雷. 舒血宁注射液药理作用研究新进展[J]. 医学综述, 2012, 18(10): 1555–1557. |
| [3] | 张亚军. 舒血宁注射液的临床应用近况[J]. 实用心脑肺血管病杂志, 2014, 22(6): 97. |
| [4] | 王强, 姜希娟, 范英昌, 等. 银杏叶提取物EGB761对高胆固醇血症家兔血脑屏障通透性的影响[J]. 天津中医药大学学报, 2010, 29(1): 30–32. DOI:10.11656/j.issn.1673-9043.2010.01.11 |
| [5] | 高青, 马东明, 胡先同, 等. 银杏叶提取物对家兔高胆固醇血症模型脑组织形态学的影响[J]. 天津中医药, 2015, 32(3): 11. |
| [6] | 孙璐, 刘睿, 赵雯, 等. 苦碟子注射液中4种氨基酸含量的测定[J]. 天津中医药, 2015, 32(2): 106–109. DOI:10.11656/j.issn.1672-1519.2015.02.11 |
| [7] | 郑灏, 程显隆, 魏锋, 等. 雷丸中16种氨基酸的柱前衍生化RP-HPLC法含量测定[J]. 药物分析杂志, 2011, 31(9): 1631–1635. |
| [8] | 李梅, 陆敏仪, 刘华钢. 反相高效液相色谱法测定舒血宁注射液中银杏总黄酮苷的含量[J]. 广西医科大学学报, 2001, 18(3): 390–392. |
| [9] | 苏雪清, 黄燕萍. 舒血宁注射液中5-羟甲基糠醛的含量测定[J]. 天津药学, 2013, 25(1): 7–9. |
| [10] | 于宏晓, 赵曰利, 徐海涛, 等. 氨基酸分析技术的研究进展[J]. 农产品加工·学刊, 2011(3): 44–47. |
| [11] | 康春生, 于灏, 汪发文, 等. 氨基酸柱前衍生HPLC分析方法的应用[J]. 口腔护理用品工业, 2014, 24(4): 48–50. |
| [12] | 贾薇, 陈涛, 李进. 中药中氨基酸含量测定的研究概况[J]. 天津药学, 2009, 21(5): 50–52. |
| [13] | 郭俊国, 解孝锋, 毕宏生. PITC柱前衍生HPLC法测定茺蔚子中游离和水解氨基酸的含量[J]. 中华中医药杂志, 2015, 30(1): 91–94. |
| [14] | 张春艳, 董伟林, 王润玲. HPLC法测定家兔模型肠梗阻后血浆中瓜氨酸含量[J]. 天津医科大学学报, 2013, 19(3): 238–240. |
| [15] | 刘红丽, 曹元龙. 高效液相色谱邻苯二甲醛衍生化法测氨基酸[J]. 河南预防医学杂志, 1998, 9(4): 231–232. |
| [16] | 周婷, 程威威, 林亲录, 等. 丹磺酰氯柱前衍生发芽糙米中γ-氨基丁酸的HPLC分析[J]. 食品科技, 2014, 39(1): 282–286. |
| [17] | 瞿其曙, 汤晓庆, 胡效亚, 等. 柱前衍生法在氨基酸分析测定中的应用[J]. 化学进展, 2006, 18(6): 789–793. |
 2017, Vol. 36
2017, Vol. 36