文章信息
- 朱蕴朱蕴, 顾星顾星, 张兵张兵, 祁东利祁东利, 刘志东刘志东, 魏子斌魏子斌
- ZHU Yun, GU Xing, ZHANG Bing, QI Dong-li, LIU Zhi-dong, WEI Zi-bin
- 基于尤斯灌流室技术的泽泻汤大鼠肠吸收研究
- Rat intestinal absorption study of Zexie decoction with Ussing chamber by UPLC-MS/MS
- 天津中医药大学学报, 2017, 36(4): 299-302
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(4): 299-302
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.04.16
-
文章历史
收稿日期: 2017-04-10
2. 天津中医药大学, 现代中药发现与制剂技术教育部工程研究中心, 天津 300193
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin 300193, China
泽泻汤由泽泻和白术两味药组成,复方出自东汉张仲景的《金匮要略》,是临床治疗痰饮眩晕、水肿、高脂血症等疾病的要方。泽泻化学成分主要有泽泻醇类原萜醇三萜化合物[1],白术主要含有白术内酯Ⅱ和Ⅲ[2-4]。泽泻汤是口服复方汤剂,汤剂中主要成分的肠吸收情况直接影响复方的疗效,所以研究泽泻汤成分的肠吸收显得尤为重要。有文献报道采用Caco-2细胞研究白术内酯Ⅱ、Ⅲ单体成分的肠吸收[5],但中药复方含有成分众多,复方中成分的肠吸收由于其他成分的存在可能与单体成分的肠吸收不同,而泽泻汤复方中白术内酯类成分的肠吸收还未见报道。本文采用尤斯灌流室技术研究泽泻汤中成分白术内酯Ⅱ和Ⅲ在大鼠不同离体肠段的跨膜吸收特征,为泽泻汤复方的口服体内吸收研究提供依据。
1 仪器与材料 1.1 仪器EM-CSYS-8型尤斯灌液室(美国Physiologic Instruments公司),Agilent 1290 UPLC串联Agilent 6460型三重四级杆质谱仪,配备电喷雾离子源(美国Agilent公司),冷冻离心机(美国Thermo公司),Milli-Q超纯水系统(美国Millipore公司),DKB-501A型超级恒温水浴槽(上海精宏实验设备有限公司),C3860A超声清洗器(天津Autoscience公司)。
1.2 材料白术内酯Ⅱ、白术内酯Ⅲ(纯度>99%,中国食品药品检定研究院),琼脂糖(上海生工生物有限公司),乙腈(美国Fisher),甲酸(日本东京化成工业株式会社),氯化钠(NaCl)、氯化钾(KCl)、磷酸二氢钠(NaH2PO4)、碳酸氢钠(NaHCO3)、氯化钙(CaCl2)、六水氯化镁(MgCl2·6H2O)、葡萄糖(天津风船化学试剂科技有限公司)。泽泻饮片(批号:四川201509)、白术饮片(批号:河北201509)由正大青春宝药业有限公司提供,经天津中医药大学中医药研究中心刘志东博士鉴定为泽泻[Alisma orientalis(Sam.)Juzep.]、白术(Atractylodes macrocephala Koidz.)。
1.3 实验动物SD大鼠,雄性,体质量200~230 g,购自中国人民解放军军事医学科学院卫生学环境医学研究所动物实验中心,合格证编号:SCXK-(军)2014-0001。
2 方法与结果 2.1 色谱条件色谱柱:Agilent Zorbax Plus C18柱(2.1 mm×50 mm,1.8 μm),保护柱:Agilent Zorbax Plus C18柱(2.1 mm×5 mm,1.8 μm),流动相:乙腈-0.1%甲酸水(42:58),流速:0.3 mL/min,进样量:3 μL。
2.2 质谱条件阳离子MRM模式,Gas Temperature:350 ℃,Gas Flow:13 L/min,Nebulizer:15 psi,白术内酯Ⅱ,Fragmentor电压110 V,碰撞能量13 V,离子反应为m/z233→m/z187。白术内酯Ⅲ,Fragmentor电压100 V,碰撞能量17 V,离子反应为m/z249.15→m/z231。
2.3 溶液配制 2.3.1 K-R液的制备5.56 g CaCl2,7.01 g KCl,4.88 g MgCl2·6H2O,3.74 g NaH2PO4·2H2O溶于1 000 mL去离子水中,作为储备液。称取13.67 g NaCl,4.20 g NaHCO3,3.96 g葡萄糖,加入储备液100 mL,加入去离子水至2 000 mL,通入95%O2 0.5 h。
2.3.2 标准溶液的配制精密称取白术内酯Ⅱ、白术内酯Ⅲ 2 mg分别置于50 mL容量瓶,乙腈定容至刻度,摇匀,为标准品储备液。
2.3.3 给药侧药液的配制取泽泻15 g,白术6 g,加水400 mL浸泡30 min,以多功能煎药砂锅武火加热至沸腾,浓缩至药液约200 mL,400目纱布过滤。提取液经减压干燥,真空干燥箱烘干。取干膏6.8 g于50 mL容量瓶中,K-R液溶解,超声30 min,冷却后定容,得给药侧药液,用于肠黏膜给药,药物浓度为白术内酯Ⅱ9.15 μg/mL,白术内酯Ⅲ22.43 μg/mL。
2.4 方法学分别以空白K-R液,标准品溶液,样品溶液进针,白术内酯Ⅲ保留时间为3.8 min,白术内酯Ⅱ保留时间为8.5 min,专属性良好。取标准品储备液,K-R液依次稀释至420、160、80、32、16、4 ng/mL,以峰面积对浓度作图,得标准曲线。白术内酯Ⅱ标曲为Ŷ=16.908 929X-9.122 124(r2=0.999)。白术内酯Ⅲ标曲为Ŷ=54.778 906X+61.637 786(r2=0.999)。精密度符合要求,样品溶液12 h内稳定。
2.5 尤斯灌流室法测定样品的肠吸收实验大鼠禁食12 h,自由饮水,脊椎脱臼处死,沿腹中线打开腹腔,从幽门下5 cm起取10 cm小肠作为十二指肠,接着取10 cm作为空肠,回盲部前10 cm小肠作为回肠,盲肠下2 cm起取6 cm作为结肠。生理盐水清洗后,迅速置于K-R液中冰浴5 min,各肠段分别剪取3~4 cm长的部分,迅速剥离并去除浆膜侧的浆膜层,将肠黏膜固定在扩散室中。黏膜侧为给药侧,加入5 mL药液;浆膜侧为接收侧,加入5 mL K-R液。扩散池的两边均通入混合气体(95%O2、5%CO2),并以水浴维持37.5 ℃恒温。分别在30、45、60、90、120、150、180 min时,取出0.5 mL接收液,同时立即补充同温度同体积的K-R液,接收液10 000 r/min离心15 min,取上清测定含量[6-8]。
采用以下公式计算实验结果:
累积透过量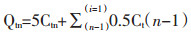
其中0.5和5表示取样体积和加入药液量,分别为0.5 mL和5 mL。根据给药剂量D,计算累积透过率(Qtn/D×100%)。表观渗透系数(Papp)是表示药物经黏膜透过能力的重要指标,其计算公式为:Papp=(dQ/dt)×(1/AC0),单位:cm/s,其中dQ/dt表示稳态时时间-累积透过量线性回归所得的斜率,A为有效渗透面积,C0为加入药液侧初始药物浓度。
所有数据均采用SPSS 18.0统计软件进行分析,计量资料以平均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义,结果见图 1。
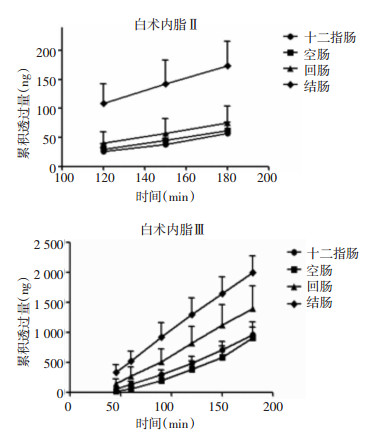
|
| 图 1 白术内酯在各肠段的累积透过量 |
泽泻汤中白术内酯Ⅱ在各肠段累积透过率随时间延长而增加,其中在结肠透过率最高,结肠180 min的累积透过量为234 ng,累积透过率为3.25%。白术内酯Ⅲ的累积透过率同样在结肠最高,结肠180 min的累积透过量为2 246 ng,累积透过率为4.32%。
白术内酯Ⅱ在大鼠各肠段的表观渗透系数范围在(6.10×10-6~25.22×10-6)cm/s之间,大小顺序为结肠>回肠>空肠>十二指肠;白术内酯Ⅲ在(1.88×10-6~5.41×10-6)cm/s之间,大小顺序是结肠>回肠>十二指肠>空肠。见表 1、表 2。
| 肠段 | Papp(×10-6cm/s) | 平均系数 (x±s) | RSD (%) | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| 十二指肠 | 8.59 | 13.99 | 11.77 | 8.86 | 9.83 | 7.63 | 10.11±2.36 | 23.37 |
| 空肠 | 9.42 | 10.12 | 10.26 | 8.59 | 9.29 | 14.00 | 10.28±1.92 | 18.68 |
| 回肠 | 7.90 | 10.68 | 6.10 | 11.93 | 15.67 | 13.59 | 10.98±3.55 | 32.35 |
| 结肠 | 23.97 | 15.80 | 25.22 | 21.20 | 18.58 | 21.34 | 21.20±3.46**##△△ | 16.44 |
| 注:与十二指肠相比,**P<0.01;与空肠相比,##P<0.01;与回肠相比,△△P<0.01。 | ||||||||
| 肠段 | Papp(×10-6cm/s) | 平均系数 (x±s) | RSD (%) | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |||
| 十二指肠 | 2.11 | 2.71 | 2.77 | 3.17 | 2.46 | 1.88 | 2.52±0.47 | 18.56 |
| 空肠 | 2.52 | 2.31 | 2.35 | 2.15 | 2.21 | 3.27 | 2.47±0.41 | 16.70 |
| 回肠 | 2.48 | 3.98 | 2.81 | 3.83 | 4.15 | 3.50 | 3.46±0.67*# | 19.50 |
| 结肠 | 4.83 | 4.21 | 5.41 | 4.46 | 3.90 | 4.90 | 4.62±0.54**##△△ | 11.64 |
| 注:与十二指肠相比,*P<0.05,**P<0.01;与空肠相比,#P<0.05,##P<0.01;与回肠相比,△△P<0.01。 | ||||||||
白术内酯Ⅲ母离子为249 [M+H]+,离子碎片主要有231+、183.1+、171+、105+,选择离子丰度最高的碎片离子231 [M+H-H2O]+作为检测离子;白术内酯Ⅱ母离子为233[M+H]+,离子碎片主要有187+、130.9+、115.6+、105+,选择离子丰度最高的碎片离子187 [M+H-H2O-CO]+作为检测离子[9-10]。
肠黏膜保持良好的活性,才能维持膜的完整性,这样得到的成分渗透性数据才能可信。跨膜电位差(Vt)是肠黏膜活性的重要指标,文献报道实验过程中当Vt大于4 mV,表明肠黏膜活性良好。本实验实时监控整个操作过程中肠黏膜的Vt,组织电位差在4 mV以上为有效数据[11-12]。
白术内酯Ⅱ在各肠段的累积透过率均低于3.25%,白术内酯Ⅲ在各肠段的累积透过率均低于4.32%,符合漏槽条件[13]。实验条件下,给药侧白术内酯Ⅱ和Ⅲ在3 h保持稳定。通常药物主要在小肠吸收,因为小肠的有效吸收面积比其他肠段大很多。本实验发现泽泻汤中白术内酯Ⅱ和Ⅲ与其他药物不同,在结肠的吸收显著大于十二指肠、空肠和回肠3个肠段,具有区域选择性吸收。
Caco-2细胞是研究药物跨膜转运的常用方法,文献采用Caco-2细胞进行不同化合物的膜渗透性研究[14],提出:1)化合物Papp>1.0×10-6 cm/s,属于高渗透性化合物;2)化合物0.1×10-6 cm/s<Papp<1.0×10-6 cm/s,属于中等渗透性化合物;3)化合物Papp<0.1×10-6 cm/s,属于低渗透性化合物。文献报道[8]Caco-2细胞研究的白术内酯Ⅱ的Papp值为19.46×10-6 cm/s,白术内酯Ⅲ的Papp值为27.39×10-6 cm/s,指出这两个成分均为高渗透性药物。
大鼠不同肠段的尤斯灌流室吸收研究[15-17]显示,以美托洛尔为代表的高渗透性药物的Papp值在(11.40×10-6~100.26×10-6)cm/s,以阿替洛尔为代表的低渗透性药物的Papp值在(0.88×10-6~8.25×10-6)cm/s。本实验泽泻汤中白术内酯Ⅱ在大鼠各肠段的表观渗透系数范围在(6.10×10-6~25.22×10-6)cm/s之间,白术内酯Ⅲ在(1.88×10-6~5.41×10-6)cm/s之间,根据上述尤斯灌流室研究的判断标准,泽泻汤中白术内酯Ⅱ属于高渗透性药物,而白术内酯Ⅲ属于低渗透性药物。据此可知,本文复方中白术内酯Ⅲ的渗透性结果与文献报道结果[8]不同,可能的原因:第一,本文用尤斯灌流室法研究成分的肠吸收,与文献所用Caco-2细胞法不同;第二,本文是研究复方中成分而非单体的肠吸收,复方中其他成分可能影响了肠黏膜的紧密连接[18-19]或药物转运蛋白[11],从而影响了成分的渗透性。
| [1] | 彭贤, 黄舒, 郦皆秀, 等. 泽泻属植物化学成分与药理活性[J]. 国外医药:植物药分册, 2000, 15(6): 245–247. |
| [2] | 李伟, 文红梅, 崔小兵, 等. 白术的化学成分研究[J]. 中草药, 2007, 38(10): 1460–1462. DOI:10.3321/j.issn:0253-2670.2007.10.008 |
| [3] | 杨娥, 钟艳梅, 冯毅凡. 白术化学成分和药理作用的研究进展[J]. 广东药学院学报, 2012, 28(2): 218–221. |
| [4] | 凌宗全. 白术化学成分及药理作用研究进展[J]. 内蒙古中医药, 2013, 32(4): 105–106. |
| [5] | Guo J, Xu W, Yang XW. Intestinal permeability of atractylenolides across the human Caco -2 cell monolayer model[J]. Journal of Chinese Pharmaceutical Sciences, 2011, 20(5): 505–509. |
| [6] | 黎国富, 杨劲, 华小懿, 等. Ussing Chamber模型研究甘草酸二胺经大鼠肠黏膜的转运和代谢[J]. 中国中药杂志, 2010, 35(17): 2261–2266. |
| [7] | 孙亚彬, 李国峰, 刘思佳, 等. 应用Ussing Chamber技术评价甘草与海藻的配伍对大鼠肠黏膜P-gp的影响[J]. 中国药学杂志, 2010, 45(8): 585–589. |
| [8] | Cardinali A, Rotondo F, Minervini F, et al. Assessment of verbascoside absorption in human colonic tissues using the Ussing chamber model[J]. Food Research International, 2013, 54(1): 132–138. DOI:10.1016/j.foodres.2013.06.017 |
| [9] | Chen LL, Qi J, Chang YX, et al. Identification and determination of the major constituents in traditional Chinese medicinal formula Danggui -Shaoyao -San by HPLC-DAD-ESI-MS/MS[J]. Journal of Pharmaceitical and Biomedical Analysis, 2009, 50(2): 127–137. DOI:10.1016/j.jpba.2009.03.039 |
| [10] | Yan H, Sun YY, Zhang QL, et al. Simultaneous determination and pharmacokinetic study of Atractylenolide Ⅰ, Ⅱ and Ⅲ in rat plasma after intragastric administration of Baizhufuling extract and Atractylodis extract by UPLC-MS/MS[J]. Journal of Chromatography B, 2015, 993-994: 86–92. DOI:10.1016/j.jchromb.2015.05.006 |
| [11] | Chen L, Yang J, Davey AK, et al. Effects of diammonium glycyrrhizinate on the pharmacokinetics of aconitine in rats and the potential mechanism[J]. Xenobiotica, 2009, 39(12): 955–963. DOI:10.3109/00498250903271997 |
| [12] | Li HY, Sheppard DN, Hug MJ. Transepithelial electrical measurements with the Ussing chamber[J]. Journal of Cystic Fibrosis, 2004, 3(3): 123–126. |
| [13] | 沃特贝恩德. 药物生物利用度[M]. 北京: 化学工业出版社, 2007 |
| [14] | Artursson P, Karlsson J. Correlation between oral drug absorption in humans and apparent drug permeability coefficients in human intestinal epithelial (Caco-2) cells[J]. Biochem Biophys Res Commun, 1991, 175(3): 880–885. DOI:10.1016/0006-291X(91)91647-U |
| [15] | Lennernäs H. Animal data:The contributions of the Ussing Chamber and perfusion systems to predicting human oral drug delivery in vivo[J]. Advanced Drug Delivery Reviews, 2007, 59(11): 1103–1120. DOI:10.1016/j.addr.2007.06.016 |
| [16] | Lennernäs H, Nylander AS, Ungell L. Jejunal Permeability:A comparison between the Ussing Chamber technique and the single -pass perfusion in humans[J]. Phamaceutical Researh, 1997, 14(5): 667–671. |
| [17] | Ungell AL, Nylander S, Bergstrand S, et al. Membrane transport of drugs in different regions of the intestinal tract of the rat[J]. Journal of pharmaceutical sciences, 1998, 87(3): 360–366. DOI:10.1021/js970218s |
| [18] | Doo MH, Li H, Jang HI, et al. Effect of nonylphenol ethoxy-lates (NPEs) on barrier functions of epithelial cell mem-branes:Opening of tight junctions and competitive inhibi-tion of P -gp -mediated efflux[J]. International Journal of Pharmaceutics, 2005, 302(1-2): 145–153. DOI:10.1016/j.ijpharm.2005.06.014 |
| [19] | Fu QX, Wang HZ, Xia MX, et al. The effect of phytic acid on tight junctions in the human intestinal Caco-2 cell line and its mechanism[J]. European Journal of Pharmaceutical Sciences, 2015, 80(12): 1–8. |
 2017, Vol. 36
2017, Vol. 36