文章信息
- 王昊王昊, 夏明辉夏明辉, 庞旭庞旭, 韩立峰韩立峰, 张艳军张艳军
- WANG Hao, XIA Ming-hui, PANG Xu, HAN Li-feng, ZHANG Yan-jun
- 荷叶中苷类成分的分离鉴定
- Isolation and identification of glycosides from the leaves of Nelumbo nucifera Gaertn.
- 天津中医药大学学报, 2017, 36(5): 368-373
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(5): 368-373
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.05.13
-
文章历史
收稿日期: 2017-05-10
2. 沧州市中心医院, 沧州 061000;
3. 天津中医药大学中医药研究院, 天津 300193;
4. 天津中医药大学教务处, 天津 300193
2. Cangzhou central hospital, Cangzhou, Tianjin 061000, China;
3. Research Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;
4. Office of Academic Affairs, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
荷叶(Nelumbinis Folium)为睡莲科莲属植物莲(Nelumbo nucifera Gaertn.)的干燥叶,在中国大部分地区均有分布。2015版《中国药典》记载:“荷叶,味苦性平,归肝、脾、胃经,具有清暑化湿、升发清阳、凉血止血之功效,用于暑热烦渴、暑湿泄泻、脾虚泄泻、血热吐衄、便血崩漏等症。”[1]现代研究表明,荷叶主要含有黄酮、降倍半萜、生物碱、挥发油等化学成分,具有减肥降脂、降血压、祛痰止咳等广泛的药理作用[2-3]。本课题组对荷叶化学成分进行了系统研究[4-6],从其70%乙醇提取物中分离得到9个苷类化合物,它们分别为:异槲皮苷(1)、槲皮素-3-O-β-D-吡喃木糖-(1→2)-β-D-吡喃半乳糖苷(2)、槲皮素-3-O-β-D-葡萄糖醛酸-6″-甲酯(3)、槲皮素-3-O-β-D-葡萄糖醛酸-6″-乙酯(4)、山奈酚-3-O-β-D-吡喃半乳糖苷(5)、鼠李素-3-O-β-D-吡喃葡萄糖苷(6)、柯伊利素-7-O-β-D-吡喃葡萄糖苷(7)、(+)-松脂醇-4-O-β-D-吡喃葡萄糖苷(8)、(+)-表松脂醇-4′-O-β-D-吡喃葡萄糖苷(9),其中化合物3、4、8、9为首次从莲属植物中分离得到的化合物。
1 仪器与材料Agilent 1200系列高效液相色谱仪制备型:二元泵、7725i手动进样器、VWD检测器,美国Agilent公司;Waters 2695型高效液相色谱仪分析型:Waters 2695 Alliance Separation Module,Empower Pro工作站,Waters 2487双波长检测器,美国Waters公司。HPLC色谱柱[制备型:Cosmosil C18(250 mm × 20 mm,5 μm)],日本Cosmosil公司;分析型:YMC-Pack ODS-A[(250 mm×4.6 mm,5 μm),日本YMC公司)];Agilent 6520B型四级杆-飞行时间质谱仪,美国Agilent公司。Bruker Ascend 500 MHz超导核磁共振波谱仪,瑞士布鲁克公司。
可剪裁型硅胶GF254薄层层析板(天津思利达科技有限公司);展开剂:氯仿-甲醇-水(系列比例、下层);薄层显色剂:体积分数10%的硫酸乙醇溶液;正相硅胶(柱层析200~300目,青岛海洋化工厂);反相ODS(YMC-ODS-A-50 μm,120 Å,日本YMC公司);色谱纯甲醇、乙腈及分析纯乙醇、石油醚(60~90 ℃)、乙酸乙酯、正丁醇等(天津市康科德科技有限公司);分析纯三氯甲烷、二氯甲烷(天津市江天化工技术有限公司)。
20 kg荷叶药材购自河北安国市药材市场,经天津中医药大学中药学院张丽娟教授鉴定为睡莲科植物莲(Nelumbo mucifera Gaertn.)的干燥叶,药材标本保存于本实验室。
2 提取与分离荷叶药材(20 kg)经10倍量的70%乙醇回流提取两次,每次2 h,过滤,合并滤液,减压回收溶剂,最后50 ℃下真空干燥,得浸膏约2 400 g。取约2 200 g干膏加入2 L去离子水混悬,依次用石油醚(60~90 ℃)、二氯甲烷、乙酸乙酯以及正丁醇萃取,分别得石油醚萃取物32 g、二氯甲烷萃取物137 g、乙酸乙酯萃取物77 g以及正丁醇萃取物364 g。对乙酸乙酯层进行硅胶柱层析分离,先用氯仿洗脱,再以氯仿-甲醇-水(13:3:1→10:3:1→8.5:3:1→7:3:1)进行梯度洗脱,最后用甲醇洗脱,薄层检识,合并相同流分,得到7个流分[Fr.E1(21.5 g)、Fr.E2(7.4 g)、Fr.E3(6.7 g)、Fr.E4(5.9 g)、Fr.E5(4.5 g)、Fr.E6(2.8 g)、Fr.E7(7.1 g)]。Fr.E5和Fr.E6直接用制备型高效液相色谱仪进行分离纯化,分别得到化合物1(22.3 mg)和2(32.5 mg)。取其中Fr.E2经ODS柱色谱,MeOH-H2O梯度洗脱(30:70→40:60→50:50→60:40),HPLC检识,合并相同流分,共得到13组流分(Fr.E2-1~Fr.E2-13)。其中Fr.E2-3(311.3 mg)经制备高效液相色谱制备,分别得到化合物8(11.8 mg)和9(4.6 mg);Fr.E2-7(239.2 mg)经制备高效液相色谱分离纯化,分别得到化合物3(15.8 mg)和4(50.1 mg);Fr.E2-8(584.2 mg)经制备高效液相色谱分离,得到化合物6(34.0 mg)。Fr.E3经ODS柱色谱,MeOH-H2O梯度洗脱(40:60→50:50→60:40→100:0),合并相同流分,得到17组流分(Fr.E3-1~Fr.E3-17),Fr.E3-8(64.3 mg)经制备高效液相色谱分离纯化,分别得到化合物5(7.3 mg)和7(10.3 mg)。化合物1~9结构见图 1。
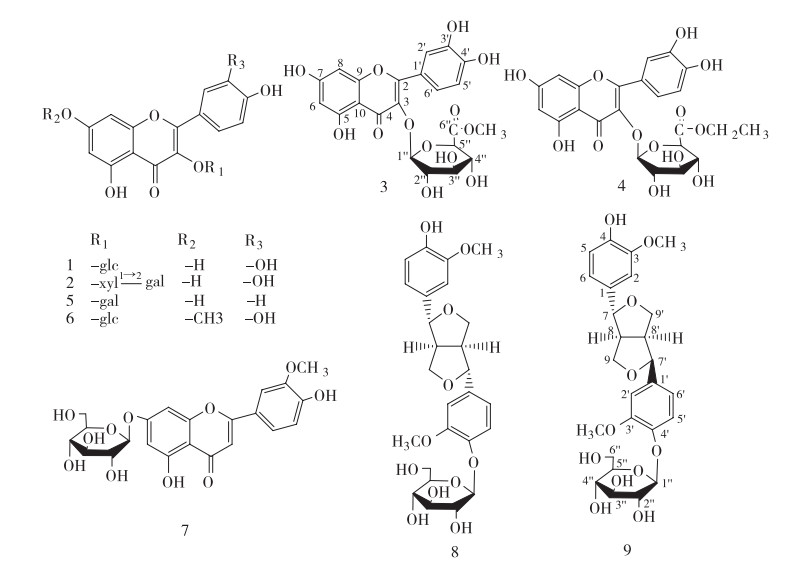
|
| 图 1 化合物1~9的结构 |
化合物1:黄色粉末,TLC板上,紫外灯254 nm下有一明显暗斑,用体积分数为10%的硫酸乙醇溶液呈亮黄色,推测其可能为黄酮类化合物。高分辨Q-TOF-MS给出其准分子离子峰m/z 465.102 2[M+H]+,确定其分子式为C21H20O12(Calcd. 465.102 8)。1H-NMR(500 MHz,DMSO-d6)谱中,最低场区δ 12.64为一个单峰,为5位羟基质子信号;低场区有3组氢信号,δ 7.59(1H,d,J=2.5 Hz),δ 6.84(1H,d,J=9.0 Hz)和δ 7.58(1H,dd,J=9.0,2.5 Hz)提示结构B环中存在一个ABX自旋耦合系统的苯环,则各自为H-2′,H-5′和H-6′。糖区信号:δ 5.46(1H,d,J=7.0 Hz,H-1"),δ 3.24(1H,m,H-2"),δ 3.24(1H,m,H-3"),δ 3.10(1H,m,H-4"),δ 3.10(1H,m,H-5"),δ 3.58(1H,d,J=11.0 Hz,H-6a")和δ 3.33(1H,m,H-6b")。13C-NMR(125 MHz,DMSO-d6)谱中总共有21个碳信号,其中一组信号δ[100.8、74.0、76.4、69.8、77.5、60.9]提示结构中存在1个葡萄糖取代基。δ 177.3(-C=O),δ 133.2(C-3)提示葡萄糖与C-3相连,核磁数据(见表 1)与文献数据[7]对比,基本一致,确定该化合物为槲皮素-3-O-β-D-吡喃葡萄糖苷。
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 2 | 156.0 | 155.2 | 156.2 | 156.3 | 156.4 | 156.5 | 164.2 |
| 3 | 133.2 | 132.9 | 132.9 | 133.1 | 133.1 | 133.5 | 103.2 |
| 4 | 177.3 | 177.3 | 176.9 | 177.1 | 177.3 | 177.5 | 181.9 |
| 5 | 161.1 | 161.2 | 161.1 | 161.1 | 161.1 | 160.8 | 161.0 |
| 6 | 98.6 | 98.5 | 98.9 | 98.8 | 98.8 | 97.8 | 99.4 |
| 7 | 164.1 | 163.9 | 165.1 | 164.4 | 159.8 | 164.9 | 162.9 |
| 8 | 93.4 | 93.3 | 93.6 | 93.6 | 93.7 | 92.0 | 94.9 |
| 9 | 156.2 | 156.1 | 156.3 | 156.5 | 156.1 | 156.2 | 156.9 |
| 10 | 103.8 | 103.7 | 103.4 | 103.8 | 103.6 | 104.9 | 105.3 |
| 1′ | 121.1 | 121.1 | 120.7 | 121.6 | 120.8 | 120.9 | 120.5 |
| 2′ | 116.1 | 115.7 | 115.9 | 116.0 | 130.9 | 116.3 | 110.2 |
| 3′ | 144.7 | 144.8 | 144.9 | 144.9 | 114.9 | 144.8 | 148.1 |
| 4′ | 148.4 | 148.4 | 148.7 | 148.6 | 159.9 | 148.6 | 151.2 |
| 5′ | 155.1 | 115.1 | 115.1 | 115.1 | 114.9 | 115.1 | 115.8 |
| 6′ | 121.5 | 122.2 | 121.5 | 120.8 | 130.9 | 121.5 | 121.0 |
| 1″ | 100.8 | 98.2 | 101.3 | 101.5 | 100.7 | 100.7 | 99.9 |
| 2″ | 73.9 | 79.7 | 73.7 | 73.7 | 71.1 | 73.9 | 73.1 |
| 3″ | 76.4 | 73.5 | 75.5 | 75.6 | 73.0 | 76.4 | 76.4 |
| 4″ | 69.8 | 67.6 | 71.3 | 71.3 | 67.8 | 69.8 | 69.5 |
| 5″ | 77.5 | 76.1 | 75.6 | 75.7 | 75.7 | 77.5 | 76.4 |
| 6″ | 60.9 | 59.9 | 168.8 | 168.3 | 60.1 | 60.9 | 60.6 |
| 1′″ | - | 104.6 | - | - | - | - | - |
| 2′″ | - | 73.8 | - | - | - | - | - |
| 3′″ | - | 75.8 | - | - | - | - | - |
| 4′″ | - | 69.3 | - | - | - | - | - |
| 5′″ | - | 65.6 | - | - | - | - | - |
| -CH2- | - | - | - | 60.5 | - | - | - |
| -CH3 | - | - | - | 13.7 | - | - | - |
| -OCH3 | - | - | 51.7 | - | - | - | 55.9 |
| Notes: Measured in DMSO-d6。 | |||||||
化合物2:黄色粉末,TLC板上,紫外灯254 nm下有一明显暗斑,用体积分数为10%的硫酸乙醇溶液显色呈亮黄色,推测其可能为黄酮类化合物。高分辨Q-TOF-MS给出其准分子离子峰m/z 597.144 6[M+H]+,确定其分子式为C26H28O16(Calcd. 597.1450)。1H-NMR(500 MHz,DMSO-d6)最低场区的δ 12.70提示结构中存在5-OH,低场区有3组氢信号,δ 7.52(1H,d,J=2.0 Hz,H-2′),δ 6.82(1H,d,J=8.5 Hz,H-5′)和δ 7.76(1H,dd,J=8.5,2.0 Hz,H-6′)提示结构B环中存在一个ABX自旋耦合系统的苯环。碳谱中总共有26个碳信号,黄酮母核有15个碳,所以推测该化合物有两个糖。δ 177.3(-C=O),δ 132.9(C-3)提示糖基与C-3相连,通过HMBC可以看出半乳糖基的端基氢δ 5.69(1H,d,J=8.0 Hz)与δ 132.9(C-3)相关,木糖端基氢δ 4.55(1H,d,J=7.5 Hz)与半乳糖2位δ 79.7(C-2")相关,可以推出木糖1位与半乳糖2位相连。核磁数据(见表 1)与参考文献[8]对照,基本一致,确定该化合物2为槲皮素-3-O-β-D-吡喃木糖-(1→2)-β-D-吡喃半乳糖苷。
化合物3:黄色粉末,TLC板上,紫外灯254 nm下有一明显暗斑,用体积分数为10%的硫酸乙醇溶液呈亮黄色,推测其可能为黄酮类化合物。高分辨Q-TOF-MS给出其准分子离子峰m/z 493.097 5[M+H]+,确定其分子式为C22H20O13(Calcd. 493.097 7)。1H-NMR(500 MHz,DMSO-d6)谱中,最低场区δ 12.53为一个单峰,为5位羟基质子信号;低场区有3组氢信号,δ 7.51(1H,d,J=2.0 Hz),δ 6.83(1H,d,J=8.0 Hz)和δ 7.57(1H,dd,J=2.0,8.0 Hz)提示结构B环中存在一个ABX自旋耦合系统的苯环,分别为H-2′,H-5′和H-6′。糖区信号:δ 5.46(1H,d,J=7.5 Hz,H-1"),δ 3.31(1H,m,H-2"),δ 3.30(1H,m,H-3"),δ 3.38(1H,m,H-4"),δ 3.30(1H,m,H-5")。13C-NMR(125 MHz,DMSO-d6)谱中总共有21个碳信号,其中一组信号δ[101.3、73.7、75.5、71.3、75.6、168.8]提示结构中存在1个葡萄糖取代基,但是葡萄糖中各碳的化学位移均有改变,提示葡萄糖苷中连有其它基团。δ 176.9(-C=O),δ 132.9(C-3)提示葡萄糖与C-3相连。在中高场δ 51.7提示结构中存在一个甲氧基,由HMBC可知,甲氧基与结构中葡萄糖苷δ 168.8(C-6")有相关,可确定甲氧基与其相连。核磁数据(见表 1)与文献数据[9]对比,基本一致,确定该化合物为槲皮素-3-O-β-D-葡萄糖醛酸-6″-甲酯。
化合物4:黄色粉末,TLC板上,紫外灯254 nm下有一明显暗斑,用体积分数为10%的硫酸乙醇溶液呈亮黄色,推测其可能为黄酮类化合物。高分辨Q-TOF-MS给出其准分子离子峰m/z 507.1137[M+H]+,确定其分子式为C23H22O13(Calcd. 507.113 3)。1H-NMR(500 MHz,DMSO-d6)谱中,最低场区δ 12.55为一个单峰,为5位羟基质子信号;低场区有3组氢信号,δ 7.54(1H,d,J=2.0 Hz,H-2′),δ 6.85(1H,d,J=8.0 Hz,H-5′)和δ 7.60(1H,dd,J=2.0,8.0 Hz,H-6′)提示结构B环中存在一个ABX自旋耦合系统的苯环。糖区信号:δ 5.45(1H,d,J=7.5 Hz,H-1"),δ 3.32(1H,m,H-2"),δ 3.30(1H,m,H-3"),δ 3.40(1H,m,H-4"),δ 3.32(1H,m,H-5")。13C-NMR(125 MHz,DMSO-d6)谱中总共有21个碳信号,其中一组信号δ[101.5、73.7、75.6、71.3、75.7、168.3]提示结构中存在1个葡萄糖取代基,但是葡萄糖中各碳的化学位移均有改变,提示葡萄糖苷中连有其它基团。δ 177.1(-C=O),δ 133.1(C-3)提示葡萄糖与C-3相连。中高场δ 60.5为一个CH2信号,高场δ 13.7为一个CH3信号,根据HSQC可知它们有相关,也与结构中葡萄糖苷δ 168.8(C-6″)有相关,可确定与其相连。核磁数据(见表 1)与文献数据[10]对比,基本一致,确定该化合物为槲皮素-3-O-β-D-葡萄糖醛酸-6″-乙酯。
化合物5:黄色粉末,TLC板上,紫外灯254 nm下有一明显暗斑,用体积分数为10%的硫酸乙醇溶液呈亮黄色,推测其可能为黄酮类化合物。高分辨Q-TOF-MS给出其准分子离子峰m/z 449.107 0[M+H]+,确定其分子式为C21H20O11(Calcd. 449.107 8)。1H-NMR(500 MHz,DMSO-d6)最低场区的δ 12.59提示结构中存在5-OH,低场区有2组氢信号,δ 8.06(2H,d,J=8.5 Hz),δ 6.86(2H,d,J=8.5 Hz)提示结构B环中存在一个AA′BB′自旋耦合系统的苯环,各自为H-2′,H-3′,H-5′和H-6′。中高场区δ 5.39(1H,d,J=7.5 Hz,H-1")为半乳糖端基氢信号。13C-NMR(125 MHz,DMSO-d6)谱中总共有21个碳信号,其中一组信号δ[101.7、71.1、73.0、67.8、75.7、60.1]提示结构中存在1个半乳糖取代基。δ 177.3(-C=O),δ 133.1(C-3)提示半乳糖与C-3相连,核磁数据(见表 1)与文献数据[11]对比,基本一致,确定该化合物为山奈酚-3-O-β-D-吡喃半乳糖苷。
化合物6:黄色粉末,TLC板上,紫外灯254 nm下有一明显暗斑,用体积分数为10%的硫酸乙醇溶液呈亮黄色,推测其可能为黄酮类化合物。高分辨Q-TOF-MS给出其准分子离子峰m/z 479.118 5[M+H]+,确定其分子式为C22H22O12(Calcd. 475.1184)。1H-NMR(500 MHz,DMSO-d6)谱中,最低场区δ 12.65为一个单峰,为5位羟基质子信号;低场区有3组氢信号:δ 7.61(1H,d,J=1.5Hz),δ 6.86(1H,d,J=8.5 Hz)和δ 7.62(1H,dd,J=1.5,8.5 Hz)提示结构B环中存在1个ABX自旋耦合系统的苯环,分别为H-2′,H-5′和H-6′。糖区信号:δ 5.49(1H,d,J=7.0 Hz,H-1"),δ 3.25(1H,m,H-2"),δ 3.24(1H,m,H-3"),δ 3.12(1H,m,H-4"),δ 3.11(1H,m,H-5"),δ 3.59(1H,d,J=11.0 Hz,H-6"a)和δ 3.35(1H,m,H-6"b)。13C-NMR(125 MHz,DMSO-d6)谱中总共有21个碳信号,其中一组信号δ[100.7、73.9、76.4、69.8、77.5、60.9]提示结构中存在1个葡萄糖取代基。δ 177.5(-C=O),δ 133.5(C-3)提示葡萄糖与C-3相连。在中高场δ 56.0提示结构中存在一个甲氧基,由HMBC可知,甲氧基与结构中A环的δ 164.9(C-7)有相关,可确定甲氧基与其相连。核磁数据(见表 1)与文献数据[12]对比,基本一致,确定该化合物为鼠李素-3-O-β-D-吡喃葡萄糖苷。
化合物7:黄色粉末,TLC板上,紫外灯254 nm下有一明显暗斑,用体积分数为10%的硫酸乙醇溶液显色呈亮黄色,推测其可能为黄酮类化合物。高分辨Q-TOF-MS给出其准分子离子峰m/z 463.123 1[M+H]+,确定其分子式为C22H22O11(Calcd. 463.1235)。1H-NMR(500 MHz,DMSO-d6)最低场区的δ 12.98提示结构中存在5-OH,低场区有1组ABX耦合氢信号:δ 7.59(1H,d,J=2.0 Hz,H-2′),δ 6.94(1H,dd,J=2.0,8.5 Hz,H-5′)和δ 7.59(1H,d,J=8.5 Hz,H-6′)。中低场区有一个d峰:δ 5.05(1H,d,J=9.0 Hz,H-1")为葡萄糖的端基氢信号。在中高场区δ 3.26-3.50(5H,m,H-2",3",4",5",6" a)和δ 3.72(1H,d,H-6"b)为葡萄糖的氢信号。13C-NMR(125 MHz,DMSO-d6)谱中总共有22个碳信号,其中一组信号δ[99.9、73.1、76.4、69.5、76.4、60.6]提示结构中存在1个葡萄糖取代基。在中高场δ 55.9提示结构中存在1个甲氧基,由HMBC可知,甲氧基与结构中B环中δ 148.1(C-3′)有相关,可确定甲氧基与其相连。核磁数据(见表 1)与文献数据[13]对比,基本一致,确定该化合物为柯伊利素-7-O-β-D-吡喃葡萄糖苷。
化合物8:淡黄色油状物,TLC板上,紫外灯254 nm下有一暗斑,用体积分数为10%的硫酸乙醇溶液显色呈紫色。[α]D23:+11.21°(c0.53,MeOH)。高分辨Q-TOF-MS给出其准分子离子峰m/z 543.183 0 [M+Na]+,确定其分子式为C26H32O11(Calcd. 543.1837)。1H-NMR(500 MHz,CD3OD)谱中,在低场区δ 6.7~7.2范围内有6组氢信号:δ 6.76(1H,d,J=8.0 Hz,H-5′)、δ 6.80(1H,d,J=8.5 Hz,H-6′)、δ 6.91(1H,d,J=8.5 Hz,H-6)、δ 6.94(1H,s,H-2′)、δ 7.02(1H,s,H-2)、δ 7.14(1H,d,J=8.5 Hz,H-5),提示结构中存在两个1,3,4取代的苯环。在中高场区有一个明显的d峰,根据峰面积及HSQC可知是两个单峰重叠,分别为δ 3.85(3H,s,-OCH3)、δ 3.86(3H,s,-OCH3),为两个甲氧基的氢信号。δ 3.85(2H,m,H-9)和δ 3.49(2H,m,H-9′)为两个亚甲基的氢信号;δ 3.12(2H,s,H-8,8′)和δ 4.70(2H,d,J=4.0 Hz,H-7′)、δ 4.75(2H,d,J=3.5 Hz,H-7)为两个次甲基的氢信号。糖区信号:δ 4.87(1H,s,H-1"),δ 3.48(1H,m,H-2"),δ 3.47(1H,m,H-3"),δ 3.44(1H,m,H-4"),δ 3.44(1H,m,H-5"),δ 3.85(1H,m,H-6" a),δ 4.23(1H,m,H-6"b)。13C-NMR(125 MHz,CD3OD)谱中显示有26个碳信号,其中一组信号δ(102.9、75.0、77.9、71.4、78.2、62.6)提示结构中存在1个葡萄糖取代基,由HMBC可知葡萄糖基与C-4有相关,可知它们相连。在中高场区δ 56.5和56.8为两个甲氧基上的碳信号,结合HMBC可知两个甲氧基分别连在C-3及C-3′上。核磁数据(见表 2)与文献数据[14]对比,基本一致,确定该化合物为(+)-松脂醇-4-O-β-D-吡喃葡萄糖苷。
| 序号 | 1H-NMR | 13C-NMR | |||
| 8 | 9 | 8 | 9 | ||
| 1 | - | - | 137.5 | 137.6 | |
| 2 | 7.02(1H,s) | 7.03(1H,d,1.5) | 111.7 | 111.6 | |
| 3 | - | - | 147.5 | 147.6 | |
| 4 | - | - | 151.0 | 151.0 | |
| 5 | 7.14(1H,d,8.5) | 7.14(1H,d,8.5) | 118.1 | 118.1 | |
| 6 | 6.91(1H,d,8.5) | 6.91(1H,dd,1.5,7.0) | 119.8 | 119.9 | |
| 7 | 4.75(2H,d,3.5) | 4.47(2H,d,6.5) | 87.1 | 89.1 | |
| 8 | 3.12(2H,s) | 2.92(2H,dd,6.5,9.0) | 55.4 | 55.8 | |
| 9 | 3.85(2H,m) | 3.86(2H,m) | 72.7 | 72.0 | |
| 1′ | - | - | 113.8 | 131.3 | |
| 2′ | 6.94(1H,s) | 6.96(1H,s) | 111.1 | 110.6 | |
| 3′ | - | - | 147.4 | 148.9 | |
| 4′ | - | - | 149.2 | 146.7 | |
| 5′ | 6.76(1H,d,8.0) | 6.77(1H,d,8.0) | 116.1 | 116.1 | |
| 6′ | 6.80(1H,d,8.5) | 6.80(1H,d,8.0) | 120.1 | 119.4 | |
| 7′ | 4.70(2H,d,4.0) | 4.87(2H,d,7.0) | 87.5 | 83.6 | |
| 8′ | 3.12(2H,s) | 3.39(2H,m) | 55.6 | 51.3 | |
| 9′ | 3.49(2H,m) | 3.41(2H,m) | 72.7 | 70.8 | |
| 1" | 4.87(1H,s) | 4.89(1H,s) | 102.9 | 102.9 | |
| 2" | 3.48(1H,m) | 3.48(1H,m) | 75.0 | 74.9 | |
| 3" | 3.47(1H,m) | 3.47(1H,m) | 77.9 | 77.9 | |
| 4" | 3.44(1H,m) | 3.44(1H,m) | 71.4 | 71.4 | |
| 5" | 3.44(1H,m) | 3.44(1H,m) | 78.2 | 78.2 | |
| 6" | 3.85(1H,m) | 3.85(1H,m) | 62.6 | 62.5 | |
| 4.23(1H,m) | 4.23(1H,m) | ||||
| -OCH3 | 3.85(3H,s) | 3.86(3H,s) | 56.5 | 56.4 | |
| -OCH3 | 3.86(3H,s) | 3.87(3H,s) | 56.8 | 56.8 | |
| Notes: Measured in CD3OD。 | |||||
化合物9:淡黄色油状物,TLC板上,紫外灯254 nm下有一暗斑,用体积分数为10%的硫酸乙醇溶液显色呈紫色。[α]D23:+22.73°(c0.22,MeOH)。高分辨Q-TOF-MS给出其准分子离子峰m/z 565.1926[M+COOH]-,确定其分子式为C26H32O11(Calcd. 565.192 7)。1H-NMR(500 MHz,CD3OD)谱中,在低场区δ 6.7~7.2范围内有6组氢信号:δ 6.77(1H,d,J=8.0 Hz,H-5′)、δ 6.80(1H,d,J=8.0 Hz,H-6′)、δ 6.91(1H,dd,J=1.5,7.0 Hz,H-6)、δ 6.96(1H,s,H-2′)、δ 7.03(1H,d,J=1.5 Hz,H-2)、δ 7.14(1H,d,J=8.5 Hz,H-5),提示结构中存在两个1,3,4取代的苯环。在中高场区有一个明显的d峰,根据峰面积及HSQC可知是两个单峰重叠,分别为δ 3.86(3H,s,-OCH3)、δ 3.87(3H,s,-OCH3),为两个甲氧基的氢信号。δ 3.86(2H,m,H-9)和δ 3.41(2H,m,H-9′)为两个亚甲基的氢信号;δ 3.39(2H,m,H-8′)、δ 2.92(2H,dd,J=6.5,9.0 Hz,H-8)和δ 4.47(2H,d,J=6.5 Hz,H-7)、δ 4.87(2H,d,J=7.0 Hz,H-7′)为两个次甲基的氢信号。糖区信号:δ 4.89(1H,s,H-1"),δ 3.48(1H,m,H-2"),δ 3.47(1H,m,H-3"),δ 3.44(1H,m,H-4"),δ 3.44(1H,m,H-5"),δ 3.85(1H,m,H-6"a),δ 4.23(1H,m,H-6"b)。13C-NMR(125 MHz,CD3OD)谱中显示有26个碳信号,其中一组信号δ[102.9、75.0、77.9、71.4、78.2、62.5]提示结构中存在1个葡萄糖取代基,由HMBC可知葡萄糖基与C-4′有相关,可知它们相连。在中高场区δ 56.4和56.8为两个甲氧基上的碳信号,结合HMBC可知两个甲氧基分别连在C-3及C-3′上。核磁数据(见表 2)与文献数据[15]对比,基本一致,确定该化合物为(+)-表松脂醇-4′-O-β-D-吡喃葡萄糖苷,与化合物8为同分异构体。
| [1] | 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015: 275-276 |
| [2] | 夏明辉, 赵晶, 韩立峰, 等. 荷叶化学及药理学研究进展[J]. 辽宁中医药大学学报, 2015, 17(11): 102–104. |
| [3] | 周健鹏. 荷叶化学成分和药理作用研究进展[J]. 天津药学, 2014, 26(2): 65–68. |
| [4] | 彭双, 韩立峰, 刘二伟, 等. 荷叶中化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2012, 29(7): 519–524. |
| [5] | 马迪, 彭双, 韩立峰, 等. 荷叶中化学成分的分离与鉴定(Ⅱ)[J]. 沈阳药科大学学报, 2014, 31(5): 355–359. |
| [6] | 夏明辉, 彭双, 赵晶, 等. 荷叶中化学成分的分离与鉴定(Ⅲ)[J]. 天津中医药大学学报, 2015, 34(2): 96–99. DOI:10.11656/j.issn.1673-9043.2015.02.08 |
| [7] | Han JT, Bang MH, Chun OK, et al. Flavonol glycosides from the aerial parts of Aceriphyllum rossii and their antioxidant activities[J]. Archives of pharmacal research, 2004, 27(4): 390–395. DOI:10.1007/BF02980079 |
| [8] | Iwaoka E, Oku H, Takahashi Y, et al. Allergy-preventive effects of Hibiscus mutabilis 'Versicolor' and a novel allergy-preventive flavonoid glycoside[J]. Biological & Pharmaceutical Bulletin, 2009, 32(3): 509–512. |
| [9] | Ma F, Onoda T, Li W, et al. A new flavonoid glycoside and other chemical constituents from leaves of Rosa davurica and their antioxidant activity[J]. Natural product research, 2013, 27(23): 2178–2182. DOI:10.1080/14786419.2013.811408 |
| [10] | 刘涛, 马龙, 赵军, 等. 琐琐葡萄化学成分研究[J]. 天然产物研究与开发, 2010, 22(6): 1009–1011. |
| [11] | Jung MJ, Chung HY, Choi JH, et al. Antioxidant principles from the needles of red pine, Pinus densi ora[J]. Phytotherapy Research, 2003, 17(9): 1064–1068. DOI:10.1002/(ISSN)1099-1573 |
| [12] | Miliauskas G, van Beek TA, Venskutonis PR, et al. Antioxidant activity of Potentilla fruticosa[J]. Journal of the Science of Food and Agriculture, 2004, 84(15): 1997–2009. DOI:10.1002/jsfa.v84:15 |
| [13] | Harput US, Çalişi, Saracoglu I, et al. Secondary metabolites from Phlomis syriaca and their antioxidant activities[J]. Turkish Journal of Chemistry, 2006, 30(3): 383–390. |
| [14] | Kim DK, Lim JP, Kim JW, et al. Antitumor and antiinflammatory constituents from Celtis sinensis[J]. Archives of pharmacal research, 2005, 28(1): 39–43. DOI:10.1007/BF02975133 |
| [15] | Rahman MMA, Dewick PM, Jackson DE, et al. Lignans of Forsythia intermedia[J]. Phytochemistry, 1990, 29(6): 1971–1980. DOI:10.1016/0031-9422(90)85050-P |
 2017, Vol. 36
2017, Vol. 36




