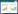文章信息
- 李瑞, 李亚平, 马融, 李巍, 钟成梁, 魏小维
- LI Rui, LI Ya-ping, MA Rong, LI Wei, ZHONG Cheng-liang, WEI Xiao-wei
- 益智宁神颗粒对SHR大鼠前额叶-纹状体多巴胺含量、GDNF mRNA及其蛋白表达的影响
- Yizhi Ningshen granules:Effects on Dopamine levels, GDNFmRNA and its protein expression in prefrontal cortex-striatum of SHR
- 天津中医药大学学报, 2017, 36(6): 449-454
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(6): 449-454
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.06.13
-
文章历史
收稿日期: 2017-07-20
2. 天津中医药大学第一附属医院, 天津 300193
2. The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
注意缺陷多动障碍(ADHD)是以与年龄不相称的注意力分散,注意广度缩小,不分场合的过度活动和情绪冲动,并伴有认知障碍和学习困难,进而影响其社会功能为临床表现的一种行为障碍[1]。ADHD常见于儿童期,全球学龄期儿童及青少年患病率约为5.29%[2]。其病因及发病机制复杂,脑内多巴胺(DA)功能缺陷学说最受支持。研究发现胶质细胞源性神经营养因子(GDNF)广泛存在于中枢系统的DA区域[3],是一种确切有效的DA能神经营养因子[4]。中医药对ADHD研究近30年,以期有效和安全地治疗患儿,并结合现代分子生物技术来阐述中医药的作用机制及寻找中药活性成分,其理论、临床及实验研究逐渐得到发展[5-7]。
天津中医药大学第一附属医院儿科脑病课题组采用益肾填精法通过益智宁神(YZNS)颗粒于临床治疗ADHD 10余年,临床研究结果显示YZNS颗粒可改善ADHD患儿临床症状,并对其脑电图慢波及认知结构不平衡性具有优化和调节作用[8-10];前期动物实验研究提示YZNS颗粒具有改善ADHD模型大鼠认知功能和调节其脑组织中单胺类神经递质的作用[11-12]。故推测,YZNS颗粒获效的机制可能是通过对DA能神经网络成熟度进行整体调控,从而促进ADHD儿童大脑发育改善其大脑功能。本实验以目前公认的ADHD动物模型——幼龄自发性高血压(SHR)大鼠[13]为动物模型,以YZNS颗粒为药物载体,观察中医“益肾填精法”对SHR大鼠纹状体、前额叶DA含量和GDNF mRNA及其蛋白表达的影响。
1 材料与方法 1.1 实验动物及药物32只SHR大鼠,8只京都(WKY)大鼠,均为雄性,3周龄,体质量90~110 g,清洁级,北京维通利华实验动物技术有限公司提供,恒温恒湿条件饲养于天津实验动物中心,自由饮食进水。YZNS颗粒,由紫河车、熟地黄、远志、泽泻、石菖蒲、黄连组成(四川新绿色药业科技发展股份有限公司提供,批号1507029),本方以生理盐水配成(每次灌胃时当场配制),生药含量为3.75 g/mL。盐酸哌甲酯缓释片(美国Janssen Cilag Manufacturing LLC公司生产,批号4IE416)。盐酸托莫西汀胶囊(美国LILLY公司生产,批号C315229)。
1.2 主要仪器及试剂LC-6000型高效液相色谱仪(美国科美特公司),涡旋振荡仪(海门市其林贝尔仪器制造有限公司),离心机(德国Eppendorf公司),荧光定量聚合酶链反应(PCR)仪(美国Applied Biosystems公司),分光光度计(美国Therno Scientific公司),电子天平(型号BSA124S-CW,德国Sartorius公司),去离子水仪(美国PALL, Purelab Plus公司),移液枪(法国Eppendorf公司),低温冰箱(青岛海尔公司),电泳仪、垂直电泳槽(型号DYCZ-20C)、转移槽(型号DYCP-40C,北京六一仪器厂),制冰机(型号AF10,美国SCOTSMAN)、PVDF膜(美国Millipore公司),医用X线胶片(美国柯达公司);乙腈,超纯RNA提取试剂,反转录试剂盒,实时-聚合酶链反应(RT PCR)试剂盒,5x RNA加权缓冲液(日本TaKaRa公司),GDNF(Ab18956,英国Abcam公司),β-actin(TA-09,北京中杉金桥生物技术有限公司)等。
1.3 分组及治疗方案32只SHR大鼠称质量后采用随机数字法将其随机分为4组:模型对照组、YZNS组、盐酸哌甲酯组(OROS-MPH组)、盐酸托莫西汀组(ATM组);WKY大鼠作为SHR大鼠的正常对照。治疗方案:1)正常对照组(WKY组):0.5%生理盐水,20 mg/kg(体质量),每日1次;2)模型对照组(MOC组):0.5%生理盐水,20 mg/kg(体质量),每日1次;3)YZNS组:YZNS颗粒,以0.5%生理盐水配制成生药含量3.75 g/mL的溶液灌胃,37.5 gkg(体质量),每日1次;4)OROS-MPH组:按5 mg/kg剂量灌胃,每日1次;5)ATM组:按0.3 mg/kg剂量灌胃,每日1次。以上治疗持续28 d。
1.4 样品标本采集各组大鼠于治疗28 d后断头处死,在冰台上迅速分离其大脑的前额叶皮质和纹状体,速冻后转移至-80 ℃冰箱保存备用。
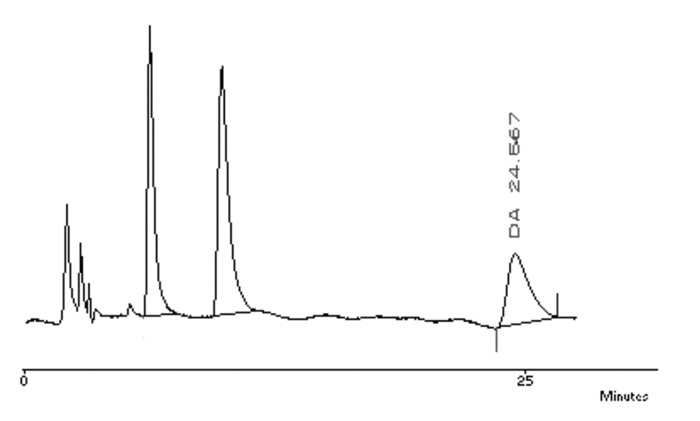
1.5 高效液相色谱法检测DA含量取前额叶皮质、纹状体组织,称质量,置-80 ℃储存。检测时加入0.1 mol/L高氯酸200 μL,将之匀浆,4 ℃低温离心,12 000 r/min,15 min后,取其上清液30 μL,用于高效液相色谱电化学检测DA含量。再根据结果绘制标准曲线图,对照品、组织样品、流动相色谱图依次见图 1、2、3。
|
| 图 1 神经递质对照品色谱图 |
|
| 图 2 组织样品中神经递质色谱图 |

|
| 图 3 流动相色谱图 |
向每0.1 g样品中加入2 mL RNA Aiso Plus,并完全覆盖样品,室温静置5 min后,参照超纯RNA提取试剂(TaKaRa Code D9108B)说明书提取RNA,使用Nanodrop 2000超微量分光光度计测定RNA的浓度、纯度(A260 nm/A280 nm在1.9~2.1范围间)。
1.6.2 RNA电泳、消化取5 μL RNA用1%琼脂糖凝胶进行电泳,以检测RNA的完整性;将反转录试剂盒中的gDNA Eraser(TaKaRa code DRRO47A)、5×g DNA Eraser buffer、RNase-Free water、Total RNA等组分充分混匀,短暂离心,使管壁上的溶液收集到管底,42 ℃ 2 min,4 ℃保存。
1.6.3 反转录将RNA模板、引物、5×RT Buffer和RNase-freeWater溶解并置于冰上备用。37 ℃孵育15 min(反转录反应),85 ℃ 5 s(反转录酶失活),4 ℃保存。
1.6.4 RT PCR反应按SYBR Premix Ex Taq(TaKaRa code DRR420A)说明书进行扩增,扩增程序为:95 ℃30 s(95 ℃ 5 s,60 ℃ 34 s)×40个循环后,将各样品cDNA 10倍稀释后取2 μL作模板,分别用目的基因引物和内参基因引物进行扩增,同时在60~95 ℃进行溶解曲线分析。在PCR反应程序结束后,使用仪器自带软件进行定量分析。引物序列见表 1。
| 引物名称 | 引物序列(5'to3') | 产物大小(bp) |
| GDNF-F | CAAGGTAGGCCAGGCATGTT | 113 |
| GDNF-R | ATCCACACCGTTTAGCGGAA | |
| βactin-F | ACTCTGTGTGGATTGGTGGC | 155 |
| βactin-R | AGAAAGGGTGTAAAACGCAGC |
提取细胞总蛋白并测定蛋白浓度后,将样品蛋白进行SDS(十二烷基硫酸钠)—PAGE(聚丙烯酰胺)胶电泳、转膜,封闭液稀释一抗(内参抗体稀释度为1:1 000)、辣根过氧化物酶(HRP)标记的二抗杂交(1:3 000)等步骤,化学发光显色,凝胶图像分析系统测定光密度值。用image J软件分析灰度值。
1.8 统计学方法及分析用SPSS 18.0统计学分析软件进行数据处理,测定结果以均数±标准差(x±s)表示,多组间均数比较时,方差齐则采用单因素方差分析,两两比较选用LSD法;方差不齐,采用Kruskal-Wallis秩和检验,两两比较采用LSD法,多组间均数若两两比较采用Nemenyi检验。P < 0.05认为差异有统计学意义。
2 结果 2.1 大鼠生存情况MOC组:治疗4周后取材当天,大鼠意外死亡1只,其余大鼠无死亡情况。
2.2 大鼠前额叶DA含量的变化MOC组、OROS-MPH组与WKY组存在差异,其余组无统计学意义(P > 0.05);YZNS组、ATM组DA含量明显多于OROS-MPH组,见表 2。
| ng/mL | |||
| 组别 | n | DA(前额叶) | DA(纹状体) |
| WKY组 | 8 | 249.14±30.658#△ | 144.36±19.544△ |
| MOC组 | 7 | 134.11±32.982*▲ | 94.93±15.158 |
| YZNS组 | 8 | 200.25±16.502△ | 67.98± 9.624*▲ |
| OROS-MPH组 | 8 | 89.64±13.206*▲ | 90.96±10.679*▲ |
| ATM组 | 8 | 232.47±38.667#△ | 144.85±26.664△ |
| 注:与WKY组相比较,*P < 0.05;与MOC组相比较,#P < 0.05;与OROS-MPH组相比较,△P < 0.05;与ATM组相比较,▲P < 0.05。 | |||
MOC组、ATM组大鼠纹状体DA含量与WKY组无统计学差异(P > 0.05),而YZNS组、OROS-MPH组均低于WKY组,且有统计学意义(P < 0.05),但此两组间未表现出统计学差异。见表 2。
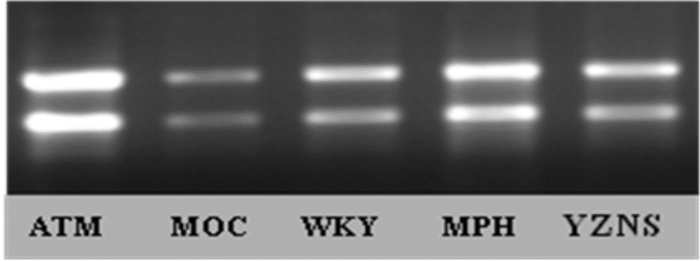
2.4 大鼠前额叶GDNF mRNA表达量MOC组与WKY组无统计学差异(P > 0.05),SHR药物治疗各组有较明显高于WKY组的趋势,各组间亦存在统计学差异(P < 0.05),表达量从高到低依次为ATM组 > OROS-MPH组 > YZNS组,均有统计学意义,见表 3,电泳图见图 4。
| % | |||
| 组别 | n | GDNF mRNA相对灰度(前额叶) | GDNF mRNA表达量相对灰度(纹状体) |
| WKY组 | 8 | 1.044 9±0.046 35△▲ | 1.024 7±0.035 06△▲ |
| MOC组 | 7 | 1.033 9±0.028 60△▲ | 1.054 4±0.036 72△▲ |
| YZNS组 | 8 | 1.717 0±0.142 10*#△▲ | 1.703 1±0.176 25*#△▲ |
| OROS-MPH组 | 8 | 1.858 8±0.020 34*# | 1.831 7±0.074 72*#▲ |
| ATM组 | 8 | 2.069 9±0.135 54*#△▲ | 1.960 9±0.102 90*#△ |
| 注:与WKY组相比较,*P < 0.05;与MOC组相比较,#P < 0.05;与OROS-MPH组相比较,△P < 0.05;与ATM组相比较,▲P < 0.05。 | |||
|
| 图 4 各组前额叶GDNF mRNA电泳图 |
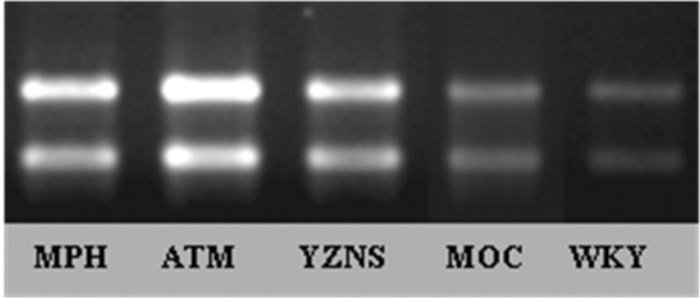
SHR各组大鼠均有高于WKY组的趋势,其余组均有统计学意义(P < 0.05);其中,SHR药物治疗各组间均存在统计学差异(P < 0.05),表达量从高到低依次为ATM组 > OROS-MPH组 > YZNS组,见表 3,电泳图见图 5。
|
| 图 5 各组纹状体GDNF mRNA电泳图 |
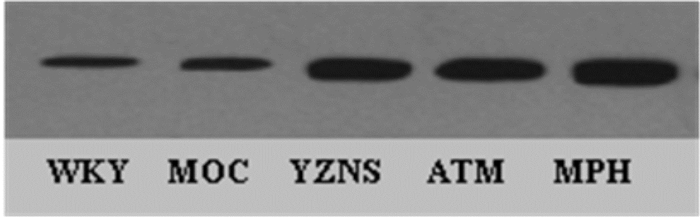
SHR各组均有高于WKY组的趋势,且有统计学意义(P < 0.05),但各组间未表现出统计学差异(P > 0.05),见表 4,蛋白定量灰度图,见图 6。
| ×102 | |||
| 组别 | n | GDNF蛋白阳性面积 (前额叶) |
GDNF蛋白阳性面积 (纹状体) |
| WKY组 | 8 | 0.634 6±0.237 4*△▲ | 0.534 71±0.094 0*△▲ |
| MOC组 | 7 | 1.196 1±0.338 4* | 0.994 86±0.271 0*△ |
| YZNS组 | 8 | 1.080 1±0.201 3* | 1.012 86±0.204 9*△ |
| OROS-MPH组 | 8 | 1.301 1±0.068 6* | 1.351 00±0.312 3*#▲ |
| ATM组 | 8 | 1.162 3±0.136 5* | 0.988 00±0.167 5*△ |
| 注:与WKY组相比较,*P < 0.05;与MOC组相比较,#P < 0.05;与OROS-MPH组相比较,△P < 0.05;与ATM组相比较,▲P < 0.05。 | |||
|
| 图 6 各组前额叶GDNF蛋白定量灰度图 |
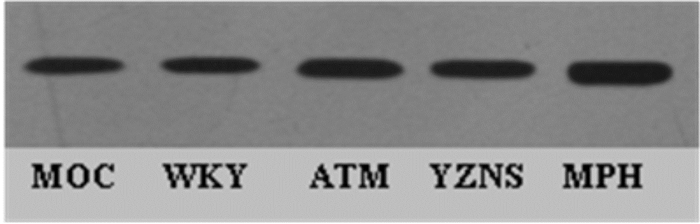
SHR大鼠纹状体GDNF蛋白表达均有高于WKY组的趋势,存在统计学差异(P < 0.05);OROS-MPH组高于其余各组SHR大鼠纹状体GDNF蛋白表达(P < 0.05);其余各组间未表现出统计学差异(P > 0.05),见表 4,蛋白定量灰度图,见图 7。
|
| 图 7 各组纹状体GDNF蛋白定量灰度图 |
大量研究揭示中枢神经系统中DA的功能缺陷与其发病密切相关[14-19]。相关神经药理学研究发现,盐酸哌甲酯可提高突触间隙DA的含量[20],也认为ADHD患儿存在DA不足或缺陷[21-22]。托莫西汀可通过增加前额叶突触间隙去甲肾上腺素和DA的浓度来发挥治疗ADHD的作用[23]。
当DA投射到前额叶皮质和纹状体时,前体细胞上的DA受体可发挥调节神经元增殖、分化的作用,引起突触改变。异常的DA信号具有干扰前额叶皮质和纹状体的作用,ADHD脑内长期的DA异常调节,可导致前额叶皮质—纹状体环路功能紊乱[14, 19]。
GDNF是一种有效的DA能神经营养因子,与神经发育和生长有关。大量离体、在体实验发现,GDNF对DA能神经元不仅具有特异的营养、支持、保护和修复作用,而且在神经前体细胞分化为DA神经元过程中起到重要的促进作用[25-27]。
动物实验研究结果已表明脑内GDNF在认知能力中起着重要作用[28]。脑在发育过程中能够作出相应代偿性改变,来改善某一方面的功能缺陷[29]。
本实验结果中SHR大鼠前额叶皮质、纹状体DA的含量均有低于WKY大鼠的趋势,表明幼龄SHR大鼠脑内DA含量不足是其DA网络不成熟的主要指标之一;而SHR上述2个部位中GDNF蛋白表达均高于WKY,提示机体可能因DA功能缺陷而对促进其特异性营养因子GDNF产生代偿性变化;笔者推测SHR大鼠的病理改变尚未影响到GDNF mRNA,但药物干预或可上调mRNA表达,促进GDNF蛋白表达进一步代偿表达,最终达到保护DA能神经元、改善认知能力的作用。故本实验中各药物干预组SHR 2个部位GDNF mRNA表达均高于模型对照组SHR,而模型对照组SHR与WKY无统计学差异。
3.2 药物疗效机制本实验以中药复方YZNS颗粒为干预手段,以临床治疗ADHD常用药物中枢兴奋剂盐酸哌甲酯、新版指南提升为一线药物治疗的非神经兴奋剂盐酸托莫西汀为对照[1],探索中医药对ADHD特定脑区DA能神经网络成熟度的影响机制。研究数据提示,盐酸哌甲酯作用的优势部位倾向于纹状体,盐酸托莫西汀作用的优势部位倾向于前额叶皮质,YZNS颗粒作为中药复方,在上述两个部位均有作用,其中提高DA含量方面,在前额叶皮质中的作用更具优势,疗效与盐酸托莫西汀相当;在促进GDNF蛋白表达方面的疗效亦与盐酸托莫西汀相当。
3.3 模型选择SHR大鼠是1963年京都大学医学部病理系K.Okamoto将WKY经过几代交叉繁殖培育出的一个新种系。与原种系WKY相比,SHR大鼠除了在10周龄后可发生自发性高血压之外,幼龄期尚具有活动过度、行为冲动、注意力不集中等与ADHD相似的行为,且无需人工诱导,因此在国内外ADHD相关研究中已得到广泛应用[7, 13-15, 21, 30]。WKY因为其具有相同品系的特征,在行为上更类似于其他种类,为SHR的正常对照组动物[31]。
4 小结YZNS颗粒为中药复方,其对DA特定脑区功能有改善作用的具体活性成分尚不明确,需与血清、脑脊液药理学等结合进行筛选。ADHD的发病机制除涉及DA外,还与其他单胺类神经递质,如去甲肾上腺素、5-羟色胺等有关。与此同时,大脑神经环路中不同部位在其发病中所起作用也有所不同,研究表明,ADHD患儿下丘脑-垂体-肾上腺(HPA)轴对应激呈低反应性, 而HPA轴的低反应性与ADHD的3大核心症状密切相关[32-33],其常伴随的情绪和认知缺陷与海马功能异常有关[34],而海马又发挥着负反馈调节HPA轴的中枢作用。因此,YZNS颗粒对其他神经递质、其他脑区通路的干预机制有待进一步深入研究。
| [1] |
郑毅, 刘靖. 中国注意缺陷多动障碍防治指南[M]. 第2版. 北京: 中华医学电子音像出版社, 2015, 1-11, 96-97.
|
| [2] |
Polanczyk G, de Lima MS, Horta BL, et al. The worldwide prevalence of ADHD:a systematic review and metaregression analysis[J]. Am J Psychiatry, 2007, 164(6): 942-948. DOI:10.1176/ajp.2007.164.6.942 |
| [3] |
Reis RA, Cabral MC, Loureiro NE, et al. Sympathetic neuronal survival induced by retinal trophic factors[J]. J Neurobiol, 2002, 50(1): 13-23. DOI:10.1002/(ISSN)1097-4695 |
| [4] |
Lin LF, Doherty DH, Lile JD, et al. GDNF:a glial cell line-derived neurotrophic factor for midbrain dopaminergic neurons[J]. Science, 1993, 260(5111): 1130-1132. DOI:10.1126/science.8493557 |
| [5] |
倪新强, 韩新民. 中医药对注意力缺陷多动障碍的研究进展[J]. 中国中西医结合杂志, 2013, 33(3): 428-431. |
| [6] |
倪新强, 张艳莉, 韩新民. 中医药对注意力缺陷多动障碍的动物实验规范化探讨[J]. 中国中药杂志, 2013, 38(7): 1103-1107. |
| [7] |
雷爽, 韩新民. 注意力缺陷多动障碍中医药动物实验研究进展[J]. 中华中医药杂志, 2014(6): 1937-1939. |
| [8] |
李亚平, 马融, 魏小维, 等. 益智宁神颗粒治疗儿童多动症"肾阴不足肝阳偏旺"证的临床分析[J]. 天津中医药, 2004, 21(5): 374-376. |
| [9] |
马融, 张喜莲. 髓海发育迟缓致儿童注意缺陷多动障碍病机假说探讨[J]. 中华中医药杂志, 2008, 23(8): 737-739. |
| [10] |
李亚平, 马融, 魏小维. 儿童多动症临床辨证及证候分布规律的研究进展[J]. 天津中医药, 2011, 28(5): 433-434. |
| [11] |
古今楠, 马融. 益智宁神颗粒对于注意缺陷多动障碍动物模型认知功能的影响[J]. 中华中医药杂志, 2008, 23(10): 910-912. |
| [12] |
马融, 古今楠, 李新民, 等. 益智宁神颗粒对自发性高血压模型大鼠脑组织去甲肾上腺素、多巴胺的影响[J]. 天津中医药, 2008, 25(1): 6-9. DOI:10.11656/j.issn.1673-9043.2008.01.02 |
| [13] |
Sagvolden T, Metzger MA, Schiørbeck HK, et al. The spontaneously hypertensive rat (SHR) as an animal model of childhood hyperactivity (ADHD):changed reactivity to reinforcers and to psychomotor stimulants[J]. Behavioral & Neural Biology, 1992, 58(2): 103-112. |
| [14] |
Sagvolden T. Behavioral validation of the spontaneously hypertensive rat (SHR) as an animal model of attention-deficit/hyperactivity disorder (AD/HD)[J]. Neuroscience & Biobehavioral Reviews, 2000, 24(1): 31-39. |
| [15] |
Gizer IR, Ficks C, Waldman ID. Candidate gene studies of ADHD:a meta-analytic review[J]. Hum Genet, 2009, 126(1): 51-90. DOI:10.1007/s00439-009-0694-x |
| [16] |
Williams GV, Castner SA. Under the curve:critical issues for elucidating D1 receptor function in working memory[J]. Neuroscience, 2006, 139(1): 263-276. DOI:10.1016/j.neuroscience.2005.09.028 |
| [17] |
Alex KD, Pehek EA. Pharmacologic mechanisms of serotonergic regulation of dopamine neurotransmission[J]. Pharmacol Ther, 2007, 113(2): 296-320. DOI:10.1016/j.pharmthera.2006.08.004 |
| [18] |
Williams GV, Castner SA. Under the curve:critical issues for elucidating D1 receptor function in working memory[J]. Neuroscience, 2006, 139(1): 263-276. DOI:10.1016/j.neuroscience.2005.09.028 |
| [19] |
Alex KD, Pehek EA. Pharmacologic mechanisms of serotonergic regulation of dopamine neurotransmission[J]. Pharmacol Ther, 2007, 113(2): 296-320. DOI:10.1016/j.pharmthera.2006.08.004 |
| [20] |
Mattes JA. The role of frontal lobe dysfunction in childhoodhyperkinesis[J]. Compr Psychiatry, 1980, 21(5): 358-369. DOI:10.1016/0010-440X(80)90017-6 |
| [21] |
马融, 魏小维, 李亚平, 等. 益肾填精法治疗儿童多动症及其神经生化机制研究[J]. 天津中医药, 2007, 24(4): 309. |
| [22] |
Volkow N. Depressed dopamine activity in caudate and preliminary evidence of limbic involvement in adults with attention deficit hyperactivity disorder[J]. Arch Gen Psychiatry, 2007, 64(64): 932-940. |
| [23] |
斯塔尔. 精神药理学精要[M]. 北京: 北京大学医学出版社, 2009, 471.
|
| [24] |
Perrier AL, Tabar V, Barberi T, et al. Derivation of midbrain dopamine neurons from human embryonic stem cells[J]. Proc Natl Acad Sci USA, 2004, 101(34): 12543-12548. DOI:10.1073/pnas.0404700101 |
| [25] |
Wilens TE. Effects of methylphenidate on the catecholaminergic system in attention-deficit/hyperactivity disorder[J]. J Clin Psychopharmacol, 2008, 28(2): 46-53. |
| [26] |
郭雨霁, 李盛芳. 神经营养因子家族及其受体的研究进展[J]. 神经解剖学杂志, 2001, 17(3): 288-294. |
| [27] |
Schuchardt A, D'Agati V, Larssonblomberg L, et al. Defects in the kidney and enteric nervous system of mice lacking the tyrosine kinase receptor Ret[J]. Nature, 1994, 367(6461): 380-383. DOI:10.1038/367380a0 |
| [28] |
Gerlai R, Mcnamara A, Choi-Lundberg DL, et al. Impaired water maze learningperfor-mance without altered dopaminergic function in mice heterozygous for the GDNF mutation[J]. Eur J Neurosci, 2001, 14(7): 1153-1163. DOI:10.1046/j.0953-816x.2001.01724.x |
| [29] |
吴剑锋, 白洁. 多巴胺系统在纹状体和前额叶皮质中的作用[J]. 中国老年学杂志, 2015, 34(20): 5950-5952. DOI:10.3969/j.issn.1005-9202.2015.20.136 |
| [30] |
徐通, 周翊, 王强虹, 等. SHR大鼠冲动性变化的初步观察[J]. 中国心理卫生杂志, 2003, 17(5): 313-315. |
| [31] |
池霞. 注意缺陷多动障碍动物模型-SHR大鼠前额叶皮层基因表达谱特征的研究[D]. 南京: 南京医科大学, 2005. http://d.wanfangdata.com.cn/Thesis/Y736565
|
| [32] |
Blomqvist M, Holmberg K, Lindblad F, et al. Salivary cortisol levels and dental anxiety in children with attention deficit hyperactivity disorder[J]. European Journal of Oral Sciences, 2007, 115(1): 1-6. DOI:10.1111/eos.2007.115.issue-1 |
| [33] |
West DV, Claes S, Deboutte D. Differences in hypothalamic-pituitary-adrenal axis functioning among children with ADHD predominantly inattentive and combined types[J]. European Child & Adolescent Psychiatry, 2009, 18(9): 543-553. |
| [34] |
Davidson RJ, Putnam KM, Larson CL. Dysfunction in the neural circuitry of emotion regulation-a possible prelude to violence[J]. Science, 2000, 289(5479): 591-594. DOI:10.1126/science.289.5479.591 |
 2017, Vol. 36
2017, Vol. 36