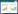文章信息
- 邢蕾蕾, 胡晓慧, 杨瑾, 艾乐, 王怡, 王炎炎
- XING Lei-lei, HU Xiao-hui, YANG Jin, AI Le, WANG Yi, WANG Yan-yan
- 甘草对H2O2诱导大鼠H9c2心肌细胞损伤保护作用的研究
- Study on the effects of licorice on H2O2-induced H9c2 myocardial injury
- 天津中医药大学学报, 2017, 36(6): 455-460
- Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(6): 455-460
- http://dx.doi.org/10.11656/j.issn.1673-9043.2017.06.14
-
文章历史
收稿日期: 2017-07-01
2. 天津中新药业集团股份有限公司乐仁堂制药厂, 天津 300112
2. Lerentang Pharmaceutical Factory, Tianjin Zhongxin Pharmaceutical Group Co., Ltd., Tianjin 300112, China
缺血性心脏病(IHD)是由冠状动脉狭窄引起心肌缺血与缺氧的一种病症,中医称之为“胸痹”[1-2]。近十年的研究发现,氧化应激在IHD中扮演着重要的角色[3-5]。心肌缺血再灌注过程会使细胞产生大量的氧自由基,能够降低细胞抗氧化能力,导致细胞膜脂质过氧化和钙超载,激活细胞凋亡途径[6]。因此,减轻氧化应激损伤对于IHD的治疗起重要作用[7]。
甘草为豆科植物甘草的干燥根及根茎,具有补中益气、清热解毒、祛痰止咳、缓急止痛、调和药性之功[8]。甘草是一种使用广泛且历史悠久的中草药,也是方剂中常见的配伍用药,《本草纲目》称其为百药之首,早在《神农本草经》中记载了其具有补益心气之功,《伤寒论》中提出炙甘草汤重用甘草以益气通利血脉用于气血不足所致的心力不继[7, 9]。现代研究发现,甘草中含具有抗氧化作用的化合物,如黄酮类[10-12]。本论文建立过氧化氢(H2O2)诱导的氧化应激模型,探讨甘草对H2O2诱导大鼠H9c2心肌细胞损伤的保护作用,为中医临床治疗缺血性心脏病配伍用药提供参考。
1 材料与仪器 1.1 细胞株大鼠心肌细胞(H9c2),购买于American Type Culture Collection(ATCC, Manassas, VA)。
1.2 药物与试剂甘草浸膏由天津中新药业集团股份有限公司乐仁堂制药厂提供。DMEM/F12培养基(美国HyClone公司,批号AAJ207793),胎牛血清(美国Gibco公司,批号1619646),0.25%胰蛋白酶(美国HyClone公司,批号3473-25g),3%H2O2(美国Sigma公司,批号STBF6045V),噻唑蓝(MTT,美国Sigma公司,批号M2128),乳酸脱氢酶(LDH)检测试剂盒(美国Promega公司,批号0000193323),超氧化物歧化酶(SOD)活力检测试剂盒(南京建成生物工程研究所,批号A001-1),丙二醛(MDA)检测试剂盒(南京建成生物工程研究所,批号A003-1),CM-H2DCFDA探针(美国Invitrogen公司,批号1648514),FluO4-AM探针(日本同仁化学研究所,批号GW774),Calcein-AM探针(美国Santa Cruz公司,批号sc-203865),凋亡检测试剂盒(美国BD公司,批号18656)。
1.3 仪器CO2恒温培养箱(美国Thermo Scientific公司,型号FORMA3111),倒置相差显微镜(日本OLYMPUS公司,型号CKX41),多功能酶标仪(美国Perkin Elmer公司,型号Enpire),荧光倒置显微镜(日本Nikon公司,型号ECLIPSE Ti),离心机(美国Thermo Scientific公司,型号Legend Micro 17),流式细胞仪(美国BD公司,型号Accuri C6),摇床(美国Thermo Scientific公司,型号Orbital Shaker)。
2 实验方法 2.1 细胞培养将大鼠H9c2心肌细胞培养于含有10%胎牛血清和1%双抗的DMEM/F12培养液中,置于37 ℃、5%CO2培养箱内培养。
2.2 H2O2氧化应激损伤模型建立与分组将H9c2细胞浓度调整为每毫升5×104个,每孔100 μL细胞悬液接种到96孔细胞培养板,用含10%胎牛血清的DMEM/F12培养基培养36 h,换用无胎牛血清的DMEM/F12培养基培养12 h后,根据参考文献[13-17],选用50、100、200、400 μmol/L的H2O2诱导心肌细胞损伤2、4 h两个时间点,检测细胞活力来筛选合适的H2O2氧化应激损伤模型的作用浓度及时间。实验分为4组,分别为空白对照组、H2O2模型组(100 μmol/L,4 h)、甘草高、低剂量组(800、400 μg/mL,4 h)。
2.3 MTT法检测细胞活力将H9c2心肌细胞以3×104/mL密度种于96孔板中,给药并进行H2O2损伤处理。除去培养液,96孔细胞培养板内每孔加入100 μL MTT溶液(终浓度0.5 mg/mL),于37 ℃孵育4 h,可见孔内形成有蓝紫色结晶。小心弃去孔内MTT溶液,每孔加入150 μL二甲基亚砜(DMSO),37 ℃震荡10 min,使结晶物充分溶解后。用酶标仪测定570 nm波长处的A值,结果以百分细胞存活率表示。
2.4 细胞培养上清中LDH释放的检测将大鼠H9c2心肌细胞以3×104/mL密度种于96孔板中,给药并进行H2O2损伤处理。H2O2损伤结束后,收集细胞上清液,根据美国Promega公司提供的LDH含量检测试剂盒说明书进行检测。设定激发波长为560 nm,发射波长为590 nm。
2.5 抗氧化物检测收集待测孔板内的细胞上清液,离心(1 000 r/min,10 min)收集上清液,根据南京建成生物工程研究所提供的SOD活力及MDA含量检测试剂盒说明书分别进行实验。
2.6 心肌细胞内ROS的检测用DMSO将CMH2DCFH-DA粉末溶解成5 mmol/L的母液,-20 ℃保存。实验测定前用DMEM/F12基础培基稀释为5 μmol/L的CMH2DCFH-DA工作液。将H9c2细胞以5×104/mL浓度接种于黑色透底96孔细胞培养板,给药并进行H2O2损伤实验。H2O2损伤结束后,每孔加入100 μL CMH2DCFH-DA工作液,37 ℃ CO2培养箱孵育30 min。30 min后,弃去工作液,用磷酸盐缓冲液(PBS)清洗2次,每次5 min。每孔加入100 μL Hank’s缓冲液,37 ℃,CO2培养箱继续孵育20 min后,上机检测。设定激发波长488 nm,发射波长525 nm。
2.7 Fluo-4am检测细胞内Ca2+浓度用DMSO将Fluo-4am固体粉末溶解成4 mmol/L的母液,-20 ℃保存。实验测定前用DMEM/F12基础培基稀释为4 μmol/L的Fluo-4am工作液。将H9c2细胞以5×104/mL浓度接种于黑色透底96孔细胞培养板,给药并进行H2O2损伤实验。H2O2损伤结束后,每孔加入100 μL Fluo-4am工作液,37 ℃,CO2培养箱孵育30 min。30 min后,弃去工作液,用HBSS清洗2次,每次5 min。将培养板放入荧光酶标仪中测定激发波长为494 nm,发射波长为516 nm的荧光强度。
2.8 钙黄绿素猝灭法检测线粒体通透性转换孔(mPTP)开放水平用DMSO将Calcein-AM溶解,配制成2 mmol/L的母液备用。将H9c2细胞以5×104/mL浓度接种于黑色透底96孔细胞培养板,给药并进行H2O2损伤实验。H2O2损伤结束后,用D-hank’s溶液浸洗1次。用Hank’s溶液稀释成终浓度为2 μmol/L的Calcein-AM以及1 mmol/L的CoCl2工作液,每孔加入100 μL,避光孵育40 min。弃探针溶液,用D-hank’s溶液浸洗两遍后,加入Hank’s溶液,置于酶标仪中,于激发波长为488 nm,发射波长为515 nm处,进行检测。
2.9 细胞凋亡将大鼠H9c2心肌细胞以3×105/mL密度种于12孔板中,给药并进行H2O2损伤处理。H2O2损伤结束后,弃去各孔培养液,用PBS缓冲液清洗后加入胰酶消化,含血清的培基终止消化并轻柔吹打促进细胞消化脱壁。将所得消化液与复氧培养液合并于离心管中,1 000 r/min离心10 min收集细胞沉淀。每管加入Binding Buffer 500 μL重悬细胞,吹匀。最后加入Annexin V-FITC和PI溶液各5 μL,混匀,室温避光染色15 min。用流式细胞仪检测细胞凋亡。
2.10 统计方法采用SPSS 18.0软件包进行统计学处理,数据用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD法,方差不齐用Dunnett’s T3法。P < 0.05有统计学意义。
3 实验结果 3.1 H2O2损伤模型的建立根据H2O2损伤后对H9c2细胞活力的影响,选择H2O2浓度为100 μmol/L作用于H9c2细胞4 h为合适的造模条件,见表 1。
| 组别 | 剂量(μmol/L) | n | MTT(%Control) |
| 空白组 | - | 10 | 100.00±9.36 |
| 2 h | 50 | 10 | 93.24±4.80 |
| 2 h | 100 | 10 | 89.80±8.03* |
| 2 h | 200 | 10 | 49.61±7.17** |
| 2 h | 400 | 10 | 39.72±4.13** |
| 4 h | 50 | 10 | 89.08±8.87* |
| 4 h | 100 | 10 | 71.08±8.59** |
| 4 h | 200 | 10 | 43.54±5.57** |
| 4 h | 400 | 10 | 26.69±2.19** |
| 注:与空白组比较,*P < 0.05,**P < 0.01。 | |||
在正常条件下与对照组比较,甘草在200~1 000 μg/mL剂量范围内对正常心肌细胞的活力无影响(P > 0.05)。H2O2损伤后,与对照组比较,模型组细胞活力显著降低,LDH释放量显著升高(P < 0.01);与模型组比较,甘草600~1 000 μg/mL组能显著提高造模后细胞活力、降低LDH的释放(P < 0.05或P < 0.01)。通过上述结果,选择甘草400、800 μg/mL为低、高剂量进行后续实验研究。见表 2、表 3。
| 组别 | 剂量(μg/mL) | n | MTT(%Control) |
| 空白组 | - | 10 | 100.00±3.45 |
| 甘草 | 200 | 10 | 100.68±7.01 |
| 甘草 | 400 | 10 | 99.95±8.28 |
| 甘草 | 600 | 10 | 101.60±6.32 |
| 甘草 | 800 | 10 | 102.15±6.93 |
| 甘草 | 1000 | 10 | 101.81±7.28 |
| 组别 | 剂量(μg/mL) | n | MTT(%Control) | LDH(%Control) |
| 空白组 | - | 10 | 100.00±13.04 | 100.00±14.82 |
| 模型组 | - | 10 | 70.39±3.09** | 215.34±35.56** |
| 甘草 | 200 | 10 | 70.62±6.78 | 198.86±37.20 |
| 甘草 | 400 | 10 | 75.66±11.32 | 179.55±39.89 |
| 甘草 | 600 | 10 | 81.46±8.84# | 155.68±38.50# |
| 甘草 | 800 | 10 | 83.65±4.01## | 137.50±21.41## |
| 甘草 | 1 000 | 10 | 86.26±7.45## | 128.41±24.47## |
| 注:与空白组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 | ||||
实验结果所示,与对照组比较,模型组SOD活性显著降低、MDA含量显著升高(P < 0.01);与模型组比较,甘草各组SOD活性均显著升高(P < 0.01),甘草800 μg/mL组MDA含量显著降低(P < 0.05),见表 4。
| 组别 | 剂量(μg/mL) | n | SOD(U/mL) | MDA(nmol/mL) |
| 空白组 | - | 6 | 35.63±3.46 | 4.63±1.77 |
| 模型组 | - | 6 | 10.57±1.41** | 11.40±4.47** |
| 甘草 | 400 | 6 | 28.35±2.17## | 10.12±1.56 |
| 甘草 | 800 | 6 | 31.77±1.18## | 6.76±0.79# |
| 注:与空白组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 | ||||
实验结果所示,模型组ROS的释放量较对照组显著升高(P < 0.01);与模型组比较,甘草各组均能显著降低ROS的释放(P < 0.01),见表 5、图 1。
| 组别 | 剂量(μg/mL) | n | DCFH-DA荧光值(% Control) |
| 空白组 | - | 6 | 100.00±3.33 |
| 模型组 | - | 6 | 125.31±3.20** |
| 甘草 | 400 | 6 | 110.55±5.45## |
| 甘草 | 800 | 6 | 108.40±4.27## |
| 注:与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 | |||
|
| 图 1 甘草对H2O2损伤后H9c2细胞ROS释放的影响 |
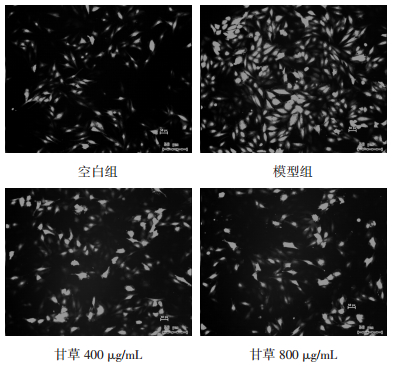
实验结果所示,模型组细胞内Ca2+浓度较对照组显著升高(P < 0.01);与模型组比较,甘草各组均能显著降低细胞内Ca2+浓度(P < 0.01),见表 6、图 2。
| 组别 | 剂量(μg/mL) | n | Fluo-4am荧光值(% Control) |
| 空白组 | - | 6 | 100.00±5.41 |
| 模型组 | - | 6 | 141.87±10.15** |
| 甘草 | 400 | 6 | 120.73±6.98## |
| 甘草 | 800 | 6 | 111.07±5.40## |
| 注:与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 | |||
|
| 图 2 甘草对H2O2损伤后H9c2细胞内Ca2+浓度的影响 |
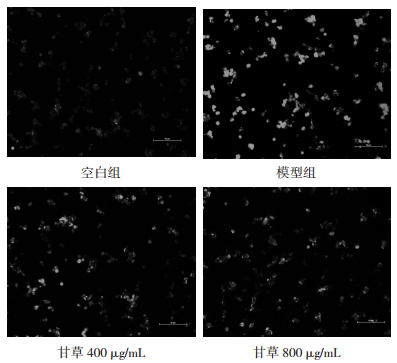
实验结果所示,模型组钙黄绿素的荧光值较对照组显著降低(P < 0.01),表明mPTP的开放水平显著增加;与模型组比较,甘草800 μg/mL组能显著降低mPTP的开放水平(P < 0.01),见表 7、图 3。
| 组别 | 剂量(μg/mL) | n | 钙黄绿色荧光值(%Control) |
| 空白组 | - | 6 | 100.00±9.74 |
| 模型组 | - | 6 | 40.83±2.35** |
| 甘草 | 400 | 6 | 43.33±3.10 |
| 甘草 | 800 | 6 | 50.80±4.40## |
| 注:与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 | |||

|
| 图 3 甘草对H2O2损伤后H9c2细胞mPTP开放的影响 |
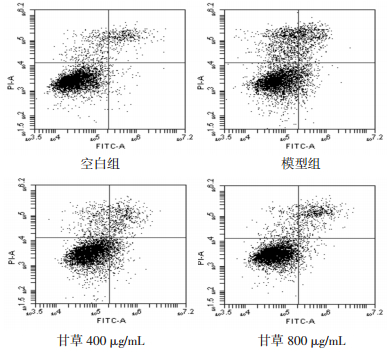
实验结果所示,模型组细胞凋亡率较对照组显著升高(P < 0.01);与模型组比较,甘草800 μg/mL组能降低细胞凋亡率(P < 0.05),见表 8。
| 组别 | 剂量(μg/mL) | n | 细胞凋亡率(%) |
| 空白组 | - | 4 | 9.83±2.16 |
| 模型组 | - | 4 | 21.83±3.61** |
| 甘草 | 400 | 4 | 18.87±1.91 |
| 甘草 | 800 | 4 | 15.07±1.29# |
| 注:与空白组比较,**P < 0.01;与模型组比较,#P < 0.05。 | |||
|
| 图 4 甘草对H2O2损伤后H9c2细胞凋亡率的影响 |
氧化应激是指机体遭受各种有害物质刺激,使组织或细胞内氧自由基增多且清除能力降低,导致机体氧化和抗氧化能力失衡,它与多种心血管疾病的发生、发展相关[18-19]。研究发现缺血的心肌发生再灌后会导致氧自由基(ROS)的大量产生,H2O2是氧自由基组成成员之一。正常情况下,H2O2作为机体的代谢产物可以活化转录因子、促进细胞增殖等,来调节机体生理过程[16],但当H2O2过量时发生单电子还原而产生活性更强的羟自由基(·OH),导致机体的氧化和抗氧化系统失衡引起组织损伤[19-20]。H2O2诱导的体外氧化应激损伤的模型,已被广泛用于模拟体内氧化损伤的病理过程[21-23]。
本论文意在研究甘草对H2O2诱导H9c2心肌细胞损伤的保护作用。H2O2诱导心肌细胞使细胞膜脂质过氧化,细胞活力降低,细胞质中稳定存在的LDH外漏。甘草能够提高心肌细胞活力,减少LDH外漏。同时,H2O2刺激心肌细胞后增强了ROS指示剂DCFH-DA探针的荧光强度,降低了心肌细胞内主要抗氧化酶SOD的活力,并且提高了脂质过氧化产物MDA水平。这一结果证实了H2O2不仅诱导了氧自由基的生成和脂质过氧化,还抑制了心肌细胞抗氧化酶活力,破坏了心肌细胞正常的氧化/抗氧化平衡。甘草能够降低DCFH-DA探针荧光强度及MDA水平、提高SOD活力。实验结果提示,甘草具有清除H2O2诱导的活性氧、减少脂质过氧化产物、增强心肌细胞抗氧化的能力。线粒体作为ROS的主要产生场所,也是ROS最常攻击的部位,线粒体凋亡途径是细胞凋亡的重要途径[24-25]。过量的ROS可以导致细胞内Ca2+浓度增加,线粒体膜电位下降,位于线粒体内外膜之间的膜通透性转换孔(mPTP)开放增加,引发心肌细胞凋亡[26-28]。同时,细胞内过量的Ca2+引发线粒体Ca2+浓度增加,激活还原型底物NADH的合成,加速了电子链的传递,使ROS产生增多[29]。甘草能够减少细胞内钙离子含量,有效抑制mPTP开放,降低心肌细胞凋亡率。实验结果提示,甘草能够通过抑制钙超载、抗凋亡发挥保护心肌细胞的作用。综上所述,甘草对H2O2诱导H9c2心肌细胞损伤具有保护作用,其作用可能是通过抗氧化、抑制钙超载和抗凋亡实现的,此结果为临床治疗缺血性心脏病配伍用药提供参考。
| [1] |
翟恒博. 缺血性心脏病再认识[J]. 心血管病学进展, 2016, 37(4): 395-400. |
| [2] |
叶进. 胸痹研究概览[J]. 环球中医药, 2012, 5(7): 547-552. |
| [3] |
Molavi B, Mehta JL. Oxidative stress in cardiovascular diease:molecular basis of its deleterious effects, its detection, and therapeutic considerations[J]. Curr Opin Cardiol, 2004, 19(19): 488-493. |
| [4] |
Sachidanandam K, Fagan SC, Ergul A. Oxidative stress and cardiovascular disease:antioxidants and unresolved issues[J]. Cardiovasc Drug Rev, 2005, 23(2): 115-132. |
| [5] |
Fearon IM, Faux SP. Oxidative stress and cardiovascular disease:novel tools give(free) radical insight[J]. Mol Cell Cardiol, 2009, 47(3): 372-381. DOI:10.1016/j.yjmcc.2009.05.013 |
| [6] |
Mao CY, Lu HB, Kong N, et al. Levocarnitine protects H9c2 rat cardiomyocytes from H2O2-induced mitochondrial dysfunction and apoptosis[J]. International Journal of Medical Sciences, 2013, 11(11): 1107-1115. |
| [7] |
Munzel T, Gori T, Bruno RM, et al. Is oxidative stress a therapeutic target in cardiovascular diease[J]. European Heart Journal, 2010, 31(22): 2741-2748. DOI:10.1093/eurheartj/ehq396 |
| [8] |
张丹丹. 浅谈甘草成分及其功效[J]. 中国中医药现代远程教育, 2012, 10(21): 128-129. |
| [9] |
Wang X, Zhang H, Chen L, et al. Liquorice, a unique "guide drug" of traditional Chinese medicine:A review of its role in drug interactions[J]. Journal of Ethnopharmacology, 2013, 150(3): 781-790. DOI:10.1016/j.jep.2013.09.055 |
| [10] |
鲁晓翔. 黄酮类化合物抗氧化作用机制研究进展[J]. 食品研究与开发, 2012, 33(3): 220-224. |
| [11] |
周倩, 戴衍朋, 王亮, 等. HPLC法测定生甘草、炙甘草中6种成分[J]. 中成药, 2016, 38(2): 378-382. |
| [12] |
张友波, 徐嵬, 杨秀伟, 等. RP-HPLC法同时测定不同产地甘草中9个主要成分的含量[J]. 药物分析杂志, 2013, 33(2): 214-219. |
| [13] |
Gu Y, Liang Z, Wang H, et al. Tanshinone ⅡA protects H9c2 cells from oxidative stress-induced cell death via microRNA-133 upregulation and Akt activation[J]. Experimental & Therapeutic Medicine, 2016, 12(2): 1147. |
| [14] |
Lee Y, Gustafasson AB. Role of apoptosis in cardiovascular disease[J]. Apoptosis, 2009, 14(4): 536-548. DOI:10.1007/s10495-008-0302-x |
| [15] |
Río LAD, López-Huertas E. Editor's Choice, ROS Generation in peroxisomes and its role in cell signaling[J]. Plant and cell Physiology, 2016, 57(7): pcw076. |
| [16] |
Tiwari M, Tripathi A, Chaube SK. Presence of encircling granulosa cells protects against oxidative stress-induced apoptosis in rat eggs cultured in vitro[J]. Apoptosis, 2017, 22(1): 1-10. DOI:10.1007/s10495-016-1296-4 |
| [17] |
Hong C, Li C, Huo K, et al. Luteolin Prevents H2O2-Induced apoptosis in H9C2 cells through modulating Akt-P53/Mdm2 signaling pathway[J]. Biomed Research International, 2016, 2016: 1-9. |
| [18] |
梁丽萍, 艾力曼·马合木提, 侯月梅. 氧化应激在心血管疾病中的研究进展[J]. 中国医药, 2015, 10(3): 435-437. |
| [19] |
李玉洁, 鲍天冬, 李琦, 等. 复方银杏叶颗粒对H2O2致H9c2细胞损伤的保护作用[J]. 中草药, 2016, 47(3): 459-465. |
| [20] |
Sharikabad MN, Ostbye KM, Brors O. Effect of hydrogen peroxide on reoxygenation-induced Ca2+ accumu-lation in rat cardiomyocytes[J]. Free Radic Biol Med, 2004, 37(4): 531-538. DOI:10.1016/j.freeradbiomed.2004.05.002 |
| [21] |
Janero DR, Hreniuk D, Sharif HM. Hydrogen peroxide-induced oxidative stress to the mammalian heart-muscle cell (cardiomyocyte):lethal peroxidative membrane injury[J]. Journal of Cellular Physiology, 1991, 149(3): 347-364. DOI:10.1002/(ISSN)1097-4652 |
| [22] |
Young IC, Chuang ST, Hsu CH, et al. C-phycocyanin alleviates osteoarthritic injury in chondrocytes stimulated with H2O2 and compressive stress[J]. International Journal of Biological Macromolecules, 2016, 93(Pt A): 852-859. |
| [23] |
Ilavenil S, Da HK, Jeong YI, et al. Trigonelline protects the cardiocyte from hydrogen peroxide induced apoptosis in H9c2 cells[J]. Asian Pacific Journal of Tropical Medicine, 2015, 115(4): 263-268. |
| [24] |
Murphy MP. Understanding and preventing mitochondrial oxidative damage[J]. Biochemical Society Transactions, 2016, 44(5): 1219-1226. DOI:10.1042/BST20160108 |
| [25] |
Murphy MP. How mitochondria produce reactive oxygen species[J]. Biochem, 2009, 417(1): 1-13. DOI:10.1042/BJ20081386 |
| [26] |
Kroemer G, Galluzzi L, Brenner C. Mitochondrial membrane permeabilization in cell death[J]. Physiol Rev, 2007, 87(1): 99-163. DOI:10.1152/physrev.00013.2006 |
| [27] |
Webster KA. Mitochondrial membrane permeabilization and cell death during myocardial infarction:roles of calcium and reactive oxygen species[J]. Future Cardiology, 2012, 8(6): 863-884. DOI:10.2217/fca.12.58 |
| [28] |
Redza-Dutordoir M, Averill-Bates DA. Activation of apoptosis signalling pathways by reactive oxygen species[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2016, 1863(12): 2977-2992. DOI:10.1016/j.bbamcr.2016.09.012 |
| [29] |
Santo-Domingo J, Wiederkehr A, De MU. Modulation of the matrix redox signaling by mitochondrial Ca2+[J]. World Journal of Biological Chemistry, 2015, 6(4): 310-323. DOI:10.4331/wjbc.v6.i4.310 |
 2017, Vol. 36
2017, Vol. 36