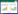文章信息
- 杨非凡, 王玉明, 董文颖, 李楠, 杨益, 李遇伯
- YANG Feifan, WANG Yuming, DONG Wenying, LI Nan, YANG Yi, LI Yubo
- 中药雷公藤的肝脏毒性及其个体易感性
- Hepatic toxicity and its individual susceptibility of Tripterygium Wilfordii
- 天津中医药大学学报, 2018, 37(3): 188-191
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(3): 188-191
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.03.04
-
文章历史
收稿日期: 2017-12-20
近年来,药源性肝损害作为临床较为常见的、易产生严重后果的药源性疾病,已成为制约中医药健康可持续发展所面临的关键性问题[1]。而由于使用中草药而产生的肝损害甚至中毒致死的临床报道数量在中国也逐年上升,上升趋势没有中止的迹象,并且目前正以每年3%~4.5%的速度增加[2]。
雷公藤(Tripterygium Wilfordii Hook. F)又叫做断肠草,是卫矛科雷公藤属藤本植物,又名黄腾木、断肠草等,最早记载于《本草纲目拾遗》;其药味辛苦、性寒,有大毒,归肝、脾、肾经,具有祛风除湿、通络止痛、活血消肿、杀虫解毒等功效[3],多用于自身免疫等难治性疾病的治疗,但在发挥药理活性的同时其产生的毒副作用也不可忽视。雷公藤的药理活性化学成分主要有二萜类(如雷公藤甲素)、三萜类(如雷公藤红素)、生物碱类(如雷公藤总生物碱)等,雷公藤的主要特点就是其起作用的药效成分同时也是毒性成分,这也一直制约了雷公藤中药材在临床应用的开发[4]。雷公藤的主要毒性成分为雷公藤甲素,在相关文献报道中其所致肝毒性在单味肝损伤中药中高居首位,近年来已引起临床高度重视[5-6]。为此本文就雷公藤对肝脏的毒性损伤作用作一综述,并进一步探讨个体可能的易感性机制,以期为中药雷公藤在临床上的合理使用提供依据。
1 中药肝脏毒性研究现状《素问·灵兰秘典论》曰:“肝者,将军之官,谋虑出焉。”肝是人体药物代谢的主要场所,药物对其的毒性损伤自然也是最大。当药物用量过大时,或者遗传因素促使药物代谢发生异常时,某些活性基团可能会耗尽肝脏内的谷胱甘肽(GSH),从而产生氧化应激反应,之后丙二醛(MDA)含量增加,肝脏脂质过氧化,钙-ATP的自稳性受到破坏,最终肝损伤造成肝脏内分泌功能障碍,乃至最终导致肝功能衰竭[7],主要涉及胆汁酸代谢、脂肪酸β氧化、甘油磷脂代谢等通路,但大多中药药源性肝损害的损伤途径和毒性机理尚不是很明确,见图 1。
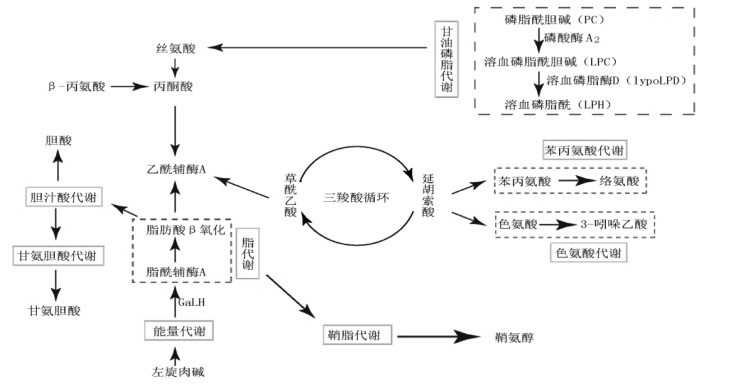
|
| 图 1 肝毒性药物干扰的代谢通路之间的关系 |
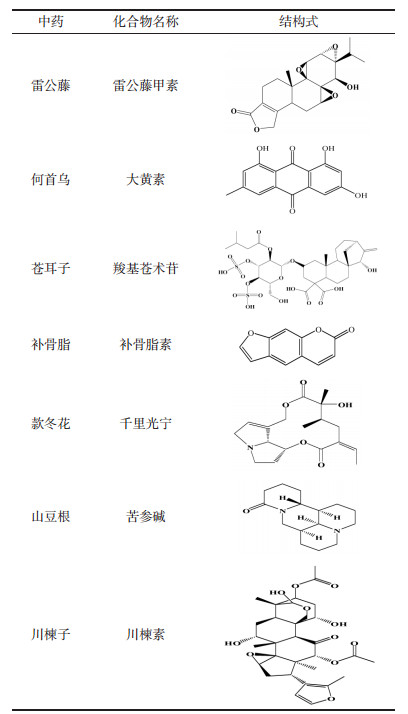
中药已有数千年的人体应用历史和安全性经验,因“多成分、多效应、多靶点、配伍应用、长期用药”等特点导致中药的可控性极其复杂。中药毒性的发生与临床疾病、证候、机体状态、体质等个体因素不无关系。近年来人类已经认识到雷公藤、何首乌、川楝子、栀子、补骨脂、款冬花、山豆根、苍术、苍耳子等中药都能引起严重肝毒性[8]。然而这些中药的毒性物质是什么?具有肝毒性的客观真实性如何?临床上进行早期诊断和干预的可行性如何?一直是困扰临床医生和检验人员的难题。仅有少数毒性成分有文献报道,大部分毒性物质及损伤机制还不清楚,见表 1。
研究表明,雷公藤所含成分中有一部分能够产生较为明显的毒性,能够产生毒性的成分如生物碱、二萜类、三萜类及苷类物质,它们的毒性大小排列为:二萜类>生物碱类>三萜类>苷类。其中,二萜类成分对心、肝、胃肠道及骨髓有明显不良反应,生物碱类物质主要损伤肝脏,破坏红细胞并引起进行性贫血。可以发现,对于肝脏的毒性损害是雷公藤中所含的多种毒性成分的共同作用[9],在这诸多毒性成分中,起主要毒性作用的成分是雷公藤甲素。雷公藤对肝脏毒性损害的机制比较复杂,经研究认为主要可归纳为以下几个因素。
1.1 造成过氧化损伤雷公藤中所含三萜类成分雷公藤内酯醇可引起小鼠急性肝损伤,导致了明显的氧化应激反应。Cao等[10]腹腔给予小鼠雷公藤甲素建立急性肝损伤模型,活性氧的增加和HepG2细胞中GSH含量的减少,证明了雷公藤甲素对于小鼠机体能够产生较为明显的氧化应激反应。大剂量雷公藤甲素可诱导一氧化氮合酶(iNOS)的表达,进而形成大量超氧根离子引起肝毒性[11]。
1.2 引起肝脏代谢紊乱Wang等[12]口服给予,雷公藤甲素(1 000 μg/kg);两周后,发现血清谷草转氨酶(AST)升高,碱性磷酸酶(ALP)和γ-谷氨酰转移酶(γ-GGT)活性增强。发现糖皮质激素和胰岛素样生长因子-1(IGF1)可能参与TP引起的肝毒性。进一步通过全基因芯片分析发现3 329个雌性大鼠肝脏差异表达基因,这些基因的分析确定了肝毒性与胰岛素信号传导通路、葡萄糖代谢等密切相关。Li等[13]采用定量蛋白质组学和靶向有机酸分析技术揭示了雷公藤甲素导致肝损伤的毒性机制,发现参与脂肪酸(FA)代谢的细胞色素P450蛋白家族的成员,如CYP2E1,表现出显著的组间差异,而其均参与了包括细胞脂活性、体脂肪酸β-氧化等途径。
1.3 诱导凋亡性损伤Bid、Bax、Bad这些促凋亡基因能够促进Fas诱导的细胞凋亡。Bax蛋白能与抗细胞凋亡基因Bcl-2的表达蛋白能形成异二聚体,用于阻抑Bcl-2的表达。Kaufmann等[14]研究发现雷公藤甲素能降低人肝L-02细胞成活力,耗散线粒体膜电位并释放细胞色素C、下调抗细胞凋亡Bcl-2蛋白水平、上调促细胞凋亡Bax蛋白水平,通过线粒体途径诱导细胞凋亡从而产生细胞毒性,造成肝损害。
1.4 抑制代谢酶导致肝毒性根据Shen等[15]利用大鼠肝微粒体和肝细胞对雷公藤甲素肝毒性机制的研究发现,雷公藤甲素是一种弱的CYP3A抑制剂,它对CYP3A有依赖性作用,在对其产生抑制作用的同时会残留下来造成雷公藤甲素在肝脏蓄积,增加肝脏的毒性损伤。Sun等[16]采用HPLC法测定大鼠肝微粒体中模型基质和代谢产物,研究雷公藤红素对CYP亚型的抑制作用,结果表明雷公藤红素不仅是CYP1A2和CYP2C11的竞争抑制剂,而且是CYP3A2的混合型抑制剂。即雷公藤在肝脏的正常代谢受到自身的抑制,最终导致肝脏蓄积。
2 肝损伤的个体易感性雷公藤的不良反应甚至肝脏损伤不会发生于每一个人的身上,不同的人应用雷公藤会有不同的临床表现,由此可以大致推测出雷公藤的毒性反应可能存在个体易感性。雷公藤在人体内主要由微粒体细胞色素P450酶系(CYP450s)和环氧化物水解酶系(EHs)代谢,这可能导致了不同个体的器官对于雷公藤毒性的敏感程度不同。根据调查发现雷公藤毒性的个体易感性受年龄、性别和遗传易感性等因素的影响。通常性别是最大的影响因素。
2.1 性别因素许杰州等[17]通过对临床123例雷公藤多甙的不良反应报告分析,发现其中79例出现不同程度不良反应,发生率为6.2%,其中男性为45.2%(19/42),女性为74.1%(60/81)。雷公藤的肾毒性导致女性月经紊乱(表现为月经不调甚至闭经)、性功能减低、性激素水平变化(多见催乳素含量上升和雌二醇含量下降),大剂量服用可能出现难以修复的性腺发育障碍。在小鼠实验中[18]表明:雌性大鼠体内药物暴露量高,清除慢,药物代谢表现出的性别差异。由于雄性动物和雌性动物中CYP450酶的种类和数量有所差异,导致雌性大鼠体内毒性成分残留时间长,由此推测男性的CYP450酶系更有利于雷公藤毒性成分的代谢。
2.2 年龄因素雷公藤的肝脏毒性与患者的年龄呈负相关的趋势。老年人由于内分泌系统和免疫功能减退,用药后起效速度较快,急性不良反应少,故易引起积蓄中毒;育龄期妇女、儿童或合并心肝肾等器质性病变患者易出现雷公藤急性中毒[19]。
2.3 遗传因素 2.3.1 调节性T细胞调节性T细胞(Treg)是一类控制体内自身免疫反应性的T细胞亚群,以“主动”的形式来获得和保持自身的耐受。王欣之等[20]研究给予雌性小鼠雷公藤甲素后,血清转氨酶水平升高,肝细胞坏死,肝脏Treg比例降低,脾脏Treg比例变化不明显,Treg转录因子和IL-10的mRNA水平降低。Treg过继转输外源性补充Treg后,能降低雷公藤甲素引起的血清转氨酶水平升高,减轻肝脏病变程度。说明Treg参与了雷公藤甲素干扰肝脏免疫介导的肝损伤,雷公藤甲素可削弱IL-10的免疫抑制和免疫耐受的作用,Treg可能成为潜在的保护雷公藤甲素肝毒性的靶细胞。
2.3.2 CYP450酶系CYP450酶系是肝脏微粒体混合功能氧化酶系统,在雷公藤代谢中起着重要作用。其中CYP3A4是雷公藤甲素在体内代谢最重要的I相酶。雷公藤甲素经代谢后转化为羟化代谢物,羟化代谢物具有一定的细胞毒性,且在体内停留时间比雷公藤甲素更长[21]。雷公藤甲素的羟化代谢物对体内的CYP3A4具有明显的抑制作用。同时CYP2C19对雷公藤甲素在肝微粒体中的代谢也有一定的影响,并被其所抑制[22]。该研究以S-美芬妥英为探针药物,测定雷公藤醇提物对大鼠肝微粒体CYP2C19酶活性的影响,结果发现雷公藤醇提物对大鼠体内CYP2C19酶具有明显的抑制作用。
综上所述,雷公藤的过量可能导致机体产生肝脏损伤,个体的一些易感因素导致其对雷公藤致肝毒性的敏感性不同。因此,创新研究方法来探索不同的个体对雷公藤的敏感与耐受程度,才能便更好地表明雷公藤毒性效应的分子机制,辨别高危人群,防止发生不良反应。
| [1] |
Ballet F. Preventing drug-induced liver injury:how useful areanimalmodels[J]. DigestiveDiseases, 2015, 33(4): 477-485. |
| [2] |
Bjrnsson ES. Drug -induced liver injury:an overview over the most critical compounds[J]. Archives of toxicology, 2015, 89(3): 327-334. DOI:10.1007/s00204-015-1456-2 |
| [3] |
苏桂花, 苑述刚, 马少丹, 等. 雷公藤的本草学及临床应用研究[J]. 河南中医, 2011, 31(4): 412-413. |
| [4] |
薛璟, 贾晓斌, 谭晓斌, 等. 雷公藤化学成分及其毒性研究进展[J]. 中华中医药杂志, 2010, 25(5): 726-733. |
| [5] |
傅肖岩, 劳邵贤. 重视中药所致肝损害[J]. 中药新药与临床药理, 2003, 14(2): 130-133. |
| [6] |
郭艳红, 谭垦. 雷公藤的毒性及其研究概况[J]. 中药材, 2007, 30(1): 112-117. |
| [7] |
朱云, 李永纲, 王葽, 等. 595例中药导致肝损伤临床特征分析[J]. 中国中西医结合杂志, 2016, 36(1): 44-48. |
| [8] |
关翠雯, 金晶, 李佳, 等. 丹参酮ⅡA激活Nrf2/ARE通路保护雷公藤甲素所致急性肝损伤[J]. 药学学报, 2013, 48(9): 1397-1402. |
| [9] |
虞海燕, 秦万章. 雷公藤活性单体的筛选及毒性研究[J]. 浙江中医学院学报, 2000, 24(2): 70-71. |
| [10] |
Cao LJ, Hou ZY, Li HD, et al. The ethanol extract of licorice (Glycyrrhiza uralensis) protects against Triptolide -Induced oxidative stress through activation of Nrf2[J]. Evidence-Based Complementary and Alternative Medicine, 2017, 2017: 275-289. |
| [11] |
柴智, 周文静, 高丽, 等. 雷公藤肝毒性及其作用机制的研究进展[J]. 中国实验方剂学杂志, 2011, 17(7): 243-246. |
| [12] |
Wang J, Jiang Z, Ji J, et al. Gene expression profiling and pathway analysis of hepatotoxicity induced by triptolide in Wistar rats[J]. Food and chemical toxicology, 2013, 58: 495-505. DOI:10.1016/j.fct.2013.04.039 |
| [13] |
Li M, Hu T, Tie C, et al. Quantitative proteomics and targeted fatty acids analysis reveal the damage of Triptolide in Liver and Kidney[J]. Proteomics, 2017, 17(22): 17-20. |
| [14] |
Kaufmann T, Strasser A, Jost PJ. Fas death receptor sig-nalling:roles of Bid and XIAP[J]. Cell death and differenti-ation, 2012, 19(1): 42-50. DOI:10.1038/cdd.2011.121 |
| [15] |
Shen G, Zhuang X, Xiao W, et al. Role of CYP3A in regulating hepatic clearance and hepatotoxicity of triptolide in rat liver microsomes and sandwich-cultured hepatocytes[J]. Food and chemical toxicology, 2014, 71: 90-96. DOI:10.1016/j.fct.2014.05.020 |
| [16] |
Sun M, Tang Y, Ding T, et al. Inhibitory effects of celastrol on rat liver cytochrome P4501A2, 2C11, 2D6, 2E1 and 3A2 activity[J]. Fitoterapia, 2014, 92: 1-8. DOI:10.1016/j.fitote.2013.10.004 |
| [17] |
许杰州, 黄少弼, 肖征宇. 雷公藤多甙的副作用123例报告[J]. 汕头大学医学院学报, 1996(2): 36-38. |
| [18] |
刘萍霞, 庄笑梅, 王娟, 等. 雷公藤内酯醇前药MC002在大鼠体内药代性别差异研究[J]. 解放军药学学报, 2012, 28(5): 389-403. |
| [19] |
陈利欣, 李晶. 雷公藤的肾毒性作用及其防治[J]. 山东医药, 2009, 49(37): 113-114. DOI:10.3969/j.issn.1002-266X.2009.37.082 |
| [20] |
王欣之, 江振洲, 孙丽新, 等. 探索调节性T细胞在雷公藤甲素诱导肝损伤中作用[C]. 中国药理学会第十三次全国学术大会论文集, 2015: 57-58.
|
| [21] |
邵凤, 王广基, 孙建国, 等. 雷公藤甲素在大鼠肝微粒体代谢的酶动力学研究[C]. 第九届全国青年药学工作者最新科研成果交流会论文集, 2008: 262-268.
|
| [22] |
周文静, 柴智, 闫润红, 等. 雷公藤醇提物对大鼠药物代谢酶CYP2C19活性的影响[J]. 山西中医学院学报, 2014, 15(5): 18-21. |
 2018, Vol. 37
2018, Vol. 37