文章信息
- 张惠敏, 任莹璐, 柳金英, 谢璇, 王青, 苏聪平, 王伟, 郭淑贞
- ZHANG Huimin, REN Yinglu, LIU Jinying, XIE Xuan, WANG Qing, SU Congping, WANG Wei, GUO Shuzhen
- 穿心莲内酯干预异丙肾诱导的心力衰竭小鼠的效应及其机制研究
- Pharmacological effects and mechanisms of andrographolide on isoproterenol induced heart failure in mice
- 天津中医药大学学报, 2018, 37(3): 221-224
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(3): 221-224
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.03.12
-
文章历史
收稿日期: 2018-01-02
心力衰竭(心衰)是各类心血管疾病的严重或终末阶段,5年生存率与恶性肿瘤相当。目前中国心衰的患病率为0.9%,推算的患病人数高达450万[1-2]。近年来,西药治疗心衰虽取得了一定效果,但毒副作用较大,治疗成本快速增加,临床应用受到极大限制。
心衰属中医胸痹、心悸、怔忡等范畴。近年来,有不少学者在治疗心衰的复方中配伍清热解毒药物,取得了较好的疗效[3-4],清热解毒类中药成为心衰治疗药物或成分筛选的重要新来源。
穿心莲具有清热解毒,凉血消肿等功效,穿心莲内酯是爵床科植物穿心莲中提取得到的二萜内酯类化合物,是中药穿心莲的主要有效成分之一[5]。已有研究表明,穿心莲内酯具有抗心肌缺血和抗缺血-再灌注损伤、保护血管内皮细胞、调脂、降血压、抗血小板聚集、抗动脉粥样硬化和改善血液流变性等心血管保护作用[6-7],但其作用机制尚未完全阐明。本实验拟观察穿心莲内酯干预过量异丙肾上腺素(ISO)致小鼠心衰的药效,并进一步采用网络药理学的方法预测其作用靶点,为穿心莲内酯治疗心衰作用机制和靶点的阐明提供依据。
1 材料 1.1 动物SPF级健康C57BL雄性小鼠24只,体质量(20±1)g。均购于北京维通利华实验动物中心。饲养于北京中医药大学SPF级动物实验室,适应性饲养7 d,恒温恒湿环境,自由饮水,普通饲料。
1.2 药物与试剂穿心莲内酯(批号:16051709)由成都普思生物科技有限公司提供。地高辛(批准文号:国药准字H31020678)由上海信谊药厂有限公司提供。盐酸异丙肾上腺素(ISO,批号:101722747)由西格玛-奥德里奇(上海)贸易有限公司提供等。
1.3 仪器与材料加拿大VisualSonics公司高分辨率小动物超声影像系统Vevo2100以及配置的超声探头(MS-400型号);ABI StrpOnePlus Real-Time PCR System(美国ABI公司)等。
1.4 网络药理学数据库在线中医药生物信息学分析工具(BATMAN-TCM)[8]。
2 方法 2.1 分组与造模小鼠适应性饲养1周后,按照体质量随机分为空白组、模型组、穿心莲内酯组、地高辛组等4组。心衰模型的造模方法采用团队前期建立的盐酸异丙肾上腺素梯度造模法:按照第1天20 mg/kg,第2天10 mg/kg,第3~14天5 mg/kg的梯度剂量,给予小鼠皮下注射ISO[9]。给药组和模型组按上述方案造模。空白组皮下注射生理盐水,每天1次,连续14 d。从造模即日起,各给药组灌胃给药,穿心莲内酯组给予穿心莲内酯200 mg/(kg·d),地高辛组每天给予地高辛0.165 mg/(kg·d),模型组与空白组动物给予同体积纯净水,连续给药14 d,每天1次。
2.2 小鼠心脏超声检测实验终点,采用Visual Sonics Vevo 2100小动物高分辨率显微超声成像系统评价各实验组小鼠的心脏结构及心功能,测量左室收缩末期内径(LVIDs)、左室舒张末期内径(LVIDd),分别计算射血分数(EF)、短轴缩短率(FS)和舒张早期二尖瓣血流速度与舒张晚期二尖瓣血流速度比值(E/A)。每只动物采样3次,记录3个心动周期的平均值。
2.3 心脏指数计算实验终点,测量小鼠体质量。小鼠腹腔麻醉后腹主动脉取血,处死后,迅速开胸,摘取心脏,用磷酸缓冲液(PBS)冲洗心腔中的血块,剪除心脏周围结缔组织和血管,称取心脏质量,后续用于计算心脏指数。心脏指数=心脏质量(g)/体质量(g)。
2.4 病理学检测心脏组织放入4%多聚甲醛固定,常规乙醇梯度脱水、石蜡包埋、切片、HE染色,显微镜下观察并记录病变情况。
2.5 网络药理学分析在BATMAN-TCM在线网站中输入穿心莲内酯,得到药物治疗疾病与靶点交互数据集(P < 0.05;score=10)。
2.6 实时荧光定量PCR法(RT-qPCR)检测靶点基因mRNA表达取实验小鼠心肌组织(约200 mg),用Trizol试剂提取总RNA,使用RNA逆转录试剂盒将总RNA合成cDNA。β-actin:上游引物5’-GGCTGTATTCCCCTCCATCG-3’,下游引物5’-CCAGTTGGTAACAATGCCATGT-3’;HMGCR上游引物5’-TGTTCACCGGCAACAACAAGA-3’,下游引物5’-CCGCGTTATCGTCAGGATGA-3’。RT-PCR反应体系每个样本20 μL,加入到96孔板中,每个样本重复3个复孔,放入PCR仪进行荧光定量,实验结果通过平均相对含量(2-ΔΔCT)进行统计分析。
2.7 统计学方法采用SPSS 20.0统计软件进行数据分析,所有数据皆以均数±标准差(x±s)表示,多组比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
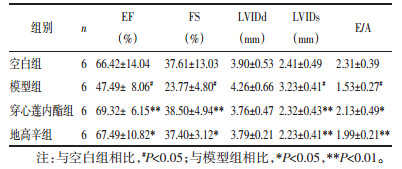
3 结果 3.1 心脏超声与空白组相比,实验终点模型组LVIDs、LVIDd显著增加,EF、FS和E/A显著降低(P<0.05)。与模型组相比,穿心莲内酯组可以显著降低心衰小鼠心室的LVIDs(P<0.01),有降低LVIDd的趋势,无统计学差异,可显著增高EF、FS和E/A(P<0.01),结果与阳性药地高辛作用相似。综上所述,穿心莲内酯对过量异丙肾诱导的心衰具有显著改善作用,见表 1。
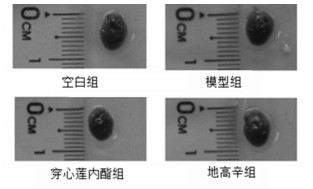
与空白组比,模型组心脏指数显著增加(P < 0.01);与模型组比,穿心莲内酯组可有效降低心衰小鼠心脏指数(P < 0.01),与阳性药地高辛作用相近。见表 2及图 1。
|
| 图 1 穿心莲内酯对过量ISO致心衰小鼠形态学的影响 |
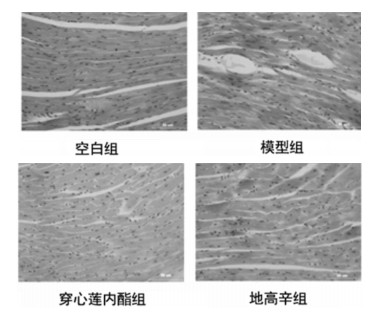
从HE染色结果看,模型组动物心肌组织中,心肌细胞体积增大、肥厚,伴有血窦扩张和结缔组织增生。与模型组相比,穿心莲内酯组动物心肌细胞的肥大程度显著减轻,与阳性药地高辛有相似改善作用,见图 2。
|
| 图 2 穿心莲内酯对过量异丙肾上腺素致心衰小鼠心肌组织形态的影响(HE 染色,×40) |
检索BATMAN-TCM数据库结合文献分析,提示穿心莲内酯与心衰的相关靶点可能为羟甲基戊二酸单酰辅酶A还原酶(HMGCR,HMG-CoA还原酶)基因。
3.5 心肌组织HMG-CoA还原酶基因mRNA表达水平各组小鼠心肌组织HMG-CoA还原酶基因mRNA表达水平如表 3所示。与空白组比较,模型组HMG-CoA还原酶基因表达水平显著升高(P<0.05);穿心莲内酯组可以显著降低过量异丙肾上腺素模型动物心肌组织中HMG-CoA还原酶基因表达(P<0.05),与BATMAN预测结果一致。
本实验通过观察穿心莲内酯干预过量ISO致小鼠心衰的心功能、病理学、形态学和HMG-CoA还原酶基因变化水平,为穿心莲内酯治疗心衰作用机制和靶点提供实验证据。通过超声检测、病理学和形态学结果分析,穿心莲内酯可以改善ISO致心衰小鼠的心脏舒张功能与收缩功能,并减轻模型小鼠心肌细胞肥大程度。本研究检索BATMAN-TCM数据库得出穿心莲内酯与心血管病相关的靶点HMG-CoA还原酶,并进一步通过实时荧光定量PCR法验证该基因的mRNA在模型小鼠中的表达结果显示,与模型组相比,穿心莲内酯组小鼠心肌组织HMG-CoA还原酶基因表达明显下调,提示穿心莲内酯可能通过抑制HMG-CoA还原酶、调节胆固醇合成进而改善ISO引起的心衰过程。
HMG-CoA还原酶是胆固醇合成的重要中间产物和关键限速酶,其表达和活性均受到生物体体内胆固醇含量的反馈调节[10]。近年来研究发现,胆固醇代谢标志物很可能是冠心病的独立危险因素[11],与冠状动脉病变程度密切相关。胆固醇能通过影响巨噬细胞的泡沫化和凋亡,从而破坏动脉粥样硬化斑块的稳定并形成坏死灶[12-14]。临床研究表明,血浆中胆固醇吸收标志物菜油固醇水平越高,全因死亡率和心血管死亡率越高[15]。
目前常用的他汀类药物(如辛伐他汀、阿托伐他汀等)主要用于心血管疾病的预防与临床治疗,其治疗机制主要是通过竞争性抑制HMG-CoA还原酶合成而达到抑制胆固醇合成,同时此类药物对患者并无致死或者致癌因素。随着药物研究的不断发展,逐步发现他汀类药物治在改善心功能的同时伴随着一些不良反应, 如肌肉毒性、肝酶异常、糖尿病高发等严重影响着药物临床效用的发挥[16-17]。因此,针对心血管相关HMG-CoA还原酶抑制剂研发,仍然是胆固醇合成靶向治疗心血管疾病取得突破性进展的关键环节。
综上所述,本研究运用网络药理学与经典药理学方法相结合的研究途径,研究穿心莲内酯的药效靶点,并进一步验证,初步探讨穿心莲内酯治疗心衰的机制可能与抑制HMG-CoA还原酶有关,从而为穿心莲内酯治疗心血管疾病提供了新的证据,但确切的机制有待进一步深入研究。
| [1] |
陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2016》概要[J]. 中国循环杂志, 2017, 32(6): 521-530. |
| [2] |
许顶立, 白煜佳. 2017 ACC/AHA/HFSA心力衰竭管理指南更新解读[J]. 中国全科医学, 2017(29): 3579-3583. DOI:10.3969/j.issn.1007-9572.2017.00.060 |
| [3] |
吴伟, 彭锐. 冠心病热毒病机的探讨[J]. 新中医, 2007, 39(6): 90-92. |
| [4] |
左冠超. 基于TGF-β1/TAK1信号通路观察通心络胶囊干预ISO致大鼠心肌纤维化的实验研究[D]. 成都: 成都中医药大学, 2016.
|
| [5] |
国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 化学工业出版社, 2010.
|
| [6] |
刘国利, 刘永琼. 穿心莲内酯的研究进展[J]. 医药导报, 2006, 25(1): 48-50. |
| [7] |
李否斌, 曾韬慧, 曾靖. 穿心莲内酯药理作用研究进展[J]. 赣南医学院学报, 2015, 35(3): 482-485. |
| [8] |
Liu Z, Guo F, Wang Y, et al. BATMAN -TCM:a Bioinfor-matics analysis tool for molecular mechANism of traditional Chinese medicine[J]. Scientific Reports, 2016, 6: 21146. DOI:10.1038/srep21146 |
| [9] |
杨鸣, 王达洋, 龚嫒媛, 等. 气阴两虚型心衰病证结合小鼠模型的构建与评价[J]. 中国中医急症, 2015, 24(12): 2076-2078. DOI:10.3969/j.issn.1004-745X.2015.12.003 |
| [10] |
Cederberg H, Gylling H, Miettinen T A, et al. Non-choles-terol sterol levels predict hyperglycemia and conversion to type 2 diabetes in Finnish men[J]. Plos One, 2013, 8(6): e67406. DOI:10.1371/journal.pone.0067406 |
| [11] |
李天平, 轩贵平, 庹勤慧. 胆固醇代谢调控的研究进展[J]. 临床与病理杂志, 2014, 34(1): 71-75. |
| [12] |
Chang TY, Chang CC, Ohgami N, et al. Cholesterol sensing, trafficking, and esterification[J]. Annual Review of Cell & Developmental Biology, 2006, 22(1): 129. |
| [13] |
Hung KT, Berisha SZ, Ritchey BM, et al. Red Blood Cells Play a Role in Reverse Cholesterol Transport[J]. Arte-riosclerosis Thrombosis & Vascular Biology, 2012, 32(6): 1460. |
| [14] |
de Mello VD, Lindstrm J, Eriksson JG, et al. Markers of cholesterol metabolism as biomarkers in predicting diabetes in the Finnish Diabetes Prevention Study[J]. Nutrition Metabolism & Cardiovascular Diseases, 2015, 25(7): 635. |
| [15] |
朱宝贤. 他汀类药物不良反应及其相关因素研究进展[J]. 内蒙古中医药, 2013, 32(34): 127-128. |
| [16] |
Betowski J, Wójcicka G, Jamrozwiniewska A. Adverse effects of statins-mechanisms and consequences[J]. Current Drug Safety, 2009, 4(3): 209. DOI:10.2174/157488609789006949 |
| [17] |
廖清池, 周胜华. 他汀类药物与血管新生研究进展[J]. 心血管病学进展, 2013, 34(2): 276-279. |
 2018, Vol. 37
2018, Vol. 37