文章信息
- 任静, 吴玉梅, 马丽, 常梦春, 刘勃缨, 张丽娜, 刘志东
- REN Jing, WU Yumei, MA Li, CHANG Mengchun, LIU Boying, ZHANG Lina, LIU Zhidong
- 三七总皂苷微乳对帕金森模型小鼠行为学及纹状体多巴胺含量的影响
- Effects of Panax Notoginseng Saponins microemulsion on behavior and striatal dopamine content in Parkinson's model rats
- 天津中医药大学学报, 2018, 37(3): 234-238
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(3): 234-238
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.03.15
-
文章历史
收稿日期: 2018-02-14
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 300193
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin 300193, China
帕金森病是主要发生于中老年人群的一种神经退行性疾病。临床症状以静止性震颤、运动迟缓、肌张力增高和姿势平衡障碍为主要特征,严重影响患者的运动和生活能力,并可导致残障。其发生机理可能与黑质-纹状体中多巴胺(DA)含量减少有关,治疗该病的基本原则是提高大脑黑体中DA的含量[1]。
三七[2]为五加科植物三七[Panax notoginseng(Burk.)F. H. Chen]的干燥根和根茎,主产于中国滇桂西南部,始载于《本草纲目》,有“参中之王”的美誉。三七总皂苷(PNS)为三七的主根或根茎加工制成的总皂苷,是三七的主要成分之一,在治疗心脑血管疾病方面具有确切的疗效[3],但其口服易受胃肠道环境破坏,生物利用度低,油包水型微乳[4]将亲水性药物包载后,可显著提高药物的小肠黏膜透过性,保护药物免受胃肠道酶的降解,增加药物吸收,可提高药物的生物利用度。因此笔者将三七总皂苷制备成W/O型微乳,观察其对帕金森模型小鼠的治疗作用。
1 材料 1.1 仪器行为学设备(SCI Forced Swim Version2.0,SCI Tail Suspension Version2.0);高效液相系统荧光检测器(岛津,型号:RF-10AXL),XP205十万分之一天平(METTLER TOLEDO);匀浆机(上海弗鲁克流体机械制造有限公司);离心机(Thermo Fisher Scientific);-80 ℃冰箱(Haier超低温保存箱),ATS高压均质机(ATS工业系统有限公司)。
1.2 试剂1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP)(美国Sigma公司SLBS2977V);生理盐水(辰欣药业股份有限公司1611280721);高氯酸,柠檬酸(源叶生物Z14M8Y30915),乙酸钠(天津市风船化学试剂科技有限公司20150731),1-庚烷磺酸钠(源叶生物G25M8L32588),三乙胺(天津市光复精细化工研究所20150401),乙二胺四乙酸二钠(源叶生物Z04M8Y30614),L-半胱氨酸(上海蓝季生物150228),磷酸二氢钾(天津市科密欧化学试剂有限公司20150504),盐酸多巴胺(中国食品药品检定研究院100070-201507),三七总皂苷原料药(云南玉溪万方天然药物有限公司,批号021108,R1,Rg1和Rb1质量分数分别为13.79%、47.26%、24.55%),大豆磷脂[SP,上海艾韦特(A.V.T.)医药科技有限公司SY-SI-170103],油酸聚乙二醇甘油酯(Labrafil M 1944CS,法国佳法赛公司),乙醇为色谱纯。标准品溶剂为0.01 mol/L高氯酸、0.50 mmol/L Na2EDTA、0.1 g/L L-半胱氨酸的混合水溶液。组织裂解液为0.60 mol/L高氯酸、0.50 mmol/L Na2EDTA、0.1 g/L L-半胱氨酸的混合水溶液。高氯酸沉淀剂为1.20 mol/L K2HPO4、2.00 mmol/L Na2EDTA的混合水溶液。
1.3 实验动物C57BL/6小鼠购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2016-0011。动物室温度:(25±2)℃,相对湿度:(50±2)%,相关研究遵照动物实验原则进行。
2 实验方法 2.1 PNS微乳的制备PNS微乳各处方组成为:油酸聚乙二醇甘油酯(Labrafil M 1944CS,58%)、大豆磷脂(SP)/乙醇(Km=1,25%)、PNS溶液(400 mg/mL,17%)。按处方量称定油相、乳化剂与PNS水溶液于烧杯中,50 ℃恒温条件下搅拌均匀,依次经分散机分散3 min,高压均质机800 bar压力下均质5次,即得PNS微乳[5]。
2.2 动物分组及给药实验选用24只C57BL/6小鼠,自由饮水、取食,于实验前适应性饲养1周。按随机数字表法随机分为4组,即对照组、模型组,PNS微乳及溶液给药组,每组6只,模型组腹腔注射MPTP[30 mg/(kg·d)]连续注射5 d,对照组腹腔注射等量生理盐水,给药组于造模过程的第3天提前给予PNS微乳及溶液(100 mg/kg),1 h后腹腔注射MPTP[30 mg/(kg·d)],直到造模结束;模型组及正常组每天在给药后进行行为学评价,PNS微乳及溶液组在最后1次给药后进行行为学评价,检测药物对实验动物肢体运动协调功能、纹状体多巴胺含量的影响。
2.3 PNS微乳对帕金森病小鼠肢体运动功能的影响 2.3.1 爬杆实验实验选取一根长80 cm,直径1 cm的金属杆,外部缠绕纱布以防打滑,底部固定在铁架台上。将受试小鼠头向下放于金属杆顶端,记录小鼠从杆顶爬至杆底的时间,以小鼠后肢离开顶端开始计时至完全接触底座停止,每只小鼠记录3次爬杆时间,取平均值进行统计学分析,如遇小鼠出现中途停顿或返向攀爬,则重新测量。
2.3.2 悬尾实验实验在行为学实验设备中进行,将小鼠尾巴悬挂在挂钩上,观察小鼠运动能力,记录小鼠震颤时间,进行统计学分析。
2.3.3 游泳实验实验在行为学实验设备中进行,将小鼠置于水缸中,水温为25~30 ℃,评分标准如下:在受试时间内能连续不断游泳者记30分;大部分时间游泳仅偶尔漂浮者记25分;漂浮时间占整个受试时间50%以上者记20分;偶尔游泳者记15分;偶尔用后肢游动者并漂浮在一边者记10分。最后计算得分情况,并作统计学分析。
2.4 PNS微乳对帕金森病小鼠DA含量的影响 2.4.1 对照品溶液的配制精密量取盐酸DA标准品1.12 mg,置于100 mL量瓶中,加标准品溶剂溶解并定容。
2.4.2 供试品溶液的制备实验动物断头取脑,在冰枕上分离出脑组织纹状体,于-80 ℃冷冻保存。按纹状体:组织裂解液=1 g:7.5 mL的比例加入组织裂解液,匀浆,冷冻离心15 min(12 000 r/min)。上清液再离心1次,于-80 ℃下保存,样品待测前先低温解冻,加入等体积的高氯酸沉淀剂,在冰浴中放置10 min后,冷冻离心15 min(12 000 r/min),过0.22 μm的滤膜,即得。
2.4.3 色谱条件色谱柱:Angilent C18(5 μm,4.6 mm×200 mm);流动相:柠檬酸-乙酸钠缓冲液:甲醇(pH 3.8)梯度洗脱,0~10 min:5%B,10~15 min:5%~50%B,15~20 min:50%B;激发波长(EM):330 nm,发射波长(EX):280 nm;柱温:25 ℃;进样量:20 μL。
2.4.4 方法专属性将空白溶液、盐酸DA对照品溶液及脑组织样品溶液分别进样后记录其色谱图,结果显示,在DA出峰位置,空白无干扰,且目标峰分离度良好,符合方法学要求。
2.4.5 标准曲线的制备精密移取上述对照品溶液适量,分别稀释成448、358.4、224、89.6、44.8、22.4、11.2、5.6 ng/mL系列对照品溶液,以浓度(C)为横坐标X,峰面积(A)为纵坐标Y,绘制标准曲线,得标准曲线方程为Y=407.84X-1 129.3,r为0.999 9。DA在5.6~448 ng/mL范围内线性关系良好。
2.4.6 精密度实验取6份同一样本脑组织,分别加入含有一定量的DA对照品,按照脑组织的处理方法处理后进样分析。结果表明,6份脑组织样品的峰面积RSD(%)为0.96%,符合方法学要求。
2.4.7 方法回收率考察取6份已知DA含量的同一脑组织样品200 μL,分别加入同一浓度的对照品溶液,按照脑组织的样品处理方法处理后进样分析,计算加样回收率。结果平均回收率为97.66%±1.49%,表明该方法回收率良好。
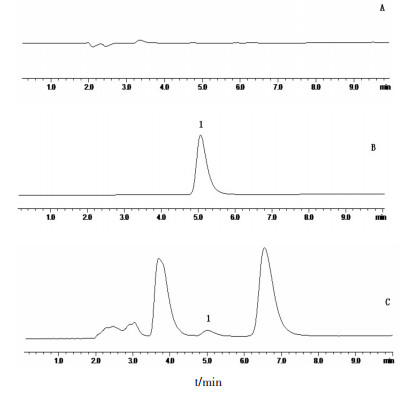
|
| A.空白;B.对照品溶液;C.样品;1.多巴胺 图 1 多巴胺专属性图谱 |
所有数据均采用SPSS 20.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异具有统计学意义。
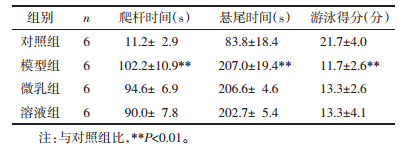
3 实验结果 3.1 三七总皂苷微乳对帕金森病小鼠肢体运动功能的影响 3.1.1 爬杆实验爬杆实验主要考察模型小鼠的肢体运动协调能力,随着训练次数的增加,实验小鼠对爬杆实验表现为越来越熟练。爬杆所用的时间越短,说明小鼠肢体运动协调能力越好。结果如表 1所示,PD模型组小鼠爬杆时间明显延长,与对照组相比有统计学意义差异(P<0.01);与模型组相比,三七总皂苷微乳及溶液组的爬杆时间均有所改善,但与模型组相比无统计学差异。
悬尾主要观察小鼠悬尾后的肢体运动情况,模型组能明显观察到小鼠肢体的震颤现象,震颤时间越长,说明小鼠肌强直等情况越严重。结果如表 1所示,PD模型组的震颤时间明显长于对照组,对照组和PD模型组间有统计学差异(P<0.01),三七总皂苷微乳及溶液组震颤现象有所改善,但与模型组相比无统计学差异。
3.1.3 游泳实验游泳实验可以反映实验动物的肢体运动协调能力,得分越低,小鼠多处于漂浮状态,说明小鼠震颤、肌强直等情况越严重,且能观察到模型组小鼠有震颤现象。结果如表 1所示,对照组和PD模型组的分值有统计学差异(P<0. 01),三七总皂苷微乳及溶液组游泳现象有所改善,但与模型组相比无统计学差异。
3.2 多巴胺含量测定将各组样品进样后分析,实验测得数据以均数±标准差(x±s)表示,数据处理采用单因素方差分析,用SPSS 20.0统计软件进行统计学处理,结果见表 2。
如表 2所示,与正常组比较,模型组DA含量显著下降(P<0.01),PNS微乳及溶液给药组DA含量显著升高(P<0.01);三七总皂苷微乳组与溶液组相比,两组之间有统计学差异(P<0.01)。
4 讨论三七总皂苷在心脑血管系统、血液系统、中枢神经系统和免疫系统等方面均得到广泛的应用[6]。在心脑血管方面,三七总皂苷具有抗心肌缺血、抗心肌梗死的作用[7-8]、脑缺血保护作用[9],抗血栓作用[10],抗炎[11]、抗氧化[12-13]等作用。梁建庆等[16]采用6-羟基多巴胺偏侧损毁黑质制备PD大鼠模型,研究三七总皂苷治疗帕金森的作用靶标,结果表明其作用靶标是神经行为学、TH及DNA mRNA、pro-BDNF阳性细胞。
在众多帕金森病动物模型中应用最广泛的是6-OHDA损毁的帕金森大鼠模型和1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导的帕金森小鼠模型,均是研究PD的良好动物模型,两者存在许多相同点和相异处。两者有相同的造模机制[17],都可模拟较好的急性或亚急性模型,但模拟慢性模型情况各异[18]。两实验均结合行为学、神经生化递质等检测结果综合评定模型,但行为学实验观察方法、内容和结果不同,前者造模成功率不稳定,存在机械损伤;后者的成功率虽较高,但存在停药后机体的代偿,症状可逆[19]。由于小鼠对MPTP的敏感性界于大鼠与灵长类之间,本实验采用C57BL/6小鼠腹腔注射PMTP复制PD模型。PD模型小鼠的行为学改变常常是由多种形式的行为障碍引起的综合结果,不能采用一种行为学指标来检测行为学的障碍,本研究以爬杆实验、悬尾实验、游泳实验作为检测动物肢体运动的协调能力的指标。
DA是哺乳动物中脑黑质多巴胺能神经细胞分泌的一种重要神经递质,与帕金森病的发生密切相关。脑内纹状体DA含量极高,约占全脑的70%,当多巴胺能神经元减少50%时,DA含量降至正常的30%,可导致帕金森氏病的症状出现[20-21]。
本研究依据PD模型制备方法,采用亚急性MPTP腹腔注射C57BL/6小鼠制备PD模型,随时观察模型小鼠行为学的变化,高效液相色谱-荧光检测法检测纹状体组织中DA的含量。实验过程中观察到PD模型鼠的震颤、不自主抖动都很明显,模型组行为学指标与正常组比较均有统计学差异,模型的复制比较成功。给药组的行为学变化与模型组比较无统计学差异,行为学障碍略有改善,通过脑组织中DA含量的测定结果可知,造模后PD模型鼠脑组织中的DA含量明显降低,与正常组相比有统计学差异;给予PNS微乳及溶液治疗后的小鼠,脑组织中DA含量明显高于PD模型组,与模型组相比有统计学差异;PNS制剂组与溶液组间有统计学差异,制剂组DA含量更加接近正常组,提示原因可能是溶液代谢较快,三七总皂苷微乳具有缓释效果。
因此,PNS微乳对帕金森模型鼠确有治疗作用,为后期三七总皂苷微乳的药动学及PK-PD研究奠定基础。
| [1] |
祖文, 贾纳, 赛那, 等. 帕金森病发病机制及治疗药物的研究进展[J]. 北方药学, 2015, 12(7): 101-103. |
| [2] |
中华人民共和国药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2015, 212-213.
|
| [3] |
刘抒雯, 刘敬霞, 虎喜成, 等. 三七总皂苷治疗缺血性脑卒中研究进展[J]. 中国实验方剂学杂志, 2015, 21(15): 217-220. |
| [4] |
刘洋, 吕娟丽, 沈丹, 等. 微乳口服给药系统的研究进展[J]. 武警医学, 2009, 20(3): 273-274. |
| [5] |
Liu Z, Zhang Q, Ding L, et al. Preparation procedure and pharmacokinetic study of water -in -oil nanoemulsion of panax notoginseng saponins for improving the oral bioavailability[J]. Curr Drug Deliv, 2016, 13(4): 600-610. DOI:10.2174/1567201812666150608095517 |
| [6] |
孙丽艳, 张默涵, 张红丹. 三七总皂苷的药理作用研究进展[J]. 世界最新医学信息文摘, 2016, 16(82): 29-30. DOI:10.3969/j.issn.1671-3141.2016.82.020 |
| [7] |
Liu JJ, Wang YT, Qiu L, et al. Saponins of Panax notoginseng:chemistry, cellular targets and therapeutic opportunities in cardiovascular diseases[J]. Expert Opin Investig Drugs, 2014, 23(4): 523. DOI:10.1517/13543784.2014.892582 |
| [8] |
Han SY, Li HX, Ma X, et al. Evaluation of the antimyocardial ischemia effect of individual and combined extracts of Panax notoginseng and Carthamus tinctorius in rats[J]. J Ethnopharmacol, 2013, 145(3): 722. DOI:10.1016/j.jep.2012.11.036 |
| [9] |
Li H, Deng CQ, Chen BY, et al. Total saponins of Panax no-toginseng modulate the expression of caspases and attenuate apoptosis in rats following focal cerebral ischemia-reperfu-sion[J]. J Ethnopharmacol, 2009, 121(3): 412. DOI:10.1016/j.jep.2008.10.042 |
| [10] |
Lau AJ, Toh DF, Chua TK, et al. Antiplatelet and anticoagu-lant effects of Panax notoginseng:comparison of raw and steamed Panax notoginseng with Panax ginseng and Panax quinquefolium[J]. J Ethnopharmacol, 2009, 125(3): 380. DOI:10.1016/j.jep.2009.07.038 |
| [11] |
徐枝芳, 唐璐, 陈志刚, 等. 早期使用三七总皂苷对大鼠脑出血炎症的影响[J]. 中国实验方剂学杂志, 2009, 15(9): 77. |
| [12] |
夏星, 钟振国, 冯丹霞. 三七总皂苷保护PC12细胞对抗过氧化氢损伤的作用[J]. 中国实验方剂学杂志, 2013, 19(4): 216. |
| [13] |
Jia CL, Xiong MQ, Wang PW, et al. Notoginsenoside R1 at-tenuates atherosclerotic lesions in ApoE deficient mouse-model[J]. Plos one, 2014, 9(6): 1. |
| [14] |
项峥, 张剑峰, 何凡, 等. 半数溶血量测定在血塞通注射液所致溶血不良反应预警中的作用[J]. 药物不良反应杂志, 2012, 14(1): 15. |
| [15] |
张剑峰, 项峥, 窦德强. 血塞通注射液溶血检测方法研究[J]. 中国现代中药, 2011, 13(1): 34. |
| [16] |
梁建庆, 何建成, 王政. 三七总皂苷治疗帕金森病大鼠的作用靶标研究[J]. 中华中医药杂志, 2015, 30(5): 1575-1579. |
| [17] |
Carrasco E, Casper D. Werner PDopaminergic neurotoxicity by 6-OHDA and MPP +:differential requirement for neu-ronal cyclooxygenase activity[J]. J Neurosci Res, 2005, 81(1): 121-131. DOI:10.1002/(ISSN)1097-4547 |
| [18] |
Hirsch EC, Hoglinger G, Rousselet E, et al. Animal models of Parkinson's disease in rodents induced by toxins:an update[J]. J Neural Transm Suppl, 2003, 65: 89-100. DOI:10.1007/978-3-7091-0643-3 |
| [19] |
Iancu R, Mohapel P, Brundin P, et al. Behavioral characteriza-tion of a unilateral 6-OHDA-lesion model of Parkinson's disease in mice[J]. Behav Brain Res, 2005, 162(1): 1-10. DOI:10.1016/j.bbr.2005.02.023 |
| [20] |
Yuan H, Zhang ZW, Liang LW, et al. Treatment strategies for Parkinson's disease[J]. Journal of Managed care Medicine, 2010, 26(1): 66-76. |
| [21] |
武倩, 叶敏, 蒲小平. 中药提取物CTE对MPTP所致帕金森病小鼠模型的神经保护作用[J]. 中国新药杂志, 2011, 20(4): 355-358. |
 2018, Vol. 37
2018, Vol. 37