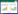文章信息
- 刘庆丰, 于帅, 孙甜甜, 李敏, 丛竹凤, 高鹏, 代龙
- LIU Qingfeng, YU Shuai, SUN Tiantian, LI Min, CONG Zhufeng, GAO Peng, DAI Long
- 不同分子量土鳖虫活性小肽凝胶的透皮特性研究
- The study of the skin penetration characteristics with different molecular weight peptide gel woodlouse
- 天津中医药大学学报, 2018, 37(3): 242-245
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(3): 242-245
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.03.17
-
文章历史
收稿日期: 2018-01-25
2. 山东省肿瘤防治研究院, 济南 250117
2. Shandong Institute of Cancer Prevention and Control, Jinan 250117, China
土鳖虫,又称
R-301型旋转蒸发器(上海申顺生物科技有限公司);CT-241电渗析仪(浙江赛特膜技术有限公司);卷式超滤膜(1KDa、3KDa)(北京市旭邦膜设备有限责任公司);LGJ-10C型真空冷冻干燥机(杭州大卫科教仪器有限公司);电热恒温水浴锅(上海精宏实验设备有限公司);AL-204型万分之一天平;KQ-500E超声波清洗器(昆山市超声仪器有限公司);电热恒温水浴锅(上海精宏实验设备有限公司);UV-1100型紫外-可见分光光度计(上海天美科学仪器有限公司);ermeGear垂直透皮扩散渗透仪(上海玉研科学仪器有限公司)。
1.2 试药及试剂胰蛋白酶(批号F20071228),酶活力2 000 U/mg;胃蛋白酶(批号F20110712),酶活力3 000 U/mg(均购自上海蓝季科技发展有限公司产品);分子量标准品:牛血清白蛋白(MW66430)(上海源叶生物科技有限公司)。
土鳖虫药材(雌虫干燥体,购自济南建联中药店),经山东中医药大学郭庆梅老师鉴定为鳖蠊科中华真地鳖(Eupolyphaga sinensis Walker)的雌虫干燥体。
硫化钠、氯化钠、丙三醇、三乙醇胺、氮酮,以上试剂均为分析纯,卡波姆940,蒸馏水。
SD大鼠,SPF级,体质量200~250 g,由山东中医药大学实验动物中心提供,合格证为SCXK(鲁)201300010。
2 方法与结果 2.1 土鳖虫活性小肽制备将土鳖虫药材粉碎过60目筛,取1 000 g,加10倍量纯水,煮沸20 min,待水液降温至40 ℃,用稀盐酸溶液调pH至1.5左右,加胃蛋白酶适量,40 ℃保温酶解2 h;再用稀氢氧化钠溶液调pH至8.0左右,加入胰蛋白酶适量,40 ℃保温酶解4 h[4];煮沸10 min灭酶,迅速冷却至室温,放置冰箱低温(4 ℃左右)冷藏过夜,离心(4 500 r/min)10 min,取上清液经电渗析仪除盐得土鳖虫酶解液[5],再依次用过分子截留量为3 KDa、1 KDa的超滤膜进行超滤,得到不同分子量的土鳖虫活性小肽组分,低温减压浓缩(65 ℃,-0.07~-0.08 MPa)后进行冻干得不同分子量土鳖虫活性小肽冻干粉(P1:M < 1 KDa,P2:1 KDa<M<3 KDa,P3:M>3 KDa),灭菌后-20 ℃低温保存。
2.2 总肽含量测定 2.2.1 溶液的配制对照品溶液的制备:精密称定牛血清白蛋白对照品适量,加水制成每1 mL含0.2 mg的溶液,即得。
土鳖虫活性小肽溶液的制备:分别取土鳖虫活性小肽冻干粉(P1:6.45 mg、P2:3.12 mg、P3:6.35 mg),用纯净水定容至25 mL容量瓶中,摇匀,制得P1样品溶液、P2样品溶液、P3样品溶液。
2.2.2 测定方法按照文献采用福林酚比色法测定总肽含量[6],依次测定对照品及P1样品溶液、P2样品溶液、P3样品溶液的吸光度,绘制标准曲线,得回归方程为:Y=0.482 5X+0.029 7(r2=0.997 6),并计算不同分子量土鳖虫活性小肽的总肽含量。结果见表 1。
实验结果得出,3种不同土鳖虫溶液中,均含有活性肽,其中P2溶液中含肽量最高,占总质量的70.84%,P1溶液中含肽量最少,占总质量的40.13%。
2.3 不同分子量土鳖虫活性小肽凝胶体外透皮特性研究 2.3.1 土鳖虫活性小肽凝胶的制备凝胶基质配方:卡波姆940,30 g(提前加入蒸馏水中充分溶胀成1%的溶液),丙三醇4 g,土鳖虫活性小肽0.2 g,蒸馏水15 mL,氮酮1 g,三乙醇胺0.1 g,共计50 g。
不同凝胶样品制备:将不同分子量的土鳖虫活性小肽P1、P2、P3溶于15 mL蒸馏水中,加入充分溶胀的卡波姆溶液,混匀,依次加入甘油、氮酮,边搅拌边滴加三乙醇胺至凝胶pH为7左右[7],即得土鳖虫活性小肽P1凝胶样品、P2凝胶样品、P3凝胶样品。
离体鼠皮制备:取SD大鼠,断颈处死,立即剥离大鼠腹部及背部皮肤,用8%硫化钠溶液脱毛,并小心剔除多余皮下组织,再用生理盐水清洗干净,于4 ℃保存备用,1周内用完。实验前检查皮肤的完整度,避免破损。
2.3.2 透皮扩散实验方法将处理好的皮肤固定于Franz扩散池,供给池与接收池之间,角质层面向供给池,接收池注满生理盐水并排净气泡,取1 g凝胶均匀涂布于鼠皮上,300 r/min,37 ℃保温开始计时,分别于1、2、4、6、8、10、12、24 h,取出全部接收液并立即补加等量的接收液,接收液浓缩至1.5 mL,再进行肽含量测定[8-10]。其中,接收池体积为15 mL,有效透过面积为3.14 cm2。
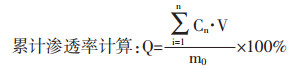
|
式中Q为累积渗透率,Cn为t时接收液肽浓度,V为接收液体积,m0为凝胶含有的初始肽量。以累积渗透率Q(%)对时间t(h)作图,得累计透皮曲线。
2.3.3 土鳖虫活性小肽水溶液与凝胶剂透皮性比较按照2.3.1项下方法分别制备P1、P2、P3凝胶样品,并制备等浓度的小肽水溶液样品,采用上述透皮扩散实验方法,比较P1、P2、P3水溶液与凝胶剂在大鼠皮肤中的渗透性。结果见表 2。
结果表明,P1、P2、P3凝胶剂在大鼠皮肤中的渗透效果均优于水溶液,透皮吸收率均明显提高,说明将土鳖虫活性小肽制成凝胶剂型有利于提高其渗透性,由于凝胶基质中含有氮酮等促渗剂成分,因此渗透性要比水溶液好很多。
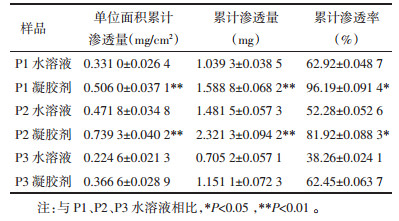
2.4 体外透皮扩散实验 2.4.1 不同大鼠皮部位对土鳖虫活性小肽P1凝胶剂透皮性的影响按照2.3.1项下方法制备土鳖虫活性小肽P1凝胶样品,并按2.3.1项下方法制备大鼠腹部及背部皮肤,采用上述透皮扩散实验方法,比较小肽P1凝胶在大鼠不同皮肤部位中的渗透性,结果见表 3。
结果表明,背部皮肤累计渗透率为54.03%,明显小于腹部皮肤96.19%,单位面积渗透量腹部是背部的1.74倍,因此,实验选择大鼠腹部皮肤进行体外透皮实验。
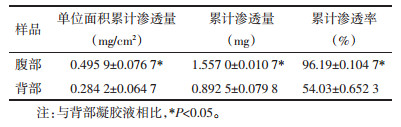
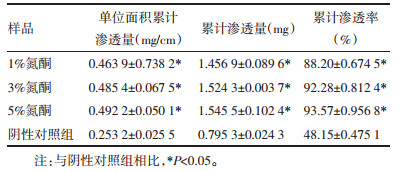
2.4.2 不同促渗剂对土鳖虫活性小肽P1凝胶剂透皮性的影响按照2.3.1项下方法分别制备含3%氮酮、3%PEG400、3%油酸不同促渗剂的小肽P1凝胶样品,采用上述透皮扩散实验方法,比较同浓度不同促渗剂对P1凝胶在大鼠皮肤中渗透性差异。结果见表 4。
结果表明,3种不同促渗剂对P1的渗透效果:氮酮>油酸>PEG400,且氮酮的单位面积渗透量分别是PEG400、油酸的1.77倍、1.54倍,说明氮酮的促渗效果更好,这可能与氮酮对皮肤的作用机制有关,它在细胞间类脂膜双分子层结构中发生作用,使其致密性降低,流动性增加[11]。
2.4.3 不同浓度氮酮对土鳖虫活性小肽P1凝胶剂透皮性的影响按照2.3.1项下方法分别制备含1%氮酮、3%氮酮、5%氮酮小肽P1凝胶样品,采用上述透皮扩散实验方法,比较不同浓度氮酮对P1凝胶渗透性的影响。结果见表 5。
结果表明,3种浓度的氮酮对土鳖虫活性小肽的促渗作用基本无区别[12],选取1%氮酮作为渗透剂即可满足实验要求。
3 讨论通过本实验,采用酶解方法和超滤法得到3种不同分子量的物质,分别为P1、P2、P3。同时folin肽含量测定方法对3种物质进行肽含量测定,得出含肽量顺序为P2>P3>P1。但是通过对比P1、P2、P3凝胶及其水溶液的累计渗透率,得出分子量越小的透皮性越好,即P1凝胶透皮效果最佳。并通过不同大鼠皮肤透过实验,得出P1凝胶在大鼠腹部皮肤透皮效果更好,P1凝胶累计渗透率可达94.26%。通过对比含3%氮酮、3%PEG400、3%油酸不同促渗剂的小肽P1凝胶样品,3%氮酮对P1凝胶样品促渗作用更强,累计渗透率达96.43%。同时对比含1%氮酮、3%氮酮、5%氮酮小肽P1凝胶样品,最后得出不同浓度氮酮对P1凝胶渗透性影响差异不大。
根据人体皮肤吸收原理,分子量越小的物质越易被皮肤吸收,本实验得出土鳖虫活性小肽3种物质中的P1透皮效果优于其他两种物质,佐证了这一吸收原理,但是土鳖虫活性小肽P1组分中可能含有游离氨基酸,氨基酸分子量小,易被人体皮肤吸收,这可能是造成P1组分透皮吸收率高的原因之一。后期实验需对P1组分进行进一步纯化,去除游离氨基酸后再进行透皮实验。
| [1] |
杨耀芳, 杨翊雯, 王赛前, 等. 土鳖虫口服液镇痛、活血化瘀与红细胞免疫研究[J]. 中成药, 2003, 25(6): 496-498. |
| [2] |
卫永琪. 麻黄连翘赤小豆汤加虫类药物治疗黄褐斑23例[J]. 中药药理与临床, 2006, 22(z1): 178. |
| [3] |
付英杰, 田景振, 郭之平. 土鳖虫化学成分制取方法及药理作用研究概况[J]. 食品与药品, 2005, 7(4A): 28-30. |
| [4] |
黄镇林. 土鳖虫胃仿生酶解物纯化分离及其物质基础研究[D]. 北京: 北京中医药大学, 2014.
|
| [5] |
刘长龙. 猪皮促创面愈合活性肽的制备分离及鉴定研究[D]. 济南: 山东中医药大学, 2013.
|
| [6] |
王少平, 曾以旺, 陈燕瑞, 等. DA-201C型大孔树脂对土鳖虫酶解液的除盐工艺考察[J]. 中国实验方剂学杂志, 2014, 20(22): 9-11. |
| [7] |
王英姿, 任天池, 肖永庆. 不同透皮促进剂对高乌甲素凝胶体外透皮吸收的影响[J]. 中国中药杂志, 2005, 30(9): 665-668. |
| [8] |
宋西卫, 王颖, 刘志东, 等. 不同促渗剂对灯盏花素离体鼠皮透过行为影响[J]. 辽宁中医杂志, 2011(4): 750-752. |
| [9] |
李骄. 玄丹巴布剂透皮吸收的研究[D]. 沈阳: 辽宁中医药大学, 2007.
|
| [10] |
夏晓静, 钦富华. 扇贝多肽脂质体凝胶的制备及体外透皮研究[J]. 药学与临床研究, 2013, 21(6): 618-621. |
| [11] |
杨耀芳, 杨翊雯, 王赛前, 等. 土鳖虫口服液镇痛、活血化瘀与红细胞免疫研究[J]. 中成药, 2003, 25(6): 496-498. |
| [12] |
白振丽, 陈宝元, 王红, 等. 透皮吸收促渗剂的研究现状及金黄膏透皮机制的研究进展[J]. 现代中西医结合杂志, 2006, 15(20): 2877-2879. DOI:10.3969/j.issn.1008-8849.2006.20.126 |
 2018, Vol. 37
2018, Vol. 37