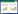文章信息
- 姜月蓬, 刘建超, 李之豪, 胡慧君, 赵志成
- JIANG Yuepeng, LIU Jianchao, LI Zhihao, HU Huijun, ZHAO Zhicheng
- 加味黄连温胆汤对痰热互结型代谢综合征的临床疗效观察
- Huanglian Wendan decoction on phlegm heat metabolic syndrome clinical curative effect observation
- 天津中医药大学学报, 2018, 37(4): 287-291
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(4): 287-291
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.04.06
-
文章历史
收稿日期: 2018-02-25
2. 黑龙江中医药大学附属第一医院, 哈尔滨 150040
2. The First Affiliated Hospital of Heilongjiang University of Tradition Chinese Medicine, Harbin 1500400, China
代谢综合征(MS)是由包括遗传和环境在内的多种因素引起的以肥胖、糖脂代谢紊乱以及血压升高等聚集发病、严重危害机体健康的临床征候群,以胰岛素抵抗(IR)、中心性肥胖等多种内分泌代谢障碍为主要临床表现[1]。与无MS的患者相比,患有MS的患者死于心血管疾病、中风、血管功能障碍和全因死亡率的风险增高[2-3]。当今,随着生活水准的不断提高,MS的发病率已达到25.9%[4],严重威胁着人类的健康。目前,对于代谢综合征的治疗现代医学主张控制饮食、适量运动,并根据患者的临床表现给予相应的对症治疗,然而相关西药的疗效、作用机理及其不良反应尚存在诸多争议。近年来,中医药治疗MS的优势逐渐显现并受到医学界的广泛关注。根据长期防治MS的临床经验和历代文献的整理总结,代谢综合征关键病机为脾虚湿盛、痰热互结,在治疗方面主张以健脾祛湿、化痰清热为基本法则,临床尤喜以加味黄连温胆汤治疗MS,取得了显著的临床疗效。本研究进一步探讨加味黄连温胆汤对MS患者中医证候、血糖、血脂、炎症因子的影响,现将研究结果总结如下。
1 资料与方法 1.1 诊断标准 1.1.1 西医诊断标准代谢综合征诊断标准参照《中国2型糖尿病防治指南(2013年版)》[5]中建议的MS诊断标准制定。
1.1.2 中医辨证标准依据《中药新药临床研究指导原则》[6]中高血压病、高脂血症、糖尿病中医分型属痰热互结证。主症为体丰、周身困顿、眩晕、胸腹胀闷、呕吐痰涎;次症为心悸不寐,口淡纳少,小便黄赤,大便黏腻,舌红苔黄腻,脉滑而数。
1.2 纳入和排除标准1)纳入标准:符合上述西医诊断标准与中医辨证标准;性别不限;知情同意,自愿参与本试验,能够定期复查、配合治疗者。2)排除标准:年龄<18岁或年龄>75岁;近1个月内出现急性糖尿病并发症者;合并急性感染者;伴有严重的心、肝、肾原发病者;妊娠或哺乳期妇女;急性冠脉综合征、急性脑卒中者;近2个月内服用过与本研究药物同类或具有拮抗作用的药物者。
1.3 一般资料纳入2017年1月-2017年10月在黑龙江中医药大学附属第一医院住院的患者,共计48例,采用随机数字表将受试者随机分为对照组与治疗组,每组各24例。
2 治疗方法基础治疗:所有受试者均接受健康教育,采用低盐低脂糖尿病饮食,戒除烟酒,每日有氧运动1 h以上。对照组:在基础治疗的同时服用盐酸二甲双胍(中美上海施贵宝制药有限公司),每次500 mg,每日3次,疗程为3周。治疗组:在对照组基础上合用加味黄连温胆汤治疗,药物组成(黄连10 g,茯苓20 g,半夏15 g,陈皮15 g,竹茹10 g,佩兰10 g,葛根15 g,甘草10 g)。本药由黑龙江中医药大学附属第一医院制剂室熬制,每次服用150 mL,早晚各1次,治疗周期为3周。两组病人分别在治疗前后测量以下指标。
3 观察项目及方法 3.1 主要临床症状积分按无、轻、中、重4级进行症状积分1)无症状(0分);2)轻(1分):稍有感觉或偶尔出现;3)中(2分):有症状,经常存在,但可以忍受;4)重(3分):症状严重,难以忍受,影响工作及生活。
3.2 形体学指标BMI、WHR。BMI:测取体质量(W)和身高(h),BMI(kg/m2)=W/h2,WHR:腰围/臀围。
3.3 血压统一测量患者右上臂,平卧位,且要求病人保持静息状态5 min以上,每周检测1次。
3.4 糖代谢相关指标测定FPG、2h PG、糖化血红蛋白(Hb Alc)、FINS、HOMA-IR,治疗前后各测1次。用稳态评估法评价胰岛素抵抗,HOMA-IR=(FPGXFINS)/22.5。
3.5 血脂TG、TC、LDL-C、HDL-C,治疗前后各测1次。
3.6 炎症因子IL-6、L-10,采用酶免法测定,治疗前后各测1次。
3.7 安全性评价血常规,尿常规,心电图,肝功能,肾功能,详细观察并记录所有受试者的不良事件发生情况,评估治疗的安全性。
4 疗效判定标准由于目前MS尚缺乏统一的疗效评判标准,遂本试验依照《中药新药治疗糖尿病的临床研究指导原则》中有关糖尿病疗效判定标准。中医证候疗效判定标准:1)显效:中医证候、体征明显改善,症状积分减少70%以上;2)有效:中医证候、体征有所改善,症状积分减少30%;3)无效:中医证候、体征均无明显缓解,甚或加重,症状积分减少不足30%。判定公式(尼莫地平法)=[(治疗前积分-治疗后积分)÷治疗前积分]×100%。
5 统计学方法采用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示,计量资料比较前进行正态性及方差齐性检验,若符合正态分布及方差齐性则采用t检验。不符合,则采用秩和检验,计数资料以百分率表示,采用χ2检验,以P<0.05为差异有统计学意义。
6 结果 6.1 基线资料两组患者治疗前的年龄、病程等资料比较,差异无统计学意义(P>0.05),具有可比性。见表 1。
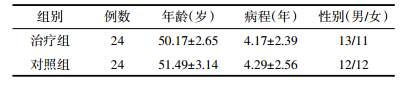
见表 2。
两组患者治疗后中医证候疗效比较,治疗组总有效率87.5%,对照组总有效率62.5%,差异有统计学意义(P<0.05),治疗组中医证候疗效优于对照组。
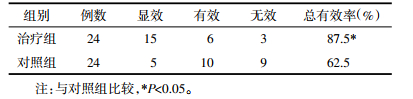
6.3 两组治疗前后形体学检测结果见表 3。
两组治疗前各项形体学指标比较,差异无统计学意义(P>0.05);与对照组比较,治疗后治疗组BMI、WHR均明显降低(P<0.05),差异有统计学意义。
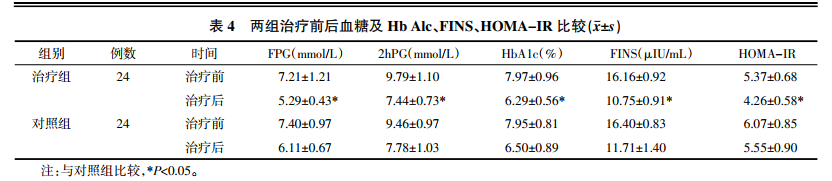
6.4 治疗前后FPG、2 h PG及Hb Alc、FINS、HOMA-IR水平比见表 4。
治疗前治疗组与对照组各项血糖相关指标比较,差异无统计学意义(P>0.05);治疗后治疗组FPG、2hPG、Hb A1c、FINS、HOMA-IR水平较对照组明显降低(P<0.05),差异有统计学意义。
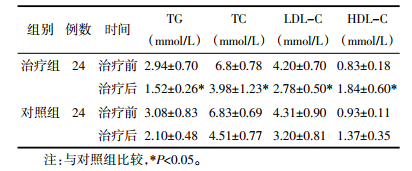
6.5 TG、TC、LDL-C、HDL-C情况比较见表 5。
两组治疗前脂质代谢水平比较,差异无统计学意义(P>0.05);与对照组比较,治疗后治疗组TG、TC、LDL-C水平明显降低,HDL-C水平明显升高(P<0.05),差异有统计学意义。
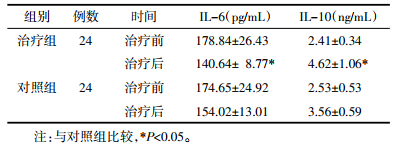
6.6 炎症因子IL-6、IL-10治疗前后水平比较见表 6。
两组治疗前炎性因子IL-6、IL-10浓度比较,差异无统计学意义(P>0.05);治疗后治疗组IL-6、IL-10水平明显低于对照组(P<0.05),差异有统计学意义。
7 安全性评价两组试验过程中均未出现不良事件。两组治疗前后均做了血常规、尿常规、心电图及肝、肾功能检查,治疗后未出现异常,表明本试验所用方剂无不良反应。
8 讨论现代医学研究表明,超重、体循环动脉压升高、糖脂代谢异常、慢性炎症应激和IR是代谢综合征的危险因素[7],而IR是代谢综合征发生的中心环节,其发生机制是由脂肪细胞功能紊乱,分泌过量炎性因子,引发炎症反应所致[8-10]。HOMA-IR最早在1985年由英国牛津大学Turner的科研小组首先提出[11],当今已在临床普及,成为评价胰岛素灵敏性、胰岛素抵抗程度的常用指标。IL-6与IL-10作为炎症因子,共同反映了IR的水平[12]。IL-6是一种促炎物质,在炎症反应中产生重要影响[13]。在代谢综合征中,脂肪细胞功能障碍经常出现,这导致了脂肪组织中IL-6和其他促炎性细胞因子分泌增加[14],IL-6可降低与胰岛素结合的分子底物的酪氨酸磷酸化,导致胰岛素信号通路障碍,促发胰素抵抗[15-16]。有研究表示[17-18],IL-6与MS及其各成分密切相关,是MS进展的一个关键因子,是生物标记物的一个很好的补充。IL-10是主要的抗炎细胞因子,在调节全身炎症反应中起作用,其功能之一是促进炎症反应后的正常组织重塑。研究发现[19],IL-10水平与TC、LDL-C、血糖和糖化血红蛋白呈负相关,与HDL水平呈正向关联,这说明如果IL-10水平低,MS的患病风险可能更高。遂本文着重观察FINS、HOMA-IR、IL-6及IL-10等相关指标。
代谢综合征虽属现代病名,但据其口渴引饮、乏力、眩晕、腹胀等典型症状可归属于古代文献中所记载的“脾瘅”、“消瘅”、“消渴”等范畴。古代医学典籍中以脾虚论脾瘅,《灵枢·本脏》曰:“脾脆则善病消瘅易伤”。《医学衷中参西录》[20]中记载:“消渴一证,古有上、中、下之分,其证皆起于中焦而极于上、下……因中焦病,而累及于脾也”,从而认为中焦脾胃是消渴发病的关键。脾虚失于散精,津液无从上达于肺,故口干欲饮;脾为胃行其津液,热灼胃液,故而口干喜饮,多食善饥;脾不能转输水谷精微,直趋于下,入于溲中,加之肾阴不足,开门太过,肾失封藏,故小便频而甘。当今中医学者认为脾虚可导致IR,并提出“脾胰同源”学说[21],脾主运化充养五脏六腑、四肢百骸,与胰岛素促进机体新陈代谢,维持机体生长发育的功能相似,当脾不散精,精微物质不能灌溉于周身,而是聚为“糖浊”,表现为血糖升高,并伴随高胰岛素血症。痰浊是IR进展的病理结果,脾气虚衰,失于散精,则津液输布代谢障碍,水液不化,聚而成湿,停而为痰,《医宗必读·痰饮》云:“脾土虚弱,清者难升,浊者难降,留中滞膈,瘀而成痰。痰湿又可进一步困遏脾土,使脾气不升,气机不畅,日久郁而化热。”正如《素问·奇病论》所云:“此肥美之所发也……肥者令人内热……转为消渴。”
针对MS的中医病机,临证时喜用加味黄连温胆汤,疗效斐然。黄连温胆汤源自清代的《六因条辩》,方中包括黄连、半夏、陈皮、茯苓、枳实、竹茹、甘草等。在此基础上精心化裁,去掉破气的枳实,佐之以芳香化浊之佩兰、升阳清热之葛根,称为加味黄连温胆汤。方中半夏辛温,下气消痰,除痞开结;黄连苦寒,清热燥湿、除脾胃湿热,两药配伍以达辛开苦降之效,畅达通利中焦之功;陈皮苦温助半夏燥湿化痰,痰化则气自达;半夏助陈皮降泻逆气,气顺则湿自消,三药共为君药。茯苓健脾利水渗湿化饮,竹茹清热化痰、除烦止呕,葛根甘凉清热,入脾胃经鼓舞脾胃之气、养阴生津,半夏“降逆下气”、葛根“升举清阳”,一升一降以助气机调畅,津液输布;佩兰芳香醒脾,化浊健运,《素问·奇病论》曰:“消渴,治之以兰,除陈气也”,此“兰”当属佩兰,以上4味中药共为臣药;甘草解毒化痰,调和诸药,为方中使药,全方共奏清热燥湿、健脾化痰之效。现代药理学研究证实,黄连具有改善胰岛素抵抗的作用[22],其机制可能与降低脂肪细胞炎性因子分泌有关[23];半夏中含有生物碱等有效成分,具有降血脂等作用[24];茯苓主要成分茯苓多糖具有降血糖和抗脂质过氧化作用[25];葛根有效成分葛根素具有降糖、降血脂,改善IR的作用[26],在药理机制上十分切中MS的病理机制。
本研究结果证实,治疗组、对照组中医征候有效率分别为87.5%、62.5%,治疗组临床疗效优于对照组;治疗组BMI、WHR、血糖、胰岛素、HOMA-IR及血脂水平、炎症因子的改善均优于对照组。此临床观察的结果显示,加味黄连温胆汤联合二甲双胍治疗MS效果突出,不良反应较少,在临床的开发及使用中前景开阔。
| [1] |
Christian KR, Andrea L. Metabolic Syndrome and Insulin Resistance:Underlying Causes and Modification by Exercise Training[J]. Compr Physiol, 2013, 3(1): 1-58. |
| [2] |
Mottillo S, Filion KB, Genest J, et al. The metabolic syndrome and cardiovascular risk a systematic review and meta-analysis[J]. J Am Coll Cardiol, 2010, 56: 1113-1132. DOI:10.1016/j.jacc.2010.05.034 |
| [3] |
Ford ES. The metabolic syndrome and mortality from cardiovascular disease and all-causes:findings from the National Health and Nutrition Examination Survey Ⅱ Mortality Study[J]. Atherosclerosis, 2004, 173: 309-314. |
| [4] |
徐少勇. 中国人群代谢综合征患病率及其相关问题的流行病学研究[D]. 陕西: 第四军医大学: 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D01104858
|
| [5] |
中华医学会糖尿病学分会. 2013年中国2型糖尿病防治指南[J]. 中华糖尿病杂志, 2014, 6(7): 451-460. |
| [6] |
郑筱萸. 中药新药临床研究指导原则(试行)[S]. 北京: 中国医药科技出版社, 2002: 85-89, 233-237.
|
| [7] |
Haffner SM. The metabolic syndrome:inflammation, diabetes mellitus, and cardiovascular disease[J]. Am J Cardiol, 2006, 97(2): 11-13. |
| [8] |
Schroder K, Tschopp J. The inflammasomes[J]. Cell, 2010, 140(6): 821-832. DOI:10.1016/j.cell.2010.01.040 |
| [9] |
Alberti KG, Eckel RH, Grundy SM, et al. Harmonizing the metabolic syndrome:a joint interim statement of the international diabetes federation task force on epidemiology and prevention; national heart, lung, and blood institute; american heart association; world heart federation; international atherosclerosis society; and international association for the study of obesity[J]. Circulation, 2009, 120(16): 1640-1645. DOI:10.1161/CIRCULATIONAHA.109.192644 |
| [10] |
Després JP. Abdominal obesity and cardiovascular disease:is inflammation the missing link[J]. Can J Cardiol, 2012, 28(6): 642-652. DOI:10.1016/j.cjca.2012.06.004 |
| [11] |
Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concention inman[J]. Diabetologia, 1985, 58: 412-419. |
| [12] |
Jinkwan K, Dae WY, Seung KL. Concurrent presence of inflammation and obstructive sleep apnea exacerbates the risk of metabolic syndrome:A KoGES 6-year follow-up study[J]. Medicine (Baltimore), 2017, 96(7): e4488. DOI:10.1097/MD.0000000000004488 |
| [13] |
Aroor AR, McKarns S, Demarco VG. Maladaptive immune and inflammatory pathways lead to cardiovascular insulin resistance[J]. Metabolism, 2013, 62(11): 1543-1552. DOI:10.1016/j.metabol.2013.07.001 |
| [14] |
Weiss TW, Arnesen H, Seljeflot I. Components of the interleukin-6 transsignalling system are associated with the metabolic syndrome, endothelial dysfunction and arterial stiffness[J]. Metabolism, 2013, 62(7): 1008-1013. DOI:10.1016/j.metabol.2013.01.019 |
| [15] |
陈晓蕾, 周弘. 代谢综含征发病机制研究进展[J]. 医学综述, 2010, 16(3): 431-433. |
| [16] |
阮丹杰, 王伟. 炎性因子与胰素抵抗的研究进展[J]. 医学综述, 2009, 15(4): 508-511. |
| [17] |
Krithika S, Andrew F, Haresh V. Systematic Review of Metabolic Syndrome Biomarkers:A Panel for Early Detection, Management, and Risk Stratification in the West Virginian Population[J]. Int J Med Sci, 2016, 13(1): 25-38. DOI:10.7150/ijms.13800 |
| [18] |
Mukumoto H, Takahashi Y, Ando M, et al. Expression profile-dependent improvement of insulin sensitivity by gene delivery of interleukin-6 in a mouse model of type Ⅱ diabete[J]. Mol Pharm, 2013, 10(10): 3812-3821. DOI:10.1021/mp400288e |
| [19] |
van Exel E, Gussekloo J, de Craen AJ. Low production capacity of interleukin-10 associates with the metabolic syndrome and type 2 diabetes:the Leiden 85-Plus Study[J]. Diabetes, 2002, 51(4): 1088-1092. DOI:10.2337/diabetes.51.4.1088 |
| [20] |
张锡纯. 重订医学衷中参西录(上册)[M]. 北京: 人民卫生出版社, 2006, 43-44.
|
| [21] |
晁俊, 刘桠, 钟文. 基于"脾胰同源"理论从脾论治糖尿病[J]. 中医杂志, 2017, 58(17): 1458-1461. |
| [22] |
李佳川, 孟宪丽, 范昕建, 等. 黄连改善胰岛素抵抗药效物质基础研究[J]. 中国中药杂志, 2010, 35(14): 1855-1858. |
| [23] |
李阳. 黄连、生地及其配伍对胰岛素抵抗脂肪细胞TNF-α、IL-1β与IL-6分泌及mRNA表达的影响[D]. 上海: 华中科技大学, 2013: 17-29. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D409977
|
| [24] |
宁娜. 半夏药理作用的研究进展[J]. 铜仁职业技术学院学术论坛(自然科学版), 2015, 13(2): 41-43. |
| [25] |
郑彩云. 茯苓多糖抗糖尿病作用的实验研究[J]. 中国医疗前沿, 2010, 5(14): 12-13. |
| [26] |
赵淑芹. 葛根的药理作用与临床应用[J]. 中国医药科学, 2013, 3(2): 40-41, 43. |
 2018, Vol. 37
2018, Vol. 37