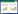文章信息
- 骆莹莹, 蒲位凌, 郭傲玮, 白茹玉, 史红, 周昆, 高秀梅, 孙力康
- LUO Yingying, PU Weiling, GUO Aowei, BAI Ruyu, SHI Hong, ZHOU Kun, GAO Xiumei, SUN Likang
- 血必净注射液对急性胰腺炎小鼠p38MAPK信号通路的影响
- Effects of Xuebijing Injection acute pancreatic by p38MAPK pathwaysin mouse model
- 天津中医药大学学报, 2018, 37(4): 318-322
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(4): 318-322
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.04.14
-
文章历史
收稿日期: 2018-03-05
急性胰腺炎(AP)是一种常见的临床急腹症之一,病程变化多变,其近年来发病率有增多的趋势。其炎症过程是由于胰腺内的胰蛋白酶被激活,导致腺泡细胞自身消化,从而使胰腺组织出现水肿,充血,出血甚至坏死等现象,在高科技发展的今天仍是死亡率高的常见急腹症[1]。
血必净注射液是在中医学理论指导下,以古方血府逐瘀汤为基础精炼而出的静脉注射剂,具有化瘀解毒的功效。有研究证实,血必净注射液在体内有拮抗内毒素、抑制炎症介质、改善胰腺微循环等药理作用[2]。目前,临床上使用血必净注射液治疗胰腺炎[3]。现研究表明血必净注射液通过抑制炎症因子肿瘤坏死因子-α(TNF-α),白介素-1β(IL-1β)的释放对胰腺炎产生治疗作用[4]。故本研究对血必净注射液治疗AP小鼠的机制进行探讨。
1 材料与方法 1.1 实验药品、试剂与仪器雨蛙素购买于上海翊圣(LOT:C07721);血必净注射液购买于天津红日药业股份有限公司(国药准字Z20040033);淀粉酶试剂盒(C016)购买于南京建成生物研究所;MCP-1 ELISA试剂盒购买于Millipore公司(Cat:MCYTOMAG-70K);兔抗小鼠多克隆抗体JNK(9252S),兔抗小鼠单克隆抗体p-JNK(81E11),兔抗小鼠单克隆抗体ERK1/2(137F5),兔抗小鼠单克隆抗体p-ERK1/2(197G2),兔抗小鼠多克隆抗体p38(9212S),兔抗小鼠单克隆抗体p-p38(12F8)均购买于CST;辣根酶lgG标记山羊抗兔(H+L)购买于中衫金桥(ZB-2301)。BCA蛋白定量试剂盒(23227)购买于Thermo Fisher Scientific;QuickBlockTMWestern封闭液(P0252)购买于碧云天生物技术公司;RIPAl组织裂解液(R0020)购买于北京索莱宝公司。4%多聚甲醛购买于天津康科德化学试剂公司;酶标仪(Enspire)购买于美国PerkinElmer。离心机(Micro17)和离心机(Micro 21 R)购买于Thermo Fisher Scientific。多功能成像分析系统(MP5000)购买于BIO-RAD公司。
1.2 动物分组与造模健康雄性小鼠C57BL/6J 15只(许可证号:SCXK京-2014-0004),8~10周,体质量20~23 g,SPF级,购买于北京华阜康生物科技股份有限公司。以上动物均饲养于中国医学科学院放射医学研究所。随机分为3组,随机分成3组(n=5):对照组、AP模型组和血必净治疗组,且每组单笼饲养,实验过程中正常饮水和饮食,室温饲养。AP模型组和血必净治疗组均腹腔注射雨蛙素(50 μg/kg,每天5次,间隔1 h,注射3 d),血必净治疗组在每天注射第5次雨蛙素30 min后给予尾静脉注射血必净注射液(13 mL/kg),且每天注射1次。急性胰腺炎模型组给予尾静脉注射同等剂量的生理盐水。
1.3 标本采集与检测造模结束24 h后,小鼠摘眼球取血至动物死亡,全血置于37 ℃水浴静置1 h,使用离心机(Micro 17)转速为3 000 r/min,10 min后取血清,存放于-20 ℃冰箱留用。完整摘除胰腺,将胰腺一分为二,靠近脾部固定于4%多聚甲醛中,剩余部分放于冻存管中迅速置于液氮中,转移到-80 ℃冰箱长期冻存。
1.3.1 胰腺组织的病理学变化固定于4%多聚甲醛中胰腺,经脱水、石蜡包埋、切片、苏木精-伊红染色法(HE),观察胰腺组织的病理变化。
1.3.2 血清淀粉酶的检测采用碘与淀粉比色法,测定淀粉酶的活性。
1.3.3 ELISA法检测胰腺组织中MCP-1表达将-80 ℃冰箱中的胰腺组织取出置于盛有少量液氮研钵中,将组织研碎,加入RIPAl组织裂解液,混匀,使用离心机转速为12 000 g,10 min,4 ℃,离心取上清。采用BCA蛋白定量试剂盒将蛋白定量为2 μg/μL,用磷酸盐缓冲液(PBS)稀释至总体积为50 μL。按照ELISA试剂盒方法测定胰腺组织中MCP-1表达。
1.3.4 Western blot法检测胰腺组织中MAPK信号通路中相关蛋白表达提取方法同1.3.3,蛋白定量的浓度为4 μg/μL。按照30 μg蛋白样本/孔进行凝胶电泳,结束后转移至用甲醇浸泡10 min的PVDF膜中,再全湿转1 h;QuickBlockTM Western封闭液室温封闭PVDF膜20 min,山羊抗兔lgG Ⅱ抗室温孵育1.5 h,洗膜,加ELC发光剂在多功能成像分析系统进行曝光,并且对目的条带进行灰度分析。
1.4 统计学方法采用SPSS软件17.0进行数据处理,所有数值均以均数±标准误(x±SD)来表示。两组之间的比较采用单因素方差分析(one-way ANOVA),P<0.05差异有统计学意义。
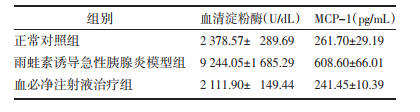
2 实验结果 2.1 胰腺组织病理学改变正常对照组小鼠胰腺组织HE染色在光镜下未见病理学改变;AP模型组胰腺组织中腺泡细胞有大片空泡形成,水肿且细胞间距变大,炎细胞浸润明显,未见腺泡细胞坏死;血必净治疗组胰腺组织中可见有极少空泡形成,与模型组相比水肿较轻和细胞间距明显减小,且均未炎细胞浸润及坏死现象;胰腺组织损伤明显改善。见图 1。
|
| 图 1 胰腺组织病理学改变(HE×200) |
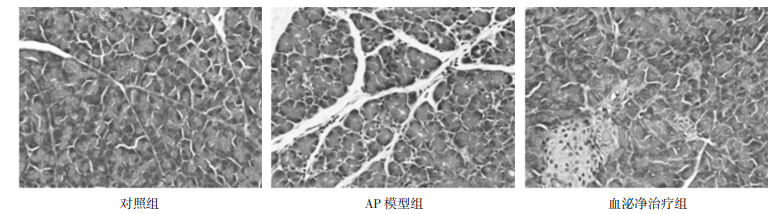
AP模型组血清淀粉酶的活性为(8 805.72±592.91)U/dL;与对照组小鼠(2 378.57±129.55)U/dL相比,差异均有统计学意义(P<0.05);而血必净治疗组血清淀粉酶的活性为(2 024.43±465.86)U/dL,与AP模型组相比显著下降(P<0.05)。见图 2。
|
| C:对照组;M:AP模型组;XBJ:血必净治疗组。与对照组相比,#P<0.05;模型组与血必净治疗组相比,*P<0.05。 图 2 小鼠血清淀粉酶的变化 |
与对照组相比(9.59±0.49)pg/mL,AP模型组(164.58±68.33)pg/mL胰腺组织中MCP-1表达明显升高,差异具有统计学差异(P<0.05);而血必净治疗组(5.95±1.46)pg/mL MCP-1表达显著降低,与AP模型组相比有统计学意义(P<0.05)。见图 3。
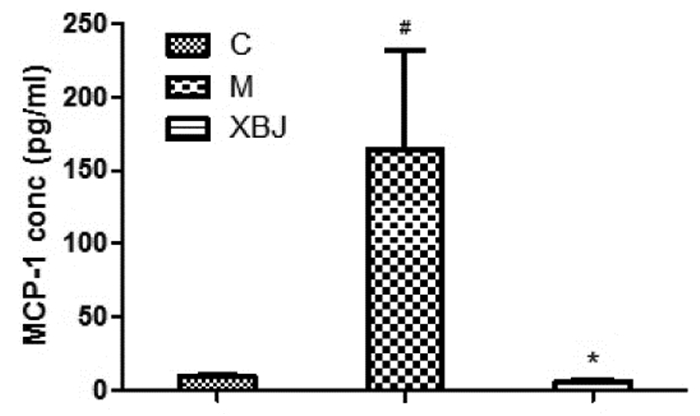
|
| C:对照组;M:AP模型组;XBJ:血必净治疗组。与对照组相比,#P<0.05;与血必净治疗组相比,*P<0.05 图 3 小鼠胰腺组织MCP-1表达变化 |
对照组、AP模型组和血必净治疗组中ERK1/2 MAPK与p-ERK1/2均未有明显改变,且不具有统计学差异(P>0.05)见图 4(A、B)。与对照组相比,AP模型组中p-p38蛋白有明显上调具有统计学差异(P<0.05);而与血必净治疗组相比蛋白p-p38有显著下调的趋势(P<0.05)。见图 4(C)。
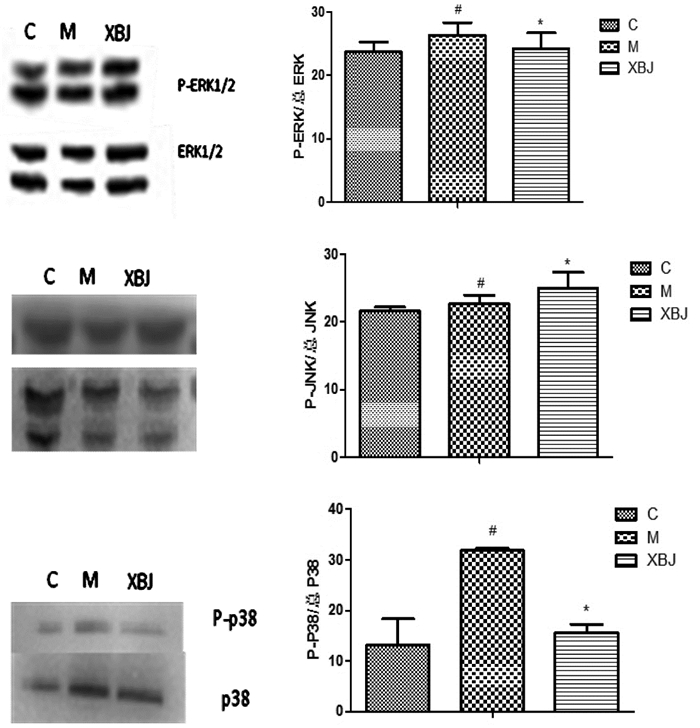
|
| C:对照组;M:AP模型组;XBJ:血必净注射液治疗组。图A、B:与对照组相比,#P>0.05;与AP模型组*P>0.05。图C:与对照组,#P<0.05;与AP模型组相比*P<0.05 图 4 MAPK信号通路中相关蛋白的表达 |
AP作为一种临床危重症,在临床上表现为腹痛、腹胀,并常伴有并发症,其特点为病势发展快、致死率高。近年来随着人们生活水平的提高以及饮食习惯越来越不规律,其发病率逐年攀升[5]。
AP是由胰腺内胰酶在腺泡细胞内被激活,引起胰腺组织的自我消化,炎性介质和自由基大量释放,严重损伤胰腺组织,从而导致胰腺微循环功能障碍,严重时可致使全身炎症反应综合征(SISRS)和多脏器功能不全(MODS)等病症[6]。临床上AP患者多以对症治疗为主,病情严重者采用手术、微创等干预措施[7]。近年来,临床AP治疗中常在西医常规治疗基础上使用血必净注射,效果显著[3, 8]。血必净注射液是根据“三证三法”的辨证原则和“菌、毒、炎”理论,在古方血府逐瘀汤的基础上研制的静脉注射制剂,主要由赤芍、川芎、丹参、红花、当归等5种中药组成,其药效为活血化瘀,清热解毒[9]。适用于因感染引起的全身炎症综合征,也可用于配合治疗多器官功能失常综合征的脏器功能受损期。方中芍药苷[10]、川芎嗪[11]、隐丹参酮与丹参酮ⅡA[12]、阿魏酸[13]和红花黄色素[14]是其主要有效成分,均发挥抗炎、抗氧化、抑制氧自由基等药理作用。研究表明,血必净注射液具有降低炎症反应、抗氧化应激以及调节免疫功能等药理作用[15]。因此,本实验对血必净注射液治疗雨蛙素诱导的AP小鼠的作用机制进行探讨。
本研究采用雨蛙素高剂量多次腹腔注射复制出小鼠AP模型,其模型组小鼠胰腺组织中腺泡细胞出现空泡现象即早期的腺泡细胞水肿,腺泡细胞间隙变大为较重水肿现象,更为严重的现象是细胞间质有炎细胞浸润并伴有出血现象。在本研究中,胰腺组织HE染色结果提示,AP模型组胰腺组织腺泡细胞水肿、细胞间距变大,炎细胞浸润较多;血必净治疗组胰腺组织细胞水肿较轻、炎细胞浸润较少(图 1),证实血必净注射液可以修复雨蛙素诱导的AP小鼠胰腺组织损伤。
AP临床诊断标准为血清淀粉酶水平。在本研究中,与对照组相比,AP模型组血清淀粉酶的活性显著升高,表明小鼠腺泡细胞内酶原被激活,引起腺泡细胞受损,从而使小鼠表现为AP。与AP模型组相比,血必净治疗组血清淀粉酶活性显著降低,提示血必净注射液对小鼠AP有治疗作用(图 2)。相关动物研究提示,MCP-1是由单核巨噬细胞、内皮细胞和成纤维细胞合成的碱性蛋白[16],在受损的组织中对巨噬细胞聚集有着重要作用[17],且作为炎症级联反应的始动因子,是早期AP重要炎症介质之一。本研究结果显示,同对照组相比,AP模型组胰腺组织MCP-1蛋白水平显著升高,提示在雨蛙素诱导的AP小鼠中,腺泡细胞内炎症级联反应已被激活。与AP模型组相比,血必净治疗组中MCP-1表达明显降低(图 3),提示血必净注射液对AP的早期炎症反应有明显抑制作用。研究显示,在胰腺腺泡细胞中核转录因子κB(NF-κB)的亚单位p65是p38MAPK的靶点[18],p38MAPK在AP小鼠胰腺腺泡细胞炎症反应中起调节作用[19]。为进一步阐明血必净注射液保护胰腺组织的机制,本文针对丝裂原活化蛋白激酶信号传导通路进行研究,结果显示,正常对照组、AP模型组和血必净治疗组中蛋白水平ERK1/2、JNK无显著性差异,因此证实血必净注射液对雨蛙素诱导的AP腺泡细胞在MAPK信号通路ERK1/2、JNK蛋白无调节作用;而AP模型组,p-p38/p38明显升高,表明雨蛙素诱导的AP模型激活了p38MAPK信号通路,血必净治疗组p-p38/p38显著下调,说明血必净注射治疗雨蛙素诱导的AP可能是通过抑制p38MAPK蛋白表达,从而阻断炎症反应,并使胰腺损伤组织得到修复(图 4 A、B、C)。
综上所述,本研究表明血必净注射液对雨蛙素诱导AP作用机制可能是抑制p38MAPK信号通路,从而调节下游蛋白MCP-1等趋化因子而达到保护小鼠AP的作用。
| [1] |
Shah AU, Sarwar A, Orabi AI, et al. Protease activation during in vivo pancreatitis is dependent on calcineurin activation[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(5): G967-73. DOI:10.1152/ajpgi.00181.2009 |
| [2] |
王莹, 高丽媛, 王秀英. 血必净注射液对急性胰腺炎治疗的临床研究及影响机制[J]. 中国伤残医学, 2013, 21(2): 96-97. |
| [3] |
郑蕊, 张莉, 田然, 等. 血必净注射液治疗重症急性胰腺炎的Meta分析[J]. 中华危重病急救医学, 2015, 27(8): 682-6. |
| [4] |
牛万成, 蒋孔斐, 张召辉, 等. 血必净对大鼠急性胰腺炎治疗作用的机制探讨[J]. 临床军医杂志, 2011, 39(5): 815-817. |
| [5] |
王助衡, 张静, 周冠华. 急性胰腺炎的治疗进展[J]. 医学综述, 2017, 23(1): 91-4+9. |
| [6] |
杜微, 王红, 张淑文, 等. 全身炎症反应综合征与急性胰腺炎病情严重程度关系的探讨[J]. 中国危重病急救医学, 2005, 17(5): 279-81. |
| [7] |
孙备, 苏维宏. 2013年美国胃肠病学会《急性胰腺炎治疗指南》解读[J]. 中国实用外科杂志, 2013, 33(9): 768-72. |
| [8] |
董改英, 黄晓静. 血必净注射液治疗急性胰腺炎的Meta分析[J]. 天津药学, 2011, 23(4): 30-3. |
| [9] |
曹书华, 王今达, 李银平. 从"菌毒并治"到"四证四法"——关于中西医结合治疗多器官功能障碍综合征辨证思路的深入与完善[J]. 中国危重病急救医学, 2005, 17(11): 7-9. |
| [10] |
陆小华, 马骁, 王建, 等. 赤芍的化学成分和药理作用研究进展[J]. 中草药, 2015, 46(4): 595-602. |
| [11] |
金玉青, 洪远林, 李建蕊, 等. 川芎的化学成分及药理作用研究进展[J]. 中药与临床, 2013, 4(3): 44-8. |
| [12] |
赵娜, 郭治昕, 赵雪, 等. 丹参的化学成分与药理作用[J]. 国外医药(植物药分册), 2007, 22(4): 155-60. |
| [13] |
董晴, 陈明苍. 当归化学成分及药理作用研究进展[J]. 亚太传统医药, 2016, 12(2): 32-4. |
| [14] |
施峰, 刘焱文. 红花的化学成分及药理研究进展[J]. 时珍国医国药, 2006, 17(9): 1666-7. |
| [15] |
王靓, 郑云辉. 血必净注射液药理研究进展[J]. 临床医药实践, 2016, 25(7): 542-4. |
| [16] |
张晓芹, 贾晓云, 史迎莉, 等. 灯盏花素通过抑制MCP-1的表达对L-精氨酸诱发重症急性胰腺炎小鼠的治疗作用研究[J]. 中国现代医学杂志, 2013, 23(35): 17-21. DOI:10.3969/j.issn.1005-8982.2013.35.004 |
| [17] |
Sun LK, Reding T, Bain M, et al. Prostaglandin E2 modulates TNF-alpha-induced MCP-1 synthesis in pancreatic acinar cells in a PKA-dependent manner[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 293(6): G1196-204. DOI:10.1152/ajpgi.00330.2007 |
| [18] |
Chen Z, Chen Y, Pan L, et al. Dachengqi Decoction Attenuates Inflammatory Response via Inhibiting HMGB1 Mediated NF-kappaB and P38 MAPK Signaling Pathways in Severe Acute Pancreatitis[J]. Cell Physiol Biochem, 2015, 37(4): 1379-1389. DOI:10.1159/000430403 |
| [19] |
Cao MH, Xu J, Cai HD, et al. p38 MAPK inhibition alleviates experimental acute pancreatitis in mice[J]. Hepatobiliary Pancreat Dis Int, 2015, 14(1): 101-106. DOI:10.1016/S1499-3872(15)60327-7 |
 2018, Vol. 37
2018, Vol. 37