文章信息
- 任红微, 石江伟, 高秀梅, 王彧
- REN Hongwei, SHI Jiangwei, GAO Xiumei, WANG Yu
- 何首乌致药物性肝损伤机制及致毒成分研究进展
- Progress on the liver toxicity mechanism and toxicity of ingredients induced by Polygonum multiflorum Thunb.
- 天津中医药大学学报, 2018, 37(5): 361-365
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(5): 361-365
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.05.03
-
文章历史
收稿日期: 2018-08-14
2. 天津中医药大学第一附属医院, 天津 300381
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China
何首乌系蓼科植物何首乌(polygonum multiflorum)的干燥块根。临床上,生何首乌主要用于治疗疮痈、瘰疠、风疹、肠燥便秘等病症;制何首乌用于治疗血虚,眩晕耳鸣,须发早白等虚症;何首乌作为中药饮片及中成药的组成成分在临床与民间都被广泛应用。近年来,由何首乌及含何首乌的制剂引起的不良反应也日益增多,引起广泛关注,主要表现为药物性肝损伤(DILI),文章综述何首乌及其所含化学成分致药物性肝损伤研究进展,为何首乌临床及制药提供参考。
1 何首乌提取物致固有型药物性肝损伤实验研究 1.1 何首乌致固有型DILI机制研究何首乌致固有型肝损伤的研究包括对生何首乌、经不同方式炮制后的制何首乌及生、制何首乌不同溶液提取物致肝损伤的研究,何首乌在动物水平表现出一定的肝损伤作用,但由于动物模型表现出的毒性不强,少见肝损伤生化指标的升高,目前关于何首乌致固有型DILI机制的研究也不够深入。
卫培峰等[1-3]发现小鼠灌胃制何首乌4周后,与空白对照组相比,血清谷丙转氨酶(ALT)、谷草转氨酶(AST)值无显著差异,但肝细胞凋亡率明显升高;分别采用清蒸及黑豆汁炮制的何首乌水煎液每日灌胃大鼠10 g/kg,3个月后,两组制首乌组大鼠肝细胞色素P450(CYP2E1)酶活性均升高,血清中肿瘤坏死因子-α(TNF-α)的含量明显升高。Li等[4]灌胃大鼠何首乌水提物20 g生药/kg 60 d后,ALT与AST未见明显改变,但肝脏CYP1A2和CYP2E1受到显著抑制,认为CYP1A2或CYP2E1基因多态性可能是何首乌在临床引起肝毒性的重要原因。
胡锡琴等[5-6]灌胃大鼠不同剂量的制首乌水煎液,3个月后发现小剂量组大鼠未见明显不良反应;大、中剂量组大鼠出现进食减少, 精神较差,体质量增长缓慢,在停药后诸症均减轻或消失;病理切片可见雌鼠肝脂肪变明显多而重于雄鼠, 各剂量组存在程度差异。王文静等[7]灌胃大鼠生何首乌、制何首乌30 g/kg,3个月后发现生何首乌组CYP450含量显著增高,肝微粒体蛋白显著下降,与空白对照组相比,制何首乌组大鼠CYP450酶与肝微粒体蛋白无显著差异,但血清ALP显著上升;生何首乌组大鼠肝脏CYP450酶明显升高,而制何首乌组无显著差异;提示生何首乌、制何首乌致大鼠肝脏物质代谢途径的机制不同。李浩等[8]给SD大鼠连续灌胃不同剂量的何首乌水提物7 d, 发现相较于空白对照组,1、10 g/kg何首乌水提物组明显抑制了大鼠肝脏mRNA的表达与CYP2E1活性。全正扬等[9]发现,灌胃何首乌水提物1 d后,大鼠血清中总胆红素(TBIL)水平较空白对照组升高;连续灌胃14 d后,大鼠血清中直接胆红素(DBIL)、间接胆红素(IBIL)、TBIL水平均较空白对照组显著升高。王涛等[10]用何首乌水提物60 g/kg灌胃大鼠28 d后,对大鼠胆汁成分有明显干扰作用,但不影响大鼠胆汁流量,这可能与损伤胆管上皮细胞和肝细胞有关;未见大鼠明显系统毒性,未引起大范围的肝脏损伤。
1.2 何首乌致固有型DILI成分研究何首乌化学成分复杂,主要成分包括蒽醌类、二苯乙烯苷类、酚类、黄酮类、磷脂类,二苯乙烯苷类和蒽醌类为何首乌两大主要成分[11],关于这两类成分致肝损伤的研究也较多。
1.2.1 蒽醌类致DILI研究何首乌中的所含蒽醌类物质主要有芦荟大黄素、大黄酸、大黄酚、大黄素-8-甲醚、w-羟基大黄素等[12],成分多且复杂,关于大黄酸及大黄素为何首乌致肝损伤物质的研究较多。
胆红素代谢过程中UDP-葡萄糖醛酸转移酶1A1(UGT1A1酶)可介导胆红素葡萄糖醛酸结合,可能导致肝损伤,汪祺等[13]发现大黄素对于UGT1A1酶有强抑制作用,而大黄酸几乎没有此作用,提示大黄素可能为何首乌中潜在致肝毒性成分。贾歌等[14]研究何首乌中大黄酸、大黄素、没食子酸对L-02细胞的影响, 结果各组均可见L-02细胞呈典型凋亡形态, 大黄素对L-02细胞凋亡的作用强于大黄酸和没食子酸。汪美汐等[15]用不同浓度的大黄素处理L-02细胞,随着剂量的增加可见明显的细胞损伤效应,细胞的存活率逐渐降低,呈时间和浓度依赖性;大黄素能明显提高CYP450各亚型mRNA表达,并可剂量依赖性诱导CYP1A1、CYP1B1的表达。
孙向红等[16]报道大黄素、大黄酸在高浓度、长时间作用下呈现出抑制细胞增殖的作用。卫培峰等[17]分别灌胃大鼠、小鼠予制何首乌、大黄酸、大黄素、大黄酚3个月后,发现血清中ALT、AST无明显变化;大鼠与小鼠灌胃大黄酚后均可见肝细胞凋亡率显著升高,制何首乌可导致大鼠肝细胞凋亡,大黄酚可能是其主要作用成分。吴双等[18]研究发现何首乌水提物主要成分大黄素-8-O-β-D-葡萄糖对大鼠肝微粒体CYP450多种亚型有抑制或促进作用。Bounda[19]等发现大黄酸可以剂量依赖性的诱导人正常肝细胞HL-7702细胞凋亡,使HL-7702细胞caspase3,caspase8和caspase9表达显著上调,线粒体膜电位显著上升,ROS清除剂NAC可以减轻大黄酸诱导的HL-7702细胞氧化损伤。这些结果表明大黄酸可以通过线粒体介导的信号通路加上氧化应激系统的参与诱导HL-7702细胞凋亡。
1.2.2 二苯乙烯苷类成分致DILI研究何首乌二苯乙烯苷类成分主要包括二苯乙烯苷(TSG),白藜芦醇,白藜芦醇苷。何首乌中二苯乙烯苷类物质被认为是何首乌发挥补益作用的主要物质,现代药理学关于何首乌抗衰老、乌发等的成分研究多集中于二苯乙烯苷类,但近年来也出现关于其致肝损伤的研究。
李娜[20]发现TSG对肝细胞增殖有不同程度的抑制作用,具体机制尚不清楚。Wu等[21]认为生首乌丙酮提取物的肝毒性可能与TSG的含量有关。Xu等[22]研究发现何首乌中TSG类物质2,3,4’,5-四羟基-2-O-β-d葡糖苷单独应用时没有肝毒性,但可以加剧对乙酰氨基酚引起的肝细胞损伤,其机制与增加小鼠肝脏中CYP2E1,CYP3A4和CYP1A2的表达和增加GSH的消耗有关。
1.2.3 鞣质类致DILI研究何首乌中鞣质类的主要成分是没食子酸,Chalasani等[23]研究发现,何首乌中没食子酸与何首乌70%总醇提物对肝细胞具有损伤作用,因此没食子酸可能为何首乌致DILI的主要成分。吴宇等[24]采用CCK-8细胞毒性筛选、UPLC-PAD含量测定及肝相关生化指标测定等方法研究发现,没食子酸、大黄素、白黎芦醇、大黄酸为何首乌中具有明显细胞毒性的单体成分,结合L-02肝细胞损伤特征分析和含量分析,推测何首乌致肝损伤的主要成分可能是没食子酸。Lin等[25]认为大黄素不是何首乌主要的肝毒性的成分,其肝毒性成分与没食子酰基和大黄素-O-己糖硫酸盐有关。
1.2.4 成分协同作用也有研究者认为,何首乌成分复杂,其致肝损伤作用并不是单一成分作用的结果,多种成分相互作用相互影响可能是其产生肝毒性的诱因。研究发现[26],生何首乌75%乙醇提取物中鞣质与TSG的不同比例配比后灌胃大鼠后可出现肝损伤,且TSG对鞣质的肝脏损伤呈现一定协同作用。鞣质与TSG 1:1配比组大鼠出现胆道阻塞症状,随着给药时间的增加症状逐渐加重, 可损伤到肝实质细胞,并且损伤不可逆。蒋骊龙等[27]研究发现TSG促进大黄素在肠道中的吸收,同时抑制其在肝脏中的代谢,导致大黄素在体内蓄积,导致何首乌致DILI。
综上所述,何首乌对肝脏有一定的损伤作用,其机制与CYP450酶活性、炎症因子升高及胆汁淤积相关,但动物模型未见报道有明显肝毒性且肝损伤相关的生化指标ALT、AST未见显著性升高,与临床报道的病例特征不符合[28]。关于其致毒成分研究多集中于蒽醌类物质,究竟何种成分是引起何首乌DILI的主要成分,仍需基于明确肝损伤模型的进一步系统的研究。有报道[29]表明小鼠对制何首乌的最大耐受剂量大于临床常用剂量倍数均大于100倍,而临床病例中服用常规剂量即有何首乌致DILI的报道。近年来,有学者认为服用何首乌及其成方制剂人群巨大,何首乌致DILI发生率相对较低,并且在正常动物安全性评价中表现出的肝损伤不强,与临床病例特征不符,因此认为何首乌所致的肝损伤可能为特异质肝损伤(IDILI)[30]。
特异质DILI(IDILI)指临床用药时大部分服用某特定药物的患者并无肝损伤事件发生,仅在小部分有易感体质的人群中出现,因此IDILI的发生与患者服用药物的剂量无明确相关性,无法复制出相似的动物模型,临床上无法预测[31]。
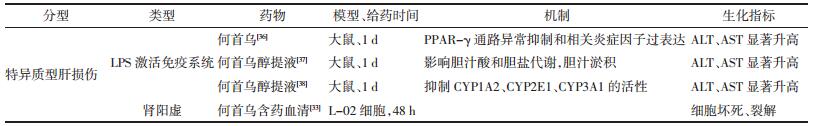
2.1 何首乌致IDILI的模型及机制 2.1.1 与中医证候相关的何首乌致IDILI研究基于中医“有故无殒”的现象,有学者提出何首乌所致IDILI与中医证候与疾病类型相关[32]。欧莉等[33]通过给予大鼠皮下注射氢化可的松建立肾阳虚模型,连续灌胃何首乌14 d后,制备含药血清,作用于L-02细胞,结果显示何首乌含药血清可不同程度降低细胞内总谷胱甘肽(T-GSH)及谷胱甘肽(GSH)含量;肾阳虚中、高剂量组含药血清作用48 h后,细胞内GSH含量与空白对照组比较有统计学差异,可见细胞密度变小,且可见部分细胞坏死、裂解,脱壁细胞增加, 提示肾阳虚证可能是制首乌致IDILI的靶向证候。高晓庆等[34]将SD大鼠制备肾阳虚及肾阴虚证模型后分别予制首乌高、中、低剂量灌胃3个月后,测定肝线粒体中细胞色素氧化酶(COX)活力及通透性转变孔道(mPTP)开放。结果肾阳虚高、中、低剂量组PTP变化值显著低于肾阳虚模型对照组,COX活力显著大于肾阳虚模型对照组, 肾阴虚证的大鼠肝线粒体COX活力增强,PTP通透性减小,肾阴虚证大鼠给制首乌提取液后PTP通透性较肾阳虚证显著减小, 说明制何首乌肝毒性成分可能在肾阴虚证大鼠体内毒性减弱。由上可见,肾阳虚证患者不适宜使用何首乌,应用时可能会导致肝损伤,提醒何首乌临床应用时应注意辨证论治。
2.1.2 与炎症特异质相关的何首乌致IDILI研究炎症特异质模型最初由Roth.R.A提出,是目前国际上广泛认可的特异质肝损伤模型[35]。Fan等[30]认为何首乌致IDILI与炎症特异质有关,经无毒剂量的LPS激活免疫系统后,引起TNF-α等炎症因子升高,再灌胃临床常用剂量何首乌后大鼠肝脏HE染色可见轻微肿胀及局部慢性炎性灶,且ALT、AST显著升高,说明LPS诱导后何首乌可以引起大鼠特异质肝损伤,这种肝损伤无剂量依赖性。
基于炎症的何首乌致特异质型肝损伤机制研究较深入。贺兰芝等[36]认为LPS诱导的何首乌IDILI的发生与PPAR-γ通路异常抑制和相关炎症因子过表达有关。井潇等[37]发现LPS刺激后灌胃何首乌醇提液,可见大鼠出现胆汁淤积症状,可见多药耐药蛋白3(MRP3)的表达上调,但胆汁盐输出泵转运蛋白(BSEP)、多药耐药蛋白2(MRP2)无明显变化;在LPS诱导的基础上,何首乌醇提液可影响胆汁酸和胆盐代谢,造成胆汁分泌减少,引起胆汁淤积症状。谢丽华[38]研究认为LPS诱导后灌胃大鼠何首乌醇提液出现IDILI, 毒性的发生与抑制CYP1A2、CYP2E1、CYP3A1的活性和抑制CYP1A2蛋白表达有关。樊星等[39]认为血清microRNA-122在LPS诱导何首乌肝损伤模型中变化的灵敏性及稳定性优于传统血清生物标志物。
由于何首乌致IDILI模型的限制,关于其致IDILI的成分研究也较少。李春雨等[40]在LPS刺激后诱导的何首乌IDILI模型基础上,发现TSG可能是何首乌致IDILI物质,在此模型上,反式TSG未见明显的致肝损伤作用,但反式TSG可经紫外光照射发生构象变化转化为顺式结构,顺式TSG增强首乌特异质肝损伤作用。
综上所述,何首乌炎症应激模型致IDILI可见其肝脏ALT、AST显著升高,其机制与CYP450酶、炎症及胆汁淤积及肝线粒体相关。但关于IDILI目前的研究多处于假说阶段,动物模型较少[35],何首乌致特异质肝损伤的其他模型与机制,尚需进一步探索。
3 结语随着人们健康意识的日益增强,何首乌及含何首乌的中成药在治疗和预防各种疾病中的应用越来越为广泛,随着临床病例的报道及基础研究的进展,人们对何首乌是否安全的认识也越来越多。尽管传统上人们大多认为何首乌在炮制过后毒性降低,但是关于制何首乌致DILI的报道仍层出不穷。目前关于何首乌肝毒性的试验性研究有很多报道,但是关于何首乌致DILI的发生机制、什么是何首乌的致DILI的成分和何首乌怎样炮制及配伍才可以减轻肝损伤的风险等的研究尚不明确。且何首乌成分复杂,如何建立起符合临床特征的何首乌致DILI的动物模型,并在此模型的基础上,研究何首乌可能的致DILI的成分,及配伍减毒机制,为何首乌炮制及提取成分提供参考,是当前急需解决的问题。
| [1] |
卫培峰, 张敏, 焦晨莉, 等. 何首乌不同炮制品对大鼠肝脏CYP2E1基因mRNA表达的影响[J]. 中国医院药学杂志, 2010, 30(17): 1445-1448. |
| [2] |
卫培峰, 胡锡琴, 苗彦霞, 等. 制首乌不同成分诱导肝细胞凋亡与肿瘤坏死因子α的相关性研究[J]. 四川中医, 2009, 27(10): 47-48. |
| [3] |
卫培峰, 吴艳艳, 焦晨莉, 等. 制何首乌及大黄酚对小鼠肝细胞凋亡的影响[J]. 中国实验方剂学杂志, 2010, 16(14): 171-173. |
| [4] |
Li DK, Chen J, Ge ZZ, et al. Hepatotoxicity in Rats Induced by Aqueous Extract of Polygoni Multiflori Radix, Root of Polygonum multiflorum Related to the Activity Inhibition of CYP1A2 or CYP2E1[J]. Evidence-Based Complementary and Alternative Medicine, 2017, 24(5): 136-147. |
| [5] |
胡锡琴, 杨红莲, 张晓琴, 等. 制何首乌对大鼠肝脏毒理的实验研究[J]. 陕西中医学院学报, 2006, 29(5): 40-43. |
| [6] |
胡锡琴, 耿增岩, 李巧兰, 等. 制何首乌不同剂量与大鼠肝损伤程度的实验研究[J]. 陕西中医, 2007, 28(10): 1420-1422. DOI:10.3969/j.issn.1000-7369.2007.10.105 |
| [7] |
王文静, 李娅琳. 生何首乌、制何首乌对大鼠肝微粒体CYP450的影响[J]. 现代中医药, 2014, 34(2): 76-78. |
| [8] |
李浩, 杨红莉, 李登科, 等. 何首乌水提物对大鼠肝脏CYP1A2, CYP2E1酶活性及mRNA表达抑制作用研究[J]. 中国中药杂志, 2015, 40(4): 1370-1372. |
| [9] |
全正扬, 陈静, 李登科, 等. 大鼠何首乌水提物短期灌胃的肝毒性研究[J]. 中国药物警戒, 2017, 14(6): 321-323. DOI:10.3969/j.issn.1672-8629.2017.06.001 |
| [10] |
王涛, 王佳颖, 江振洲, 等. 何首乌水提物大鼠连续灌胃给药28天肝毒性-胆汁淤积相关性分析[J]. 中国中药杂志, 2012, 37(10): 1445-1450. |
| [11] |
罗瑞芝, 贾伟, 赵利斌, 等. 何首乌研究进展[J]. 中草药, 2005, 36(7): 1091-1097. |
| [12] |
Yao S, Li Y, Kong L. Preparative isolation and purification of chemical constituents from the root of Polygonum multiflorum by high-speed counter-current chromatogra-phy[J]. J Chromatogr A, 2006, 15(11): 64-73. |
| [13] |
汪祺, 张玉杰, 马双成, 等. 基于二相代谢酶考察何首乌中主要单体肝毒性[J]. 药物分析杂志, 2016, 36(12): 2010-2015. |
| [14] |
贾歌, 刘畅, 庞晶瑶, 等. 何首乌及其成分对人正常肝细胞凋亡的影响[J]. 中国中医药信息杂志, 2015, 11(22): 46-48. |
| [15] |
汪美汐, 王宇光, 高月, 等. 何首乌中大黄素对L02肝细胞CYP亚酶表达及细胞毒性的影响[J]. 中国药理学通报, 2016, 32(11): 1543-1547. DOI:10.3969/j.issn.1001-1978.2016.11.013 |
| [16] |
孙向红, 孙玉维, 李红, 等. 何首乌主要成分大黄素、大黄酸和二苯乙烯苷对肝细胞、肝癌细胞的影响[J]. 现代中西医结合杂志, 2010, 19(11): 1315-1318. DOI:10.3969/j.issn.1008-8849.2010.11.007 |
| [17] |
卫培峰, 吴燕燕, 焦晨莉, 等. 制何首乌及大黄酚对小鼠肝细胞凋亡的影响[J]. 中国实验方剂学杂志, 2010, 16(14): 172-173. DOI:10.3969/j.issn.1005-9903.2010.14.053 |
| [18] |
吴双.何首乌水提物及EG大鼠肝微粒体代谢成分分析及肝细胞毒研究[D].北京: 北京中医药大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10026-1017201359.htm
|
| [19] |
Bounda GA, Zhou W, Wang DD. Rhein Elicits In Vitro Cytotoxicity in Primary Human Liver HL-7702 Cells by Inducing Apoptosis through Mitochondria-Mediated Pathway[J]. Evidence-Based Complementary and Alternative Medicine Volume, 2015, 24(40): 267-279. |
| [20] |
李娜, 马致洁, 孟雅坤, 等. 二苯乙烯苷对正常人肝细胞增殖的抑制率及影响因素研究[J]. 中国药物警戒, 2015, 12(7): 285-288. |
| [21] |
Wu X, Chen X, Huang Q, et al. Toxicity of raw and processed roots of Polygonum multiflorum[J]. Fitoterapia, 2012, 83(3): 469-475. DOI:10.1016/j.fitote.2011.12.012 |
| [22] |
Xu SF, Liu J, Shi J, et al. 2, 3, 4', 5-tetrahydroxystilbene-2-O-β-D-glucoside exacerbates acetaminophen-induced hepatotoxicity by inducing hepatic expression of CYP2E1, CYP3A4 and CYP1A2[J]. Scientific RepoRts, 2017, 40(7): 16-21. |
| [23] |
Chalasani NP, Hayashi PH, Bonkovsky HL, et al. ACG ClinicalGuideline:the diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol, 2014, 109(7): 939-950. |
| [24] |
吴宇.药物性肝损伤体外筛选模型和何首乌致肝损伤的初步研究[D]北京: 北京协和医学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10023-1016236177.htm
|
| [25] |
Lin LF, Li H, Lin HG, et al. A new perspective on liver injury bytraditional Chinese herbs such Aspolygonum multiflorum:the geographical area of harvest as an important contributory factor[J]. Frontiers in Pharmacology, 2017, 6(8): 337-349. |
| [26] |
胡锡琴, 李婭琳, 王磊, 等. 何首乌中鞣质对大鼠肝脏生化指标的影响[J]. 药物评价研究, 2010, 33(1): 63-65. |
| [27] |
蒋骊龙, 罗娜, 李会军, 等. 二苯乙稀苷影响大黄素吸收代谢的体外研究[J]. 2015年(第五届)药物毒理学年会, 294-295. |
| [28] |
练祥, 柯婷婷, 胡爱荣, 等. 何首乌及其制剂致药物性肝损伤52例临床分析[J]. 中华中医药学刊, 2013, 31(5): 1133-1134. |
| [29] |
夏蕾, 王丽霞, 牟稷征, 等. 制何首乌和白蒺藜对小鼠毒性作用的实验研究[J]. 中国医院用药评价与分析, 2010, 10(1): 32-34. |
| [30] |
Fan X, Wang J, Wang QJ, et al. A new animal model for Polygonum multiflorumThunb-induced liver injury in rats and its potential mechanisms[J]. Toxicology Research, 2015, 4(10): 85-98. |
| [31] |
茅益民. 解读ACG临床指南:"特异质型药物性肝损伤的诊断和管理"[J]. 胃肠病学, 2015, 20(4): 193-195. DOI:10.3969/j.issn.1008-7125.2015.04.02 |
| [32] |
庞晶瑶, 柏兆方, 肖小河, 等. 基于"有故无殒"的何首乌对正常和肝损伤大鼠的毒性与保护作用对比研究[J]. 药学学报, 2015, 50(8): 973-979. |
| [33] |
欧莉, 彭成, 卫培峰, 等. 制首乌诱导肝细胞凋亡的"毒-证"机制[J]. 中国老年学杂志, 2016, 36(1): 262-264. |
| [34] |
高晓庆, 卫培峰, 白杨, 等. 制首乌对肾阳虚、肾阴虚证大鼠肝线粒体COX及mPTP开放的影响[J]. 中医药导报, 2016, 22(5): 3-5. |
| [35] |
Robert AR, Patricia EG. Animal models of idiosyncratic drug-induced liver injury-Current status[J]. Critical Reviews in Toxicology, 2011, 3(24): 1-17. |
| [36] |
贺兰芝, 尹萍, 孟雅坤, 等. PPAR-γ依赖的何首乌免疫性特异质肝损伤机制研究[J]. 药学学报, 2017, 52(7): 1027-1032. |
| [37] |
井潇, 吴纯启, 韩刚, 等. 何首乌肝损伤模型大鼠胆汁淤积现象及相关蛋白表达研究[J]. 药物评价研究, 2017, 40(5): 612-615. |
| [38] |
谢丽华, 樊星, 李曼, 等. 何首乌乙醇提取液对LPS诱导大鼠肝脏CYP450酶的影响[J]. 药物评价研究, 2016, 39(2): 175-178. |
| [39] |
樊星, 王伽伯, 丁日高, 等. 血清microRNA-122在LPS诱导何首乌致大鼠肝损伤模型中的表达[J]. 药学学报, 2017, 52(7): 1045-1047. |
| [40] |
李春雨.基于免疫应激的何首乌特异质肝损伤的初步硏究[D].成都: 成都中医药大学, 2015.
|
 2018, Vol. 37
2018, Vol. 37