文章信息
- 黄棪, 徐明英, 夏雪皎, 张俊杰
- HUANG Yan, XU Mingying, XIA Xuejiao, ZHANG Junjie
- 旋覆代赭汤对胆碱能抗炎通路相关RE大鼠炎症因子的影响
- The effect of Xuanfu Daizhe decoction on inflammations in Reflux Esophagitis rats of CAP
- 天津中医药大学学报, 2018, 37(5): 386-389
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(5): 386-389
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.05.10
-
文章历史
收稿日期: 2018-04-05
机体受到感染或损伤时,通过调节体内促炎因子和抑炎因子的水平,可以促进外来病原体的清除和组织修复。反流性食管炎(RE)是机体促炎因子和抑炎因子调控失衡引起的一种以食管黏膜损害为表现的炎症。研究发现,炎症反应除了通过促肾上腺皮质激素-糖皮质激素轴调节以外,迷走神经介导的胆碱能抗炎通路(CAP)对机体局部和全身炎症反应也具有调控作用[1],本研究通过用“颈左侧迷走神经切断术”联合“贲门肌切开术加部分幽门结扎”制备胆碱能抗炎通路相关大鼠反流性食管炎动物模型[2-3],观察食管组织和血浆中促炎因子肿瘤坏死因子-α(TNF-α)、白介素(IL)-1β、IL-6和IL-10的含量,探讨旋覆代赭汤对反流性食管炎大鼠炎症因子的调节作用。
1 材料 1.1 动物清洁级SD大鼠65只,雄性,体质量(200±20)g,由浙江中医药大学实验动物中心提供,许可证号:SCXK(沪)2013-0016。
1.2 药物旋覆代赭汤方:旋覆花、半夏、炙甘草、大枣、代赭石、生姜、人参。药物购自浙江中医药大学中医门诊部,由浙江省中药研究所制剂室制备。药物浓缩至含2 g/mL生药的溶液,高温消毒灭菌,4 ℃保存,使用前混匀。
枸橼酸莫沙比利分散片(产品批号:160411),购自成都康弘药业集团股份有限公司。配制为浓度0.3 mg/mL的混悬液,4 ℃保存,使用前混匀。
1.3 试剂TNF-α(批号:E2016110306)、IL-1β(批号:E2016122104)、IL-6(批号:E2016110304)、IL-10(批号:E2016110305),酶联免疫吸附剂测定(ELISA)检测试剂盒均为杭州诚维生物有限公司产品。
1.4 仪器脱水机、包埋机、切片机(Micrrom公司产品);连续光谱酶标仪(美国Thermo公司产品);显微镜(日本Olympus公司产品)。
2 方法 2.1 造模方法造模前禁食不禁水24 h,行“部分贲门肌切开+外置幽门结扎术”,建立慢性酸性反流性食管炎模型;行“颈部单侧迷走神经切断术”建立胆碱能抗炎通路反流性食管炎模型。
2.2 分组及给药随机分为6组,即正常组、RE组、假手术组、模型组、中药组和西药组。除模型组15只外,其余每组10只。RE组为慢性酸性反流性食管炎模型;假手术组在RE组的基础上,仅分离颈左侧迷走神经而不离断;而模型组、中药组、西药组则在RE组的基础上,单侧迷走神经切断以建立胆碱能抗炎通路RE模型。造模3周后,模型组随机取5只大鼠食管做病理检测,验证模型成功与否;同时开始给药,各组大鼠相应给予旋覆代赭汤水煎剂、莫沙必利混悬液、生理盐水。每次按5 mL/kg体质量进行灌胃,每日1次,连续14 d。中药组给予旋覆代赭汤水煎剂,西药组给予莫沙必利混悬液,其余各组均给予生理盐水。
2.3 取材及指标检测大鼠末次给药后,禁食24 h,自由饮水,以10%水合氯醛3 mL/kg腹腔注射麻醉,心脏采血,每只抽取5 mL血液,离心后取上清,置入-20 ℃冰箱中备用。采血后迅速开腹,取食管-胃交界处向咽喉部截取1.5~2.0 cm长的食管,以0.9%NaCl溶液清洗,用手术剪剖开,肉眼观察食管黏膜状况。将食管放入10%福尔马林中固定,常规病理切片,HE染色,光镜观察。按试剂盒说明用酶联免疫吸附试验法检测食管组织和血浆中TNF-α,IL-1β和IL-10含量。
2.4 统计学分析应用SPSS 20.0统计软件对数据进行处理和分析,结果以均数±标准差(x±s)表示。数值资料进行正态性分布分析,方差齐性检验,符合正态分布并且方差齐,采用单因素方差分析,组间两两比较采用LSD法,P < 0.05为差异具有统计学意义。
3 结果 3.1 一般情况和体征正常组大鼠被毛紧密,色白光泽,活动自如,反应敏捷,食欲良好,体质量增长正常,大便呈颗粒状;造模后的大鼠被毛色黄稀疏,光泽减弱,精神萎靡,食量及体质量下降,大便稀溏。术后1周大鼠体质量缓慢增长,模型组体质量增长较其他组缓慢。实验中大鼠共死亡6只,假手术组、RE组、中药组各死亡1只,模型组死亡3只,死亡原因主要有腹腔感染、消化道出血、反流窒息等。治疗后中药组和西药组大鼠毛色、食欲、体质量等均较模型组改善。
3.2 各组大鼠食管黏膜肉眼及病理表现 3.2.1 食管黏膜肉眼表现3周时模型组大鼠胃底扩张明显,胃体积较正常组增加约1倍,食管下端黏膜可见点状发红。5周后,模型组大鼠食管黏膜部分可见发白、粗糙,或见点片状充血,可见点状黏膜缺损;正常组和治疗组表现基本相同,黏膜呈淡红色,光滑,轻微水肿、充血。假手术组和RE组食管黏膜有不同程度的黏膜发红、粗糙,程度与模型组相似。
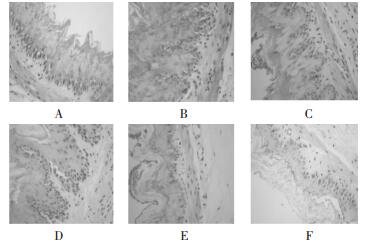
3.2.2 食管黏膜光镜下病理表现见图 1。
|
| 注:A:正常组;B:假手术组;C:RE组;D:模型组;E:中药组;F:西药组 图 1 食管黏膜光镜下病理表现 |
3周时模型组大鼠食管黏膜光镜下可见鳞状上皮增生,角质层呈火焰状增生,固有层乳头伸长明显,并有点状糜烂、炎症细胞浸润,提示造模成功。5周后,模型组大鼠黏膜表现较3周组加重,除见鳞状上皮增生、固有层乳头伸长,炎细胞浸润、毛细血管扩张以外,部分大鼠局部还出现溃疡。而治疗组黏膜镜下表现明显改善,表现为鳞状上皮少量增生,固有层乳头长度缩短,部分大鼠黏膜仍可见糜烂灶。
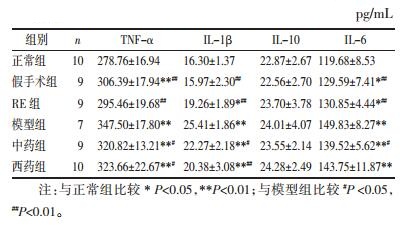
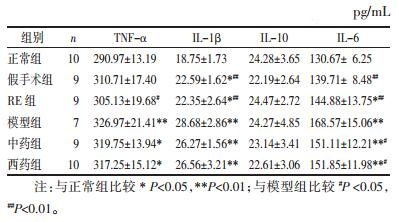
3.3 各组大鼠食管组织和血浆中炎症因子含量与正常组比较,模型组食管组织和血浆中TNF-α、IL-1β、IL-6含量均显著性升高(P < 0.01),IL-10差异无统计学意义(P>0.05)。
与模型组比较,中药组食管组织中IL-1β、TNF-α、IL-6含量以及血浆中IL-6含量均显著降低(P < 0.05),西药组食管组织中IL-1β、TNF-α含量及血浆中IL-6含量也降低(P < 0.05或P < 0.01)。与模型组比较,中药组和西药组IL-10水平,均差异无统计学意义(P>0.05),见表 1~2。
RE是常见的慢性消化道疾病,该病的发病率在西方国家高达7%~15%,而亚洲地区发病率相对较低,但近年来随着中国生活方式西化、人口的老龄化,RE的发病率也有增高趋势[4]。现代医学对RE的治疗目前局限于抑酸药和促胃肠动力药,仍有一大部分患者症状改善不明显,旋覆代赭汤在临床上治疗证属胃虚痰阻,气逆不降型的反流性食管炎有着显著的疗效,但机制不清楚。
反流性食管炎的发展与炎症介质密切相关,研究表明,炎症介质与食管动力、纤维化、恶变程度等相关[5]。在RE患者和动物模型中,IL-1β、TNF-α等炎症因子较对照组均显著提高,对IL-10的报道不一致[6-7]。胆碱能抗炎通路(CAP)是一条迷走神经介导的神经免疫抗炎通路,刺激迷走神经,可以激活CAP,抑制多种促炎因子如IL-1β、IL-6、TNF-α等的合成和释放,改善全身或局部炎症,但CAP的激活对IL-10水平不影响[8]。临床上,对于食管贲门癌患者,肿瘤未侵及周围组织的患者,术中采取保留迷走神经的术式,可以明显降低术后反流性食管炎的发生率[9-10]。在急性反流性食管炎模型中,切断双侧迷走神经,可以使食管黏膜损伤加重,电刺激切断的迷走神经后,可以激活CAP,减轻食管损伤。目前研究表明,在类风湿关节炎[11]、结肠炎[12]、胰腺炎[13]等动物模型中,切断颈部单侧迷走神经可以阻断迷走神经的保护作用,加重模型局部症状。
本实验中,与正常组比较,RE组血浆和组织中IL-1β、IL-6含量及模型组血浆和组织中TNF-α、IL-1β、IL-6水平均是升高的,且模型组的血浆和组织中TNF-α、IL-1β、IL-6水平明显高于RE组;但各组之间比较,对IL-10没有统计学差异。说明反流性食管炎发生时,主要是通过胆碱能抗炎通路,使促炎因子增加引起的机体调节失衡,单侧迷走神经阻断,可以加重反流性食管炎的炎症反应。与模型组比较,中药治疗组食管组织中TNF-α、IL-1β、IL-6等促炎因子水平显著降低,但对抑炎因子IL-10无影响。说明旋覆代赭汤可能是通过抑制促炎因子的释放来发挥抗炎作用的。
| [1] |
Borovikova LV, Ivanova S, Zhang M, et al. Vagus nerve stimulation attenduates the systemic inflammatory response to endotoxin[J]. Nature, 2000, 405(6785): 458-462. DOI:10.1038/35013070 |
| [2] |
唐艳萍, 弓艳霞, 李淑红, 等. 改良酸反流性食管炎动物模型建立及比较研究[J]. 中华消化杂志, 2011, 31(9): 632-633. DOI:10.3760/cma.j.issn.0254-1432.2011.09.014 |
| [3] |
van Maanen MA, Lebre MC, van der PT, et al. Stimulation of nicotinic acetylcholine receptors attenuates collagen-induced arthritis in mice[J]. Arthritis Rheum, 2009, 60(1): 114-122. DOI:10.1002/art.v60:1 |
| [4] |
张弓羽, 张振玉. 胃食管反流病的流行病学[J]. 世界华人消化杂志, 2010, 18(24): 2552-2557. |
| [5] |
Rieder F, Biancani P, Harnett K, et al. Inflammatory mediators in gastroesophageal reflux disease:impact on esophageal motility, fibrosis, and carcinogenesis[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 298(5): G571-81. DOI:10.1152/ajpgi.00454.2009 |
| [6] |
Fitzgerald RC, Onwuegbusi BA, Bajaj-Elliott M, et al. Diversity in the oesophageal phenotypic response to gastro-oesophageal reflux:immunological determinants[J]. Gut, 2002, 50(4): 451-459. DOI:10.1136/gut.50.4.451 |
| [7] |
史业骞, 刘清君, 杜昕, 等. 旋覆代赭汤对混合性反流性食管炎模型大鼠IL-10的影响[J]. 辽宁中医杂志, 2011, 38(12): 2480-2482. |
| [8] |
Tracey KJ. Reflex control of immunity[J]. Nat Rev Immunol, 2009, 9(6): 418-428. DOI:10.1038/nri2566 |
| [9] |
王国范, 张百江, 杨文峰, 等. 保留迷走神经加胃底重建预防食管贲门癌术后胃食管返流的研究[J]. 肿瘤防治杂志, 2005, 12(3): 218-221. DOI:10.3969/j.issn.1673-5269.2005.03.016 |
| [10] |
韩冰, 蔻瑛琍. 保留迷走神经的食管切除术后胃消化功能的研究[J]. 中国胸心血管外科临床杂志, 2016, 23(3): 253-257. |
| [11] |
Koopman FA, Schuurman PR, Vervoordeldonk MJ, et al. Vagus nerve stimulation:A new bioelectronics approach to treat rheumatoid arthritis[J]. Best Pract Res Clin Rheumatol, 2014, 28(4): 625-635. DOI:10.1016/j.berh.2014.10.015 |
| [12] |
O'Mahony C, van der Kleij H, Bienenstock J, et al. Loss of vagal anti-inflammatory effect:in vivo visualization and adoptive transfer[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 297(4): 1118-1126. DOI:10.1152/ajpregu.90904.2008 |
| [13] |
van Westerloo DJ, Giebelen IA, Florquin S, et al. The vagus nerve and nicotinic receptors modulate experimental pancreatitis severity in mice[J]. Gastroenterology, 2006, 130(6): 1822-1830. DOI:10.1053/j.gastro.2006.02.022 |
 2018, Vol. 37
2018, Vol. 37