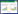文章信息
- 沙争梅, 徐宗佩, 李菁浩, 王宏波, 李琳, 刘虹, 李琳玮, 杨鹏飞, 李玉红
- SHA Zhengmei, XU Zongpei, LI Jinghao, WANG Hongtao, LI Lin, LIU Hong, LI Linwei, YANG Pengfei, LI Yuhong
- 清肝通络饮对SHR的降压及心脏保护作用的研究
- Antihypertensive effects of Qinggan Tongluo yin in spontaneously hypertensive rats and protective effect on SHR heart
- 天津中医药大学学报, 2018, 37(5): 404-410
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(5): 404-410
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.05.14
-
文章历史
收稿日期: 2018-03-24
2. 天津中医药大学中医药研究院, 天津 300193
2. TCM Resarch Institute, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
原发性高血压(EH)是以血压升高为主要临床表现,严重影响人类健康的常见慢性病。目前中国高血压患者总数达到4.5亿,高血压患病率增至66% [1],原发性高血压发病率占高血压总发病率的90%[2],心血管导致居民死亡率达40%,高于肿瘤及其他疾病[3]。血压的升高,提示机体某些部位存在缺血情况,对于这种情况,中医归于络脉不畅,络脉不得滋荣,气血随火上逆,血压升高[4]。患者多由于肝火、肝阳亢盛而导致头痛、眩晕、头胀、眼睛干涩不适、脉弦等临床表现,采用清肝火、平肝阳、通络活血等方法予以治疗。徐宗佩教授根据多年临床治疗高血压的经验与体会,在对病机充分认识的基础上,化裁天麻钩藤饮等名方而拟清肝通络饮方[4]。前期临床观察表明[5], 清肝通络饮可以有效减低患者血压,并缓解头痛、头胀等症状,同时还有降低血脂的功能。本实验以自发性高血压大鼠(SHR)为模型[6],采用大鼠尾动脉无创伤性测压仪测定清醒状态下SHR的尾动脉血压,观察清肝通络饮对SHR血压的影响;并观察了其对大鼠心脏功能和形态、血脂的影响。
1 实验材料 1.1 实验动物SHR,40只,SPF级,雄性,10周龄,体质量(220~250)g;魏一凯二氏大鼠(WKY),8只,SPF级,雄性,10周龄,体质量200~220 g,均由北京市维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0011,动物合格证号:11400700213562。饲养于天津市中国医学科学院放射医学研究所清洁级动物房,室内温度为(20~25)℃,相对湿度(40~60)%,自由饮食及饮水。
1.2 实验药物 1.2.1 清肝通络饮及其制备清肝通络饮组成:钩藤20 g(饮片批号160901)、野菊花15 g(饮片批号160801)、夏枯草15 g(饮片批号161001)、决明子20 g(饮片批号1508627191)、牛膝30 g(饮片批号161201)、地龙20 g(饮片批号160901)、土鳖虫10 g(饮片批号161201)、黄芩12 g(饮片批号161201)、炒栀子12 g(饮片批号151101)、丹参30 g(饮片批号161201)、益母草20 g(饮片批号160901)、杜仲12 g(饮片批号161001)、桑枝30 g(饮片批号160901)、威灵仙15 g(饮片批号161201)、茯苓15 g(饮片批号161202)。中药饮片均购于河北安国祁安药业有限公司,经天津中医药大学副研究员刘虹鉴定均为药典规定品种。将中药饮片称质量后,用10倍量的水浸泡0.5 h,回流提取第1次,用8倍量的水回流提取第2次,每次1.5 h,两次液体合并为清肝通络饮原液,经旋转、蒸发、烘干、称质量,计算出膏率(出膏率=干膏率/药材量×100%)如表 1,并将所得干膏研细,密封置于干燥器内备用。
阳性对照药为缬沙坦胶囊(代文),规格:80 mg×7片/盒。药品购于北京诺华制药有限公司,产品批号:X2062。
1.2.2 药物的配制及给药清肝通络饮高、中、低剂量组25 g、12.5 g、6.25 g生药/kg,将成人每日用量276 g按体表面积折算成大鼠等效剂量的1倍、0.5倍、0.25倍分别是[25 g、12.5 g、6.25 g生药/(kg·d)]。3个剂量分别制备成不同浓度,等体积浸膏灌胃大鼠。参考相关文献[7-8],阳性对照组缬沙坦用药量为(15 mg/kg),相当于将成人每日用量按体表面积折算成大鼠等效剂量的2倍。给药组大鼠均按100 g体质量给予1.0 mL药物的体积每日灌胃1次,空白组、模型组均以灌胃的方式给予等体积的纯水。连续给药10周至实验结束。所有药液,超声溶解后,4 ℃冰箱储存备用,灌胃前摇均。
1.3 实验仪器大小鼠智能无创血压计(北京软隆生物技术有限公司);小动物超声仪(加拿大Visual Sonics公司);全自动生化分析仪(日本HITACHI公司);-80 ℃低温冰箱(日本Sanyo公司);万分之一天平(德国Sartorius公司)。
2 实验方法 2.1 实验分组8只WKY大鼠,4只/笼,为对照组;40只SHR,根据血压测量结果,随机分为5组,每组8只,分别为:模型组、缬沙坦组、清肝通络饮高剂量[25 g生药/(kg·d)]组、清肝通络饮(中剂量组)[12.5 g生药/(kg·d)]组、清肝通络饮(低剂量组)[6.25 g生药/(kg·d)]组。
2.2 大鼠血压的测量大鼠适应性饲养1周,运用大小鼠智能无创血压计给予大鼠每天进行血压测量训练,连续训练7 d,同时观察大鼠的活动、进食和皮毛状况。在大鼠清醒状态下,分别给药前、药后每周测量收缩压(SBP)。测量过程完全严格按血压计操作手册规范进行操作,在安静、温暖的环境中,首先将测量装置连接好并开启保温装置,将大鼠置于保温筒内固定,动作要轻柔,使大鼠尽量保持安静,预热(37~38.5)℃约15 min,待大鼠情绪稳定后,将加压感应器置于其尾根处,待尾部脉搏波形稳定时,血压计自动加压测量,共测量5次,每次分别读取并记录SBP值,取平均值。每次在相同的环境下进行血压测量,以确保实验结果的稳定性。
2.3 超声心动检测大鼠心脏功能和形态末次给药后,进行小动物心动超声检测。将动物用10%水合氯醛ip(300 mg/kg),麻醉后,胸前区脱毛,将大鼠腹部向上,固定于操作台,胸部区域涂抹一层耦合剂,选用高频矩阵探头,探头垂直于左胸壁,与胸骨约成10~30°夹角,通过X、Y微调操作台位置,将探头转动,在胸骨旁长轴,可见左心室主动脉和二尖瓣瓣叶,显示心脏沿二尖瓣口至心尖方向的左室长轴像。在左室长轴像引导下,左室内径最大处显示M型图像。选用长轴测量包对大鼠收缩期和舒张期的心功能及形态学指标。心脏功能指标:左室射血分数(EF)和左室短轴缩短率(FS)。心脏形态学指标:左室舒张末期内径(Lvid.d)、左室收缩末期内径(Lvid.s)、舒张末期室间隔厚度(Ivsd)、收缩末期室间隔厚度(Ivss)、舒张末期左室后壁厚度(Lvpw.d)、收缩末期左室后壁厚度(Lvpw.s)、左心室质量(Mass)、左心室舒张末期容积(Vol.d)、左心室收缩末期容积(Vol.s)。每只大鼠均取3个心动周期进行测量,取平均值。
2.4 标本的采集超声心动图检测后,对大鼠进行腹主动脉取血,取血后于管口标记,置于37 ℃水浴30 min,3 000 r/min,离心15 min,取血清分装放于-80 ℃冰箱保存备用。
2.5 生化指标的检测应用全自动生化分析仪,检测各组大鼠血清中血脂(TC、TG、HDL、LDL)含量。
2.6 统计学处理用SPSS 17.0软件进行数据统计,各组实验数据计量资料应用均数±标准差(x±s)表示,多组间差异比较采用单因素方差分析。组间两两比较,若方差齐用LSD,若方差不齐采用Dunnett’s T3,P < 0.05表示差异有统计学意义。
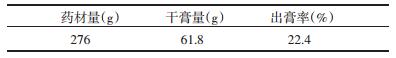
3 实验结果 3.1 清肝通络饮对SHR大鼠血压的影响 3.1.1 单次给药对SHR血压的影响结果显示,模型组大鼠收缩压显著升高,与对照组相比较,有统计学差异(P < 0.01);一次性给予清肝通络饮[25 g、12.5 g、6.25 g生药/(kg·d)],未能显著降低SHR大鼠收缩压,与模型组比较,无统计学差异(P>0.05),一次性给予缬沙坦[15 mg/(kg·d)]能够显著降低SHR大鼠收缩压,与模型组比较,有统计学差异(P < 0.01),其中药后3 h时收缩压降到最低,结果见表 2。
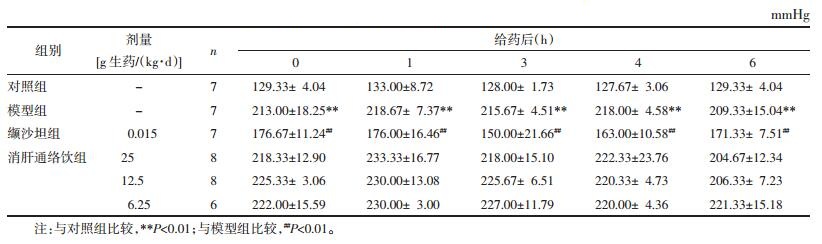
结果显示,模型组SHR收缩压显著升高,与对照组相比较,有显著性差异(P < 0.01);清肝通络饮[25 g生药/(kg·d)]在第1周、第5周降低SHR收缩压,与模型组比较,有统计学差异(P < 0.05~0.01);清肝通络饮[6.25 g生药/(kg·d)]在第1周、第7周、第8周能降低SHR收缩压,与模型组比较,有统计学差异(P < 0.05);其余测量周内,清肝通络饮[25 g、12.5 g、6.25 g生药/(kg·d)],未能降低SHR收缩压,与模型组比较,均无统计学差异;连续给予缬沙坦[15 mg/(kg·d)],在第2周、第5~10周内,均能显著降低SHR大鼠收缩压,与模型组比较,有统计学差异(P < 0.05),结果见表 3。
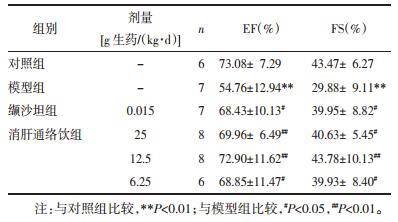
结果显示,模型组SHR的心功能显著下降,与对照组相比较,有统计学差异(P < 0.01);清肝通络饮[25 g、12.5 g、6.25 g生药/(kg·d)],能显著升高SHR的EF、FS值,与模型组比较,有统计学差异(P < 0.05~0.01);给予缬沙坦[15 mg/(kg·d)],也能够显著升高SHR大鼠EF、FS值,与模型组比较,有统计学差异(P < 0.05)。结果见表 4。
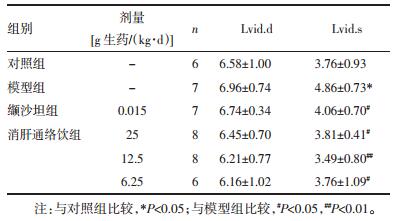
结果显示,各组大鼠Lvid.d无统计学差异(P>0.05)。模型组大鼠的Lvid.s明显增大,与对照组相比较,有统计学差异(P < 0.05);清肝通络饮[25 g、12.5 g、6.25 g生药/(kg·d)]能显著降低SHR的Lvid.s,与模型组比较,有统计学差异(P < 0.05~0.01);连续给予缬沙坦[15 mg/(kg·d)],也能够显著降低SHR大鼠Lvid.s值,与模型组比较,有统计学差异(P < 0.05)。见表 5。
结果显示, 各组大鼠Ivsd、LvPw.d、LvPw.s均无统计学差异(P>0.05)。模型组大鼠的Ivss显著变小,与对照组相比较,有统计学差异(P < 0.05);清肝通络饮[25 g、12.5 g、6.25 g生药/(kg·d)]能显著增加SHR的Ivss,与模型组比较,有统计学差异(P < 0.01);给予缬沙坦[15 mg/(kg·d)],也能够显著增加SHR大鼠Ivss,与模型组比较,有统计学差异(P < 0.05)。结果见表 6。
结果显示,各组大鼠Vol.d无统计学差异(P>0.05)。模型组大鼠的Lv mass显著增加,与对照组相比较,有统计学差异(P < 0.05);其余各组与模型组无统计学差异(P>0.05)。模型组大鼠Vol.s明显增加,与对照组相比较,有统计学差异(P < 0.05);清肝通络饮[25 g、12.5 g、6.25 g生药/(kg·d)],与模型组相比较,Vol.s明显下降,有统计学差异(P < 0.05)。给予缬沙坦[15 mg/(kg·d)],也能够显著降低SHR大鼠Vol.s,与模型组比较,有统计学差异(P < 0.05)。结果见表 7。
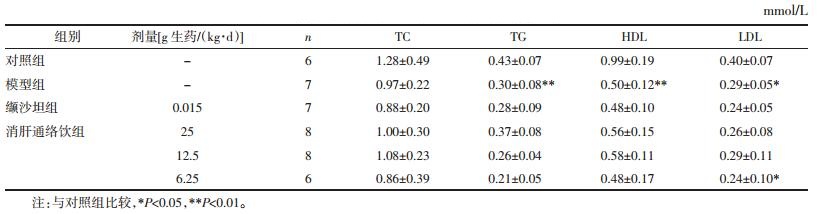
结果显示,清肝通络饮、缬沙坦对各组大鼠血脂无显著影响(P>0.05)。结果见表 8。
清肝通络饮方中钩藤、菊花、夏枯草、决明子、栀子、黄芩均有清肝火的功效,钩藤又能平肝阳;川牛膝、地龙、土鳖虫、丹参、益母草活血;川牛膝还可引血下行;地龙、土鳖虫、桑枝、威灵仙通络;益母草、茯苓利水以防血瘀化水,茯苓还有健脾、安神功效;川牛膝、杜仲补益肝肾以制肝火[5]。诸药合用,共成清肝火、通络逐瘀之剂,针对肝火型高血压,对血压的控制取得较好疗效,随证加减药味,若眩晕明显者,加天麻、牡蛎;清晨血压偏高,血脉瘀滞较重者,加用三棱、莪术;昏沉欲眠者,加当归、川芎、白芍、郁金、石菖蒲;头痛显著者,加蔓荆子、川芎以止痛。
4.1 动物模型选择高血压病的病因病机一直未完全阐释清晰,为了更好的研究其发病机制、防治和预后,选择合适的动物模型是关键[7-8]。用于高血压的动物模型有不同种属如:高血压大鼠模型、高血压犬模型、高血压兔模型、高血压羊模型、高血压灵长类模型等[9]。SHR是目前应用最广泛的高血压动物模型,几乎适用于所有的高血压相关的实验研究[10-11]。SHR大鼠[12]发生高血压几率高,收缩压可达到200 mmHg,4周龄期间可出现心脏质量增加以及心血管病变,无明显的原发性肾损伤,且具有稳定性,同时能形成典型的高血压并发症,主要累及心、脑、肾等器官。SHR是研究原发性高血压、筛选治疗高血压药物的理想动物模型,和人类原发性高血压有诸多相似之处[13-15]:1)两者病因特点均有多基因遗传倾向。2)两者病程特点相似,血压随年龄增长。3)两者随疾病发展会出现器官损伤及并发症。两者差异性:1)SHR为选择性繁殖得到,与人类发病有区别。2)SHR的免疫功能存在异常。3)SHR饲养条件较高,价格贵,遗传育种麻烦,易变种或断种,大批量使用存在一定困难。
本实验以探究清肝通络饮在动物实验上的降压作用。在进行相关实验时,模型的选择很重要。同一实验在不同的模型身上可能得到不同的结果,得出完全不同的结论,结合本次实验的特点和实验条件的合理性,选取了SHR为模型,以尽量确保实验结果和结论的正确性及可信性。
4.2 血压测量方法的选择实验大鼠动物血压的测量主要有两种方法:直接测量法和间接测量法。间接测量方法避免了创伤和麻醉对血压的影响,操作简单易行,实验动物可反复使用,较适用于慢性动物实验[16]。本实验选用无创法测量大鼠尾动脉血压,能够获取实验动物在清醒状态下的血压值,但血压易受动物情绪的影响,测得血压值同时存在一定误差。
4.3 动物实验结果分析单次灌胃给药后,清肝通络饮各组大鼠的SBP值无明显变化,缬沙坦组大鼠的SBP值有统计学差异(P < 0.01),药后2~4 h内,SBP值明显下降,4~6 h内,SBP值逐渐上升至单次给药前。这一变化同缬沙坦的药理研究作用效果相同[17],患者服用缬沙坦胶囊后,药物在体内经过吸收,2 h可达到峰值,缬沙坦作用效果较缓慢,4周左右才能达到降压效果[18]。
连续10周灌胃给药后,在实验第5周,所有实验大鼠血压值普遍升高,可能有以下两点原因:1)可能与测量环境相关,虽尽量保持测量环境安静,但第5周血压测量时,实验室周边有不可避免的声音干扰,为保持实验数据完整性、时间的连续性,未停止当日的血压测量。2)高血压的发病随季节变化而变化,春季为高血压的高发期,第5周血压测量时间为季节转换较明显时期,故可能与季节变化相关[19]。连续灌胃给药10周,清肝通络饮均未明显降低SHR血压,究其原因,可能有以下几点:首先是动物与人体的差别,尽管SHR模型的病因、病程、并发症等方面与人体发病有诸多相似之处,但是生物机体本身的存在差异,故在人体上能有效降低血压的药物可能在实验动物上体现不显著或难以体现。其次由于清肝通络饮是由15味药物组成的大复方,药味较多,方内含有土鳖虫、地龙等虫类药物,故干预药物之间的气味、口感的差异对实验结果可能存在影响,本实验动物易激惹,每次灌胃给药及定期的血压测量动物会产生抵抗,造成心理情绪的抵触,可能会加重肝阳上亢的证型,使血压暂时性升高,无法反映动物平时真正的血压,造成血压降低不显著这样一假象,鉴于临床试验在开展过程中,对安慰剂有一定选择性要求[20-22],故在进行动物药理实验研究时,也应考虑到空白组、对照组、阳性药组的药物与中药实验组的药物的口感、气味等方面的差异性,如果对照组能选择与中药浓度和口味一致的溶剂将会得到更加准确的实验结果。最后可能跟剂量有关,给药的剂量偏大影响了大鼠正常进食。以上是对本次实验血压值的分析结果,尚需要进行更多次、更多剂量及不同动物的实验进行验证此实验结果。
临床上,中药复方的应用,常常不是单味中药发挥疗效,而是通过多条途径、多个作用靶点而产生的整体调节作用[23],共同发挥作用,中药复方多作用平缓、毒副作用相对较小,由于其多组分的优点,在调节血压的同时,缓解其他系统的失衡所致的疾病,适当的发挥保护脏器作用。清肝通络饮虽未提示降压疗效,但实验结果显示其具有保护左心的功能。高血压大鼠随年龄增长,会出现心脏受损的现象[6]。左心肥厚是高血压引起心室重构的结果,心室重构是由于一系列复杂的分子和细胞机制而导致的心室形状改变以及心功能降低。心室重构初期心腔无明显增大,心室壁增厚[24],故心脏功能性改变较明显,形态学损伤有待于延长实验周期以观察。清肝通络饮改善心室结构,保护心肌的具体作用机制,需后期实验进一步探讨。
前期临床试验研究表明,清肝通络饮对患者的血脂有一定的调节作用,本次实验,监测SHR血脂、肾功能等指标。本实验使用动物为SHR,大鼠未进行高脂造模,其各项生化指标应在正常范围内波动。无论是本次实验的数据分析,还是通过与其他文献比较,发现生化指标实验数据的波动性较大[25-26]。国内、国外[27-28]发表了多篇关于血液、血生化指标检测的相关文章,实验结果差别比较大,可能是由于各个实验室相比,实验动物的来源、饲养环境、实验方法等均有所差异。因此对本次实验结果的指导意义不大,建立实验室自己的实验数据库具有更实际的意义[29]。
中药复方治疗高血压病,不是每一味中药作用的简单相加,它是通过多途径、多靶点的整合调节,发挥缓和的降压作用,与化学药物相比,毒副作用相对小,适合长期服用;而且由于中药复方本身的多组分特点,在其发挥降压作用的同时,有效地调整着较高血压水平所导致的其它系统的失衡状态,发挥其脏器保护作用。根据中医的整体观念应用中药方剂对疾病进行辨证论治,有着西医无法比拟的优势[29]。本实验在一定程度上反映清肝通络饮对心脏的保护作用,其降压作用未明确显示,临床上还需收集足够的资料,再进一步探索研究。
| [1] |
胡立群, 李红旗. 2017年高血压领域的争鸣与共识[J]. 中国临床保健杂志, 2018, 21(1): 4-6. DOI:10.3969/J.issn.1672-6790.2018.01.002 |
| [2] |
张宁. 高血压的病因以及临床治疗[J]. 中国社区医师, 2017, 33(2): 36-37. DOI:10.3969/j.issn.1007-614x.2017.2.21 |
| [3] |
陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2017》概要[J]. 中国循环杂志, 2018, 33(1): 1-8. |
| [4] |
吴云茜. 高血压病的中西医结合临床研究进展[J]. 中国卫生产业, 2014, 11(10): 192-193. |
| [5] |
张锦, 徐宗佩. 清肝通络饮治疗肝火型高血压病30例[J]. 环球中医药, 2016, 9(2): 224-226. DOI:10.3969/j.issn.1674-1749.2016.02.036 |
| [6] |
李正欢, 张晓云. 高血压动物模型应用概况与研究进展[J]. 中华高血压杂志, 2017, 25(8): 727-732. |
| [7] |
邓冬, 赵慧辉, 李雪丽, 等. 五味降压散对自发性高血压大鼠血压、血脂的影响[J]. 中医学报, 2017, 32(9): 1679-1682. |
| [8] |
Zhi BH, Chang F, Mao HL, et al. Valsartan improves the electrophysiological characteristics of left ventricular hypertrophic myocardium in spontaneously hypertensive rats[J]. Hypertension Research, 2014, 37(9): 824-9. DOI:10.1038/hr.2014.85 |
| [9] |
李建橡, 马晓聪, 邓学, 等. 高血压不同种属动物模型的研究近况[J]. 广西中医药大学学报, 2016, 19(3): 75-78. |
| [10] |
Barbosa HM, Nascimento JN, Araújo TA, et al. Acute toxicity and cytotoxicity effect of ethanolic extract of SPondias tuberosa arruda bark:hematological, biochemical and HistoPathological evaluation[J]. Annals of the Brazilian Academy of Science, 2016, 88(3): 1993-2004. |
| [11] |
Ghadirkhomi A, Safaeian L, Zolfaghari B, et al. Evaluation of acute and sub-acute toxicity of Pinus eldarica bark extract in Wistarrats[J]. Avicenna Journal of Phytomedicine, 2016, 6(5): 558-566. |
| [12] |
李正欢, 张晓云. 高血压动物模型应用概况与研究进展[J]. 中华高血压杂志, 2017, 25(8): 727-732. |
| [13] |
黄冬梅, 郑文武, 李秀英. 实验性高血压大鼠模型制备方法及应用概述[J]. 现代医药卫生, 2017, 33(3): 379-381. DOI:10.3969/j.issn.1009-5519.2017.03.020 |
| [14] |
李正欢, 张晓云. 高血压经典动物模型实际应用概况[J]. 临床心血管病杂志, 2017, 33(10): 934-937. |
| [15] |
吴兵兵, 吴帆, 何易晓, 等. 高血压病动物模型的研究进展及评价[J]. 检验医学与临床, 2014, 11(20): 2915-2916, 2919. DOI:10.3969/j.issn.1672-9455.2014.20.053 |
| [16] |
董幸, 潘燕, 孟延, 等. 尾套法与颈动脉法测量大鼠血压的相关性研究[J]. 实验室研究与探索, 2008(5): 53-55. DOI:10.3969/j.issn.1006-7167.2008.05.018 |
| [17] |
Flesch G, Müller P, Lloyd P. Absolute bioavailability and pharmacokinetics of valsartan, an angiotensin Ⅱ receptor antagonist, in man[J]. Eur J Clin Pharmacol, 1997, 52: 115-120. DOI:10.1007/s002280050259 |
| [18] |
国家卫生计生委合理用药专家委员会, 中国医师生协会高血压专业委员会. 高血压合理用药指南(第2版)[J]. 中国医学前沿杂志(电子版), 2017, 9(7): 28-126. |
| [19] |
刘淑芝. 原发性高血压中医证型与发病季节相关性问卷调查[J]. 实用中医内科杂志, 2015, 29(11): 6-8. |
| [20] |
李秋爽, 曹毅, 季聪华, 等. 中药安慰剂质量评价思考[J]. 中华中医药杂志, 2017, 32(6): 2365-2368. |
| [21] |
黄庆花, 肖静, 孙艳梅, 等. 中药复方安慰剂的制作方法及质量评价[J]. 中医杂志, 2015, 56(15): 1294-1297. |
| [22] |
王晓涛, 崔学军, 王拥军, 等. 安慰剂效应与安慰剂组学的研究与思考[J]. 世界科学技术-中医药现代化, 2016, 18(12): 2043-2048. DOI:10.11842/wst.2016.12.003 |
| [23] |
Sun T, Xu H, Xu F. Astragalus injection for hypertensiverenal damage:a systematic review[J]. Evid Based Com plement Alternat Med, 2012. DOI:10.1155/2012/929025 |
| [24] |
翟桂兰, 祝焕林, 王庆茹, 等. 缬沙坦对心力衰竭患者心室重构的影响[J]. 心脏杂志, 2005(6): 567-569, 572. DOI:10.3969/j.issn.1009-7236.2005.06.020 |
| [25] |
Barbosa HM, Nascimento JN, Araújo TA, et al. Acute toxicity and cytotoxicity effect of ethanolic extract of SPondias tuberosa arruda bark:hematological, biochemical and histopathological evaluation[J]. Annals of the Brazilian Academy of Science, 2016, 88(3): 1993-2004. |
| [26] |
Ghadirkhomi A, Safaeian L, Zolfaghari B, et al. Evaluation of acute and sub-acute toxicity of Pinus eldarica bark extract in Wistarrats[J]. Avicenna Journal of Phytomedicine, 2016, 6(5): 558-566. |
| [27] |
李迎, 崔晓霞, 尚世臣, 等. 不同样本和方法对测定大鼠血液生化指标的影响[J]. 中国比较医学杂志, 2017, 27(10): 7-9. |
| [28] |
孟令仪, 张晶莹, 吴晓刚, 等. 对Wistar大鼠30d喂养试验血液学及血生化指标参考值的研究[J]. 医学动物防制, 2017, 33(12): 1282-1285. DOI:10.7629/yxdwfz201712017 |
| [29] |
刘婷, 刘师卜, 单纯, 等. 大鼠性别及血清保存条件对生化检测结果的影响研究[J]. 标记免疫分析与临床, 2017, 24(3): 326-330, 313. |
 2018, Vol. 37
2018, Vol. 37