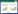文章信息
- 顾莅冰, 陈正鑫, 蒋泽砚, 马好, 樊志敏
- GU Libing, CHEN Zhenxin, JIANG Zeyan, MA Hao, FAN Zhimi
- 参麦注射液协同奥沙利铂抗结肠肿瘤作用
- Effect of Shenmai injection combined with oxaliplatin on colon cancer
- 天津中医药大学学报, 2018, 37(6): 449-454
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(6): 449-454
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.06.03
-
文章历史
收稿日期: 2018-09-11
2. 南京市中医院, 南京 210000
2. Nanjing Hospital of traditional Chinese medicine, Nanjing 210000, China
众所周知,与前代铂类药物相比第3代铂类药物奥沙利铂治疗消化系统肿瘤具有高效、低毒的特点[1],但广泛存在的对血液、神经系统的毒副反应以及对肠道肿瘤的敏感性相对较低等缺点限制了奥沙利铂在结直肠恶性肿瘤治疗中的长期应用。源于明朝秦景明《证因脉治》的参麦注射液,由红参和麦门冬两味中药佐以多种辅料制成的具有益气养阴生津功效的中药复方制剂,目前临床上广泛运用于气阴亏虚型胃肠道恶性肿瘤的治疗。现代药理学认为参麦注射液所具有的抗血管生成作用对奥沙利铂治疗肠道恶性肿瘤有增效减毒的辅助作用[2],而其作用机制尚不十分明了。本实验用人结肠癌LOVO细胞株建立裸鼠移植瘤模型以探讨参麦注射液联合奥沙利铂对结肠恶性肿瘤的抑制作用。
1 材料与方法 1.1 材料 1.1.1 动物与瘤株健康雄性BALB/c-un小鼠32只,4~6周龄,体质量16~18 g,购自上海斯莱克实验动物有限责任公司,许可证号码:SCXK(沪)2017-0005,饲养于南京中医药大学动物实验中心SPF屏障系统的洁净层流架内,温度(27±1)℃,相对湿度40%~60%。实验用裸鼠所用的水、食物、垫料等均经过灭菌处理。结肠腺癌LOVO细胞, 购自上海中国科学院细胞库,由南京市中医院中心实验室培养。
1.1.2 主要试剂参麦注射液(正大青春宝药业,生产批号:1701188);奥沙利铂注射液(艾恒,江苏恒瑞医药股份有限公司生产,生产批号:170728AG);免疫组织化学试剂:碱性成纤维细胞生长因子(b-FGF)一抗(abcam公司,产品编号:ab8880);Expose兔specific HRP/DAB detection IHC试剂盒(abcam公司,产品编号:ab80437);CD31一抗(迈新公司,产品编号:MAB-0031);二抗试剂盒(迈新公司,产品编号:kit-9922)。
1.1.3 主要仪器CO2培养箱(美国Thermo公司);全自动生化分析仪Labospect003(日立公司);FAHO4N电子天平(上海精密科学仪器有限公司);IX51倒置相差显微镜(日本Olympus公司);MIKR- O22R1110型高速冷冻离心机(离心半径20 cm,德国Zentrifugen公司);CM1100型组织切片机(德国莱卡公司)。
1.2 方法 1.2.1 造模在无菌操作环境下将传代后稳定培养24 h的LOVO细胞悬液,以1×107个/mL、0.2 mL/只的细胞悬液浓度接种于裸鼠右腋皮下。
1.2.2 分组按随机数字表法将32只Balb/c-nu雄性裸鼠(4~6周龄)按数字表法随机分为4组,生理盐水组(NC组)因为给药后第13天出现2只小鼠死亡,故NC组初始时为8只,实验结束时为6只。奥沙利铂组(OX组8只),参麦注射液组(SM组8只),参麦注射液+奥沙利铂组(SM+OX组8只)。
1.2.3 给药皮下注射肿瘤细胞悬液2周后, SM组予以每日腹腔注射参麦注射液0.1 mL/10 g,OX组予以奥沙利铂腹腔注射8 mg/kg,0.1 mL/次(1、5、9、13 d),SM+OX组予以每日腹腔注射参麦注射液0.1 mL/10 g,并予奥沙利铂腹腔注射8 mg/kg,0.1 mL/次(1、5、9、13 d),NC组腹腔注射等体积的生理盐水。
1.2.4 记录各给药组对肿瘤的影响从各组给药之日起,每隔1日对裸鼠称质量并用游标卡尺对肿瘤的长径(a)和短径(b)进行测量以计算肿瘤体积(V)。公式如下:V=(ab2)/2。绘制肿瘤生长曲线,比较各组小鼠用药前后肿瘤体积变化。
1.2.5 计算抑瘤率裸鼠处死后摘取瘤体和脾脏组织并称取质量,计算肿瘤抑制率。抑瘤率(%)=(1-实验组平均瘤质量/对照组平均瘤质量)×100%;按金正均法判断两药合用的效果:q=Ea+b/(Ea+Eb-Ea×Eb)。
1.2.6 取出瘤组织,进行样本制备用于免疫组化样本置于10%中性缓冲甲醛溶液中;部分瘤组织进行冰冻切片并苏木精-伊红(HE)染色,显微镜下观察各组病理切片细胞形态学的变化。
1.2.7 取脾组织,观察各用药组对免疫器官的影响脾指数=裸鼠脾质量(mg)/裸鼠体质量(g)。
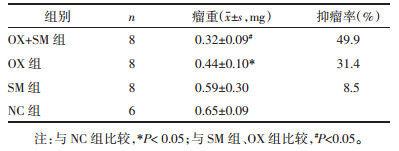
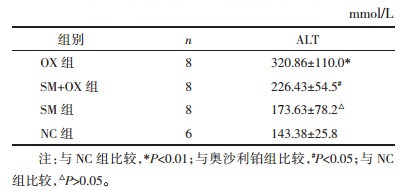
1.2.8 肝、肾功能检测摘眼球釆血。测定肝功能天门冬氨酸基转移酶(ALT)、丙氨酸氨基转移酶(AST)、肾功能尿素氮(BUN),肌酐(Scr)。
1.2.9 Elivison二步法免疫组化测定b-FGF、CD31的表达变化。
1.2.10 统计学分析应用SPSS24.0进行数据分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法,P < 0.05为差异有统计学意义。

|
| a:NC组;b:SM组;c:OX组;d:SM+OX组 图 1 给药14 d后各组肿瘤大小 |
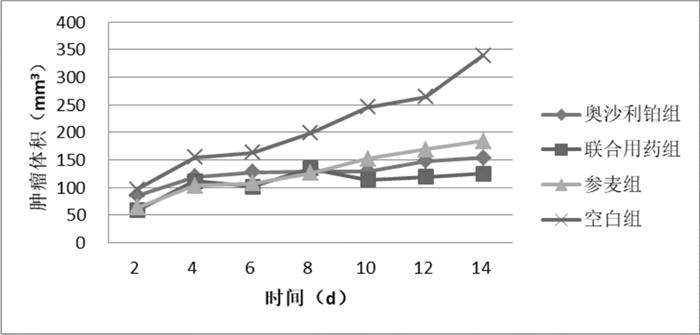
自药物注射之日起, 每日观察肿瘤组织的形态变化。初始肿瘤组织较小且移动度良好,呈不规则形,表面布满血管, 此后肿瘤包块较前逐渐增大,肿瘤组织呈类圆形或不规则形,质硬,活动度较差。给药第13天生理盐水组出现2只小鼠死亡。各组移植瘤的生长曲线如图 2所示。
|
| 图 2 各组肿瘤生长曲线 |
大体观察, NC组、SM组肿瘤体积较大, 增长明显, 多呈不规则形或类圆形,质地中等,活动度尚可,瘤体表面皮下可见血管网。OX组和OX+SM组瘤体体积与NC组和SM组相比较小,增长较为缓慢,至用药结束时,OX组和OX+SM组的肿瘤抑制率与NC组、SM组相比,差异有统计学意义(P<0.05)。OX+SM组与其他用药组相比,具有更高的肿瘤抑制率, 与SM组及OX组单独用药组相比差异有统计学意义(P<0.05),按金正均法计算q=1.64,说明参麦注射液联合奥沙利铂治疗后的效应为协同作用, 用药后各组抑瘤率见表 1。
小鼠颈椎脱臼法处死后取脾脏组织称取质量,观察给药组对免疫器官的影响,计算脾指数,结果见表 2所示:OX组和SM+OX组的脾指数较NC组明显下降,差异有统计学意义(P<0.05),SM+OX组脾指数OX组上升,SM组高于NC组,差异有统计学意义(P<0.05)。上述结果显示奥沙利铂对小鼠免疫器官功能有一定的负面影响。参麦注射液与奥沙利铂联合应用可以显著降低此负面影响。
小鼠摘眼球法取血后4 ℃,1 500转/min离心5 min,取上清置于全自动生化分析仪Labospect 003(日立公司)分析参麦注射液及奥沙利铂对小鼠肝肾功能的影响。
OX组血清ALT较NC组显著上升,差异有统计学意义(P<0.01),SM+OX组的血清ALT水平较OX组下降(P<0.05),SM组高于NC组,差异有统计学意义(P<0.05),见表 3。
OX组血清AST较NC组显著上升, 差异有统计学意义(P<0.01),SM组、SM+OX组的血清ALT水平较OX组有所下降(P<0.05),与NC组差异无统计学意义(P>0.05),见表 4。
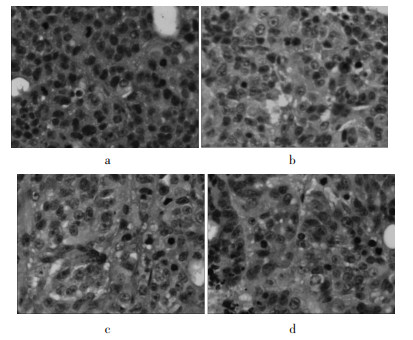
|
| a:NC组;b:OX组c:SM组d:SM+OX组 图 7 HE染色肿瘤组织切片 |
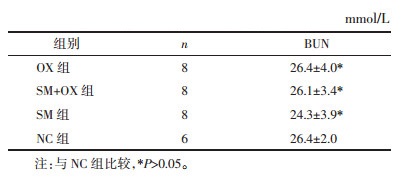
各组血清BUN表达水平与NC组差异无统计学意义(P>0.05)。SM组、SM+OX组BUN水平(表 5)较OX组亦无统计学意义(P>0.05)。上述结果显示参麦注射液与奥沙利铂单独给药组及联用给药组荷瘤裸鼠肾功能无显著差异,表明参麦注射液和奥沙利铂单独给药对荷瘤裸鼠肾脏无明显毒性,且两药合用也不增加对裸鼠肾脏的毒性。奥沙利铂单独用药对小鼠肝功能有一定的毒副作用,参麦注射液能显著减轻其对肝脏的毒性。
经HE染色后, 光镜下可见空白组瘤细胞呈圆形或椭圆形、多角形,体积较大,胞核深染,核浆比较大,核分裂相多见,核固缩较少。参麦注射液组和参麦注射液联合奥沙利铂组细胞形态各异,核固缩较多,核分裂较少,瘤组织有不同程度的坏死。
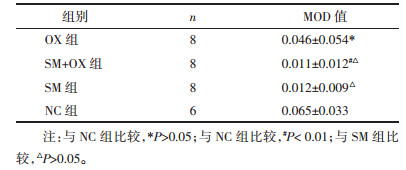
2.5 免疫组织化学法检测参麦注射液联合奥沙利铂对b-FGF蛋白表达的影响蛋白表达强度通过专业图像分析软件Image Pro Plus 6.0(IPP)计算平均光密度(MOD)值来表达。公式如下:MOD=sum(IOD)/sum(area)。MOD值越高,表达越强。
OX组MOD较NC组无明显下降,差异无统计学意义(P>0.05),SM+OX组及SM组MOD较空白对照组显著下降(P<0.01),SM+OX组与SM组MOD差异无统计学意义(P>0.05)。上述结果显示参麦注射液能显著降低肿瘤组织局部b-FGF的表达。见表 6、图 8。
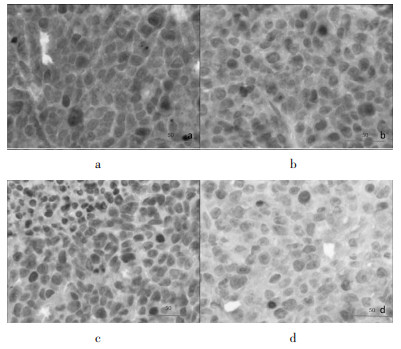
|
| a:NC组;b:OX组;c:SM组;d:SM+OX组 图 8 高倍镜下各组b-FGF表达水平(×400倍) |
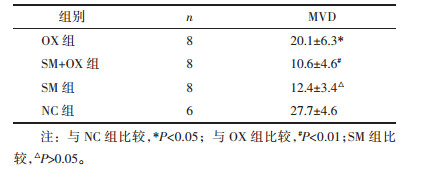
对热点区域CD31阳性的血管内皮细胞采取WEIDNER MVD计数方法进行微血管计数[2]。
OX组MVD较NC组有所下降,差异有统计学意义(P<0.05),SM+OX组及SM组MVD较NC组显著下降(P<0.01),SM+OX与SM组MVD差异无统计学意义(P>0.05)。上述结果显示示参麦注射液能显著降低肿瘤组织局部微血管密度。见图 10,图 11,表 7。

|
| a:NC组;b:OX组;c:SM组;d:SM+OX组 图 10 低倍镜下CD31表达阳性微血管(×100倍) |

|
| a:NC组;b:OX组;c:SM组;d:SM+OX组 图 11 高倍镜下CD31表达阳性微血管(×400倍) |
近年来发病率呈上升趋势[3]的结肠癌是临床常见的恶性肿瘤。以DNA为靶点杀伤肿瘤细胞[4]的奥沙利铂是其标准治疗用药。奥沙利铂与顺铂等1、2代铂类药物相比具有效率高不良反应小的特点,但仍然存在对肠道肿瘤细胞敏感度低[5]及骨髓抑制、神经毒性等诸多不足,直接影响了其长期应用。中医学认为肿瘤属本虚标实,患者素体气血已虚,而化疗药物之药毒多湿热,瘀阻脉络,煎迫津液,耗气伤血,使本虚益甚。临床研究[6-9]已经发现益气养阴之参麦注射液具有增强化疗效果降低化疗不良反应的功效,而参麦注射液与奥沙利铂合用增效减毒的作用机制尚不完全明确。进一步研究参麦注射液抗结直肠肿瘤及与化疗药物的协同作用机制有助于为临床治疗结直肠恶性肿瘤提供新的思路,降低化疗不良反应,提高肿瘤患者生活质量,延长患者生命。
本实验构建裸鼠移植瘤模型以探究参麦注射液辅助奥沙利铂治疗结肠恶性肿瘤的作用机制。结果表明,SM组对裸鼠移植瘤的生长抑制作用不明显,OX组、OX+SM组对裸鼠移植瘤的生长均有明显抑制作用,OX+SM组较OX组作用更为显著。肿瘤细胞局部微血管生成在肿瘤发生中扮演了重要角色,而参麦注射液协同奥沙利铂可使肿瘤细胞局部微血管生成减少,抑制肿瘤的增殖与转移。
血管生成,即从已存在的血管中生成新血管。休眠小肿瘤启动血管生成时(简称“血管生成开关”),会分泌刺激因子,诱导内皮细胞芽生和趋化,使小肿瘤长成肿瘤团块[10-12]。
在肿瘤团块的内部缺氧环境中,转录因子缺氧诱导因子-1(HIF-1)得以保持稳定,并激活众多参与血管生成过程基因的表达。HIF-1可诱导的蛋白质,包括血管内皮生长因子(VEGF)和b-FGF [13-14]。
VEGF与靶细胞受体结合后产生级联放大效应,通过PI3K/AKT信号通路等促进血管渗透性增加,加剧局部的缺血缺氧,进一步促使肿瘤微血管生成,形成缺氧-血管生成-缺氧的恶性循环;b-FGF通过自分泌或旁分泌的途径与靶细胞表面受体结合,激活下游多种生物因子与蛋白激酶的生物活性,促进内皮细胞生长,直接促进血管生成[15-16]。
分布于脉管细胞上上的CD31与血管的形成密切相关,可以直观表达血管生成密度。本实验表明,参麦注射液可协同奥沙利铂抑制结肠癌肿瘤细胞的生长,下调b-FGF表达,抑制肿瘤局部微血管的生成并能降低奥沙利铂对脾脏、肝脏的毒副反应。光镜观察可见,参麦注射液组、奥沙利铂组及联合给药组裸鼠肿瘤细胞核固缩较模型组显著,核分裂较少,提示参麦注射液与奥沙利铂可能通过减少肿瘤细胞局部微血管生成发挥体内抗肿瘤作用。
综上,参麦注射液可能通过下调b-FGF相关的信号通路协同奥沙利铂发挥对肿瘤组织生长的抑制作用,并能减轻奥沙利铂对肝功能及免疫器官的不良反应。参麦注射液减轻奥沙利铂对脾脏的毒副作用可能是两药联合使用降低化疗药物不良反应的关键,其作用机制有待进一步研究。
| [1] |
邓颖. 奥沙利铂的药理作用及临床应用[J]. 吉林医学, 2011, 32(18): 707. |
| [2] |
Mashino K, Sadanaga N, Yamaguchi H, et al. Expression of chemokine receptor CCR7 is associated with lymph node metastasis of gastric carcinoma[J]. Cancer Res, 2002, 62(9): 2937-2941. |
| [3] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA CancerJ Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [4] |
李康保. 奥沙利铂联合5-FU、CF治疗老年Ⅲ期结肠癌的临床分析[J]. 临床医学工程, 2011, 18(3): 345-346. DOI:10.3969/j.issn.1674-4659.2011.03.0345 |
| [5] |
魏可芸. 奥沙利铂联合5-氟尿嘧啶和亚叶酸钙治疗晚期胃癌、大肠癌疗效观察[J]. 中国社区医师, 2010, 12(230): 30. |
| [6] |
吴驻林, 谭婉君, 潘沙沙, 王李安安, 张维晴, 彭立生. 中药注射液联合含奥沙利铂化疗方案治疗大肠癌的网状Meta分析[J]. 中国实验方剂学杂志, 2017, 23(13): 203-211. |
| [7] |
雍金鹏.参麦注射液联合替吉奥治疗气阴两虚型消化道肿瘤的临床研究[D].郑州: 河南中医药大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10471-1016324587.htm
|
| [8] |
樊斌.参麦注射液联合mFOLFOX4化疗治疗Ⅱ、Ⅲ期大肠癌的临床研究[D].大连: 大连医科大学, 2016.
|
| [9] |
文亢, 李俊. 参麦注射液联合FOLFOX方案治疗结直肠癌的临床研究[J]. 陕西中医, 2015, 36(1): 3-6. DOI:10.3969/j.issn.1000-7369.2015.01.001 |
| [10] |
Folkman J. Angiogenesis:an organizing principle for drug discovery[J]. Nature Reviews Drug Discovery, 2007, 6(4): 273. DOI:10.1038/nrd2115 |
| [11] |
Guo C, Annicole B, Devanand S, et al. The role of tumor-associated macrophages in tumor vascularization[J]. Vascular Cell, 2014, 6(1): 2. DOI:10.1186/2045-824X-6-2 |
| [12] |
Klagsbrun M, Eichmann A. A role for axon guidance receptors and ligands in blood vessel development and tumor angiogenesis[J]. Cytokine & Growth Factor Reviews, 2005, 16(4-5): 535-548. |
| [13] |
Raza A, Franklin MJ, Dudek AZ. Pericytes and vessel maturation during tumor angiogenesis and metastasis[J]. American Journal of Hematology, 2010, 85(8): 593. DOI:10.1002/ajh.v85:8 |
| [14] |
Sakurai T, Kudo M. Signaling pathways governing tumor angiogenesis[J]. Oncology, 2011, 1(1): 24-29. |
| [15] |
Senger DR, Davis GE. Angiogenesis[J]. Cold Spring Harbor Perspectives in Biology, 2011, 3(8): 90. |
| [16] |
Shi L, Zhang N, Liu H, et al. Lysyl oxidase inhibition via β-aminoproprionitrile hampers human umbilical vein endothelial cell angiogenesis and migration in vitro[J]. Molecular Medicine Reports, 2018, 17(4): 5029-5036. |
| [17] |
Ying C, Lei Z, Liu W X, et al. VEGF and SEMA4D have synergistic effects on the promotion of angiogenesis in epithelial ovarian cancer[J]. Cellular & Molecular Biology Letters, 2018, 23(1): 2. |
 2018, Vol. 37
2018, Vol. 37