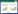文章信息
- 张宁, 边育红, 张嘉丽, 李薇, 宋新波
- ZHANG Ning, BIAN Yuhong, ZHANG Jiali, LI Wei, SONG Xinbo
- 羊胎盘肽对L6成肌细胞增殖能力和ATP浓度的影响
- Cell proliferation and ATP levels of myoblast after treated with sheep placenta peptide
- 天津中医药大学学报, 2018, 37(6): 488-493
- Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(6): 488-493
- http://dx.doi.org/10.11656/j.issn.1673-9043.2018.06.12
-
文章历史
收稿日期: 2018-07-24
2. 天津中一制药有限公司, 天津 300193
2. Tianjin Zhong Yi Pharmaceatical CO. Ltol., Tianjin 300193, China
羊胎盘是连接母羊和胎儿,进行血液以及养分交换的组织,胎儿能够从胎盘中获得生长发育的各种养分,也是通过胎盘排泄自身的代谢产物。据《本草纲目》[1]记载:“羊胎,母羊腹中的胎兽,性味甘温,具有益气补虚,温中暖下,调补肾虚、羸瘦之功效。”现代研究表明,羊胎盘具有调节机体免疫[2]、抗氧化[3]、抗疲劳[4]、保护皮肤[5]、提高消化功能[6]等作用。同时羊胎盘中含有丰富的微量元素和氨基酸、表皮生长因子等生物活性物质,并且有研究发现[7],羊胎盘较其它动物胎盘,与人胎盘的结构和成分最为相似,另外,羊胎盘不会感染肝炎等病毒,不会与人类产生交叉感染,因此羊胎盘成为动物胎盘中能够替代人胎盘的首选种类,在一定程度上有效解决了人类胎盘的数量紧缺以及使用的伦理问题。
本课题组将羊胎盘组织进行酶解制备羊胎盘肽粗品,按照《保健食品检验与评价技术规范》(2003版)[8]中的规定,以小鼠负重游泳模型初步考察了其抗疲劳活性。多肽的分子量往往影响了其活性,有研究表明小分子肽,生物利用度更高,为了明确羊胎盘肽中的主要作用成分,便于后期的定向制备,提高羊胎盘肽的品质和质量,文章在前期的研究基础上,将羊胎盘肽进行分子量分布分析,划分为不同的分子量段,以噻唑蓝(MTT(法筛选出不同分子量段的羊胎盘肽对骨骼肌成肌细胞的加药浓度,并且比较了对L6细胞中三磷酸腺苷(ATP)浓度的影响。
1 材料和仪器 1.1 材料与试剂大鼠L6骨骼肌成肌细胞购自贝尔格莱科技(天津)有限公司;高糖DMEM细胞培养基和PBS购自Hyclone公司;青霉素-链霉素混合液(双抗)、胰蛋白酶和胎牛血清购自BI公司;MTT、DMSO购自Solarbio公司;细胞培养瓶(25 cm2,75 cm2)、离心管(15 mL,50 mL)、6孔板和96孔板购自Corning Costar公司;离心管(1.5 mL)购自Axygen公司;增强型ATP检测试剂盒购自上海碧云天生物技术有限公司;乙腈购自Fisher公司;三氟乙酸购自博欧特(天津)化工贸易有限公司;甘氨酸(Mr 75.05)购自上海源叶生物技术有限公司;乙氨酰乙氨酰乙氨酸(Mr 189.1)、乙氨酰乙氨酰酪氨酰精氨酸(Mr 451.2)、人血管紧张素Ⅱ(Mr 1045.5)、胰蛋白酶抑制剂(Mr 6511)、细胞色素C(Mr 12355)均购自中国计量科学研究院。
1.2 设备与仪器高效液相色谱仪,日本岛津公司;TSK-GEL G2000SWxL凝胶色谱柱,日本东曹公司;冷冻干燥机,北京四环科学仪器厂;超净工作台,Thermo公司;超高速离心机,Thermo公司;二氧化碳培养箱,Thermo公司;酶标仪,Thermo公司;倒置显微镜,Nikon公司;Cellometer Mini全自动细胞计数仪,美国Nexcelom公司;恒温摇床,Thermo公司。
2 方法 2.1 羊胎盘肽粗品分子量分布分析 2.1.1 标准物质溶液的配制分别称取甘氨酸、乙氨酰乙氨酰乙氨酸、乙氨酰乙氨酰酪氨酰精氨酸、人血管紧张素Ⅱ、胰蛋白酶抑制剂、细胞色素C各2.5 g,精密称定,用超纯水于1 mL容量瓶中定容,按照等比例将6种溶液混匀,过0.45 μm滤膜,取续滤液,即得。
2.1.2 供试品溶液的配制取羊胎盘肽50 mg,精密称定,用超纯水于10 mL容量瓶中定容,过0.45 μm滤膜,取续滤液,即得。
2.1.3 色谱条件采用凝胶过滤色谱法测定羊胎盘肽的相对分子质量分布。色谱柱类型为TSK-GEL G2000SWxL凝胶色谱柱。流动相:乙腈-水-三氟乙酸(20:80:0.07,v/v/v)。流速:0.6 mL/min。柱温:30 ℃。进样体积:10 μL。检测波长:220 nm。
2.1.4 数据统计与分析采用Shimadzu GPC数据处理软件分析色谱图。
2.2 不同分子量段羊胎盘肽的制备按照“1.3.1”下的羊胎盘肽粗品分子量分布分析方法进行粗品的分段处理,收集相应分子量段的样品,进一步冷冻干燥,即得到不同分子量段的羊胎盘肽,分别命名为F1~F6。
2.3 大鼠L6骨骼肌成肌细胞培养实验所用细胞为从贝尔格莱科技(天津)有限公司购买的第4代L6成肌细胞。细胞培养基为含10 %胎牛血清和1%双抗的的高糖DMEM培养基。细胞增长至80%以上的时候进行传代。细胞培养环境为5% CO2,37 ℃培养箱。当细胞数量充足时,多余细胞用50%高糖DMEM、40%胎牛血清和10%DMSO配置的冻存液进行冻存。细胞计数采用Cellometer Mini全自动细胞计数仪。
2.4 大鼠L6骨骼肌成肌细胞增殖实验 2.4.1 MTT法测定细胞增殖取生长良好的大鼠L6骨骼肌成肌细胞,制备细胞浓度约1×105个/mL的L6成肌细胞悬液。于96孔细胞培养板中接种细胞,每孔100 μL,置于5% CO2,37 ℃培养箱中培养24 h。将96孔板中的培养基小心吸出并弃去,各加入100 μL用完全培养基稀释的不同浓度F1~F4(每组6个副孔),再置于5% CO2,37 ℃培养箱中培养24h。轻轻吸弃上清液,加MTT(5 mg/mL)10 μL/孔并继续培养4 h,然后加DMSO 150 μL/孔,充分振荡约5 min并静置20 min后用酶标仪检测在490 nm下的吸光度。
2.5 大鼠骨骼肌成肌细胞三磷酸腺苷(ATP)含量的测定 2.5.1 标准曲线的绘制用ATP检测裂解液稀释ATP标准溶液(0.5 mmol/L),配制成0.01、0.05、0.1、0.5、1、5、10 μmol/L浓度的ATP标准溶液(冰上操作)。
2.5.2 样品的准备取生长良好的大鼠L6骨骼肌成肌细胞,制备细胞浓度约1×105个/mL的L6成肌细胞悬液。然后接种于6孔板中,每孔2 mL,置于5% CO2,37 ℃培养箱中培养24 h。之后小心吸出培养基并弃去,以MTT法筛选出的药物浓度为基准,各孔加入2 mL用完全培养基稀释的F1~F4(每组6个副孔),再置于5% CO2,37 ℃培养箱中培养24 h。结束培养后,每孔加入1 mL胰蛋白酶,置于培养箱中孵育约1 min,直至大部分细胞被消化,然后每孔加入1 mL全培终止消化,并用移液枪小心吸取培养液吹打,尽量使细胞完全消化下来,并将各孔吸取至15 mL离心管中,1 000 r/min,离心5 min,弃去上清,用1 mL全培重悬,计数,再分别加入适量全培将各管细胞调整为相同的细胞密度,混匀,各取出1 mL细胞悬液至1.5 mL离心管中,6 000 r/min,离心5 min,弃去上清,每管加入200 μL ATP检测裂解液,用移液枪适度吹打,保证细胞能够充分裂解(冰上操作)。12 000 r/min,4 ℃,离心5 min,取上清液用于后续测定。
2.5.3 ATP浓度的测定以ATP检测试剂:ATP检测试剂稀释液1:4的比例配制ATP检测试剂工作液(须避光)。在ATP标准溶液孔和样品孔中各加入100 μL ATP检测试剂工作液,室温放置3~5 min,然后相应加入20 μL ATP标准溶液和样品,用移液枪头混匀,并且采用具有luminometer功能的酶标仪检测。
2.5.4 数据处理采用Graphpad prism 5进行方差分析,结果以均数±标准差(x±s)表示。检测各组平均值之间的显著性差异,P < 0.05和P < 0.01。
3 结果 3.1 羊胎盘肽粗品分子量分布分析凝胶色谱利用分子筛原理,较大分子量的物质先流出,而较小分子量的物质后流出,又称为排阻色谱,凝胶过滤色谱一般用于分离水溶性的物质,如多肽、蛋白、糖类等。近年来,凝胶过滤色谱法被广泛应用于多肽的分子量分布测定中[9-10],本研究以甘氨酸、乙氨酰乙氨酰乙氨酸、乙氨酰乙氨酰酪氨酰精氨酸、人血管紧张素Ⅱ、胰蛋白酶抑制剂、细胞色素C配制混标,按“2.1.3”下色谱条件进行测定,色谱图见图 1。
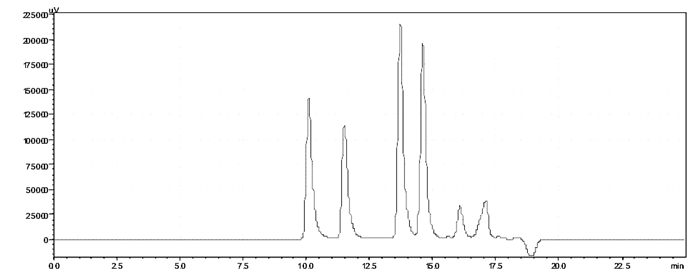
|
| 图 1 混合标准物质凝胶过滤色谱图 |
以6种标准物质相对分子质量对数lgM对保留时间t做线性回归,得到回归方程lgM=-0.323 1t+7.432 2,r=0.996 9,说明在相对分子质量75.05~12 355范围内,6种标准物质相对分子质量对数与保留时间呈良好的线性关系,标准曲线见图 2。
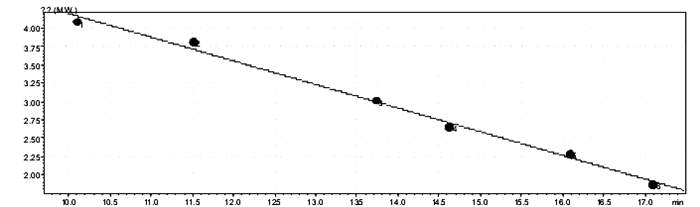
|
| 图 2 混合标准物质相对分子质量标准曲线 |
将羊胎盘粗品按“2.1.3”下色谱条件进行测定,色谱图见图 3。
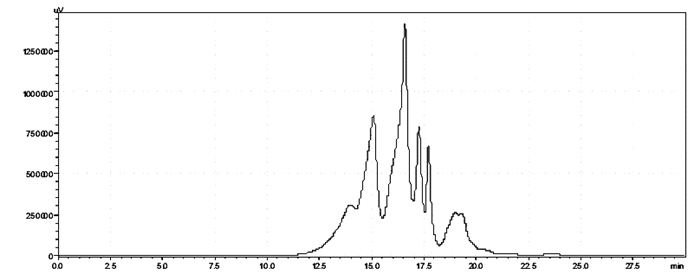
|
| 图 3 羊胎盘肽粗品凝胶过滤色谱图 |
将羊胎盘肽粗品进行分子量分布分析,按照峰的个数划分为F1~F6,其中F3占有总量面积最大,其次为F2,再次为F1。由于氨基酸的平均分子量为110,最小氨基酸为甘氨酸,其分子量为75.05,可以推测出F5和F6已不再是小肽或者氨基酸,不作为后续实验的研究对象。详细分子量分布见表 1。
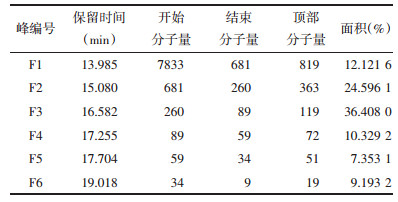
MTT法常用于筛选各种细胞株加药浓度[11],本文参考Rekik等[12]设定的羊胎盘肽浓度,将冻干后得到的F1~F4配制成20、40、60、80、100 μg/mL不同浓度的样品加药浓度为0 μg/mL的作为对照组,MTT结果见表 2。
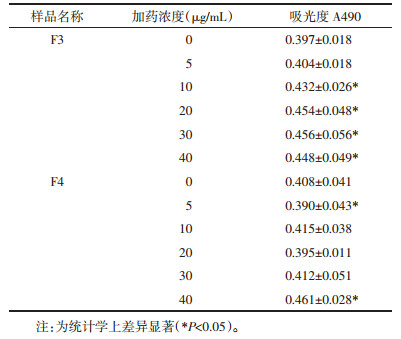
从表 2可以看出,F4对L6细胞的增殖出现了轻微抑制作用,而F1、F2、F3则出现了不同程度的促进作用,其中F3从20 μg/mL就出现了明显的促进增殖作用(P < 0.05),40 μg/mL以及更大的浓度梯度时,F3的促增殖作用极其显著(P < 0.01)。F3在20 μg/mL时具有促进增殖作用(P < 0.05),而F4在20 μg/mL时具有抑制增殖作用(P < 0.05)。实验为了研究在不影响细胞增殖能力的前提下,羊胎盘肽对细胞中ATP浓度的影响,初步确定除F3和F4外,其余组分的浓度确定为20 μg/mL。F3和F4进行再一次的MTT实验,将浓度梯度进行细化,实验结果见表 3。结合表 3的结果,将F3浓度确定为5 μg/mL,将F4浓度确定为20 μg/mL来进行后续的ATP测定实验。
测定不同浓度的ATP标准溶液,标准曲线如图 4。Y=8449.6X+1027.7,R2=0.999 6,ATP浓度在0.01~10 μmol/L范围内线性关系良好。
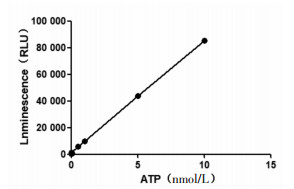
|
| 图 4 ATP标准曲线 |
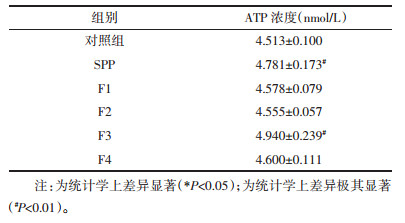
ATP是重要的信号分子,当其发生水解时,形成ADP并释放一个磷酸根,同时释放能量,对于人类和动物来说,呼吸作用是产能的主要方式。ATP是肌肉收缩、神经活动以及生物体内的其他一切活动能量的主要来源,参与了多个组织和系统的不同效应,包括参与神经传导和发育,参与伤害感受、听觉、视觉、味觉功能,参与血小板凝集、平滑肌收缩/舒张及免疫反应,调节肺及心血管功能等[13],另外有研究发现ATP还参与了如细胞增殖、分化、迁移以及死亡等[14]。因此ATP浓度能够直观地反映出药物对于机体或细胞能量代谢的影响。刘秀娜等[15]以ATP浓度为检测指标之一研究了益气活血复方对心肌梗死后慢性心力衰竭(CHF)大鼠心肌能量代谢的影响。从本实验ATP检测结果可以看出,如表 4,在选定的未影响细胞增殖能力的药物浓度时,与未加入任何药物的空白对照组比较,羊胎盘肽中的各个组分的ATP浓度都出现了升高,其中羊胎盘肽SPP和F3的促进作用极其显著(P < 0.01),并且F3组较SPP组的ATP浓度要更高,说明F3是SPP中的主要活性成分。
一般将2~9个氨基酸组成的称为寡肽,其中2~4个氨基酸组成的寡肽称为小分子肽或小肽。小分子肽相对于氨基酸和蛋白质来说,生物活性更好,对于机体而言具有吸收速度快、耗能低,生物利用度高等优点,因此成为了近年来的研究热点,涉及医药、保健食品、化妆品等多个领域。
经本课题组前期研究发现,羊胎盘肽具有良好的抗疲劳作用,能够有效延长小鼠负重游泳时间,本实验首先采用凝胶过滤色谱法将羊胎盘肽粗品进行分离收集、冻干,根据氨基酸的分子量估算,F5和F6已经不再是氨基酸或者小分子肽,可能是一些杂质或者不适于本凝胶过滤色谱柱的某些成分,因此并不作为本研究的研究对象。从能量代谢的角度进一步研究羊胎盘肽不同分子量段对于大鼠L6骨骼肌成肌细胞增殖能力的影响以及对其细胞中ATP浓度的影响,结合分子量分布,可以推测出羊胎盘肽中的寡肽能够不同程度的促进骨骼肌成肌细胞的增殖。
本实验通过MTT法筛选了不同分子量羊胎盘肽的加药浓度,并且考察了各个肽段对大鼠L6骨骼肌成肌细胞ATP浓度的影响,结果显示F3为羊胎盘肽中的主要活性成分,验证了机体对于二肽和三肽的吸收利用的确优于氨基酸和较大分子量的肽段和蛋白质。同时本研究也为后期的定向酶法制备或者合成提供理论基础。通过加入酶的种类、调整酶解条件来使F3的得率更高,有助于提高羊胎盘肽的品质以及羊胎盘原料的利用度。或者经过质谱鉴定F3中的主要肽段种类和结构,通过化学合成专属性得到此分子量段的小分子肽,将其应用于抗疲劳药品或保健食品的开发。
| [1] |
李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 1975.
|
| [2] |
周洁静, 侯银臣, 刘旺旺, 等. 羊胎盘提取残余物免疫肽制备工艺的优化[J]. 食品与发酵工业, 2015, 41(3): 129-134. |
| [3] |
姜惠敏.羊胎盘抗氧化肽的制备及其在抗衰老化妆品中的应用[D].无锡: 江南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10295-1016261314.htm
|
| [4] |
蒋腾川.羊胎盘肽的酶法制备及抗疲劳活性研究[D].天津: 天津中医药大学, 2013.
|
| [5] |
董泉洲, 尚尔和, 王小惠, 等. 羊胎盘营养液的制备及其在化妆品中的应用[J]. 日用化学工业, 1998, 5(1): 12-13. |
| [6] |
徐静娟, 朱明, 邓立. 羊胎盘保健食品的功效研究[J]. 食品工业科技, 2002, 17(1): 89-93. |
| [7] |
WU Yun. Study on the new method of extraction placental peptide and analysis of nutritive composition in sheep's placenta[J]. Food Science, 2005, 26(9): 295-297. |
| [8] |
中华人民共和国卫生部.保健食品检验与评价技术规范: 2003版[M].北京, 中国卫生监督出版社, 2003: 87-93.
|
| [9] |
胡二坤, 郭兴凤, 刘洁. 凝胶过滤色谱分离纯化玉米蛋白酶解产物研究[J]. 粮食与油脂, 2017, 30(7): 94-98. DOI:10.3969/j.issn.1008-9578.2017.07.023 |
| [10] |
蒋腾川, 宋新波, 张丽娟. 凝胶过滤色谱法测定3种不同来源多肽的相对分子质量分布[J]. 食品科学, 2014, 35(24): 312-315. DOI:10.7506/spkx1002-6630-201424060 |
| [11] |
孙晓辉, 王懿, 张艳. 参草通脉颗粒影响慢性心力衰竭大鼠血栓形成的实验研究[J]. 天津中医药大学学报, 2016, 35(5): 314-317. |
| [12] |
Muluye RA, Bian YH, Wang L, et al. Placenta Peptide Can Protect Mitochondrial Dysfunction through Inhibiting ROS and TNF-a Generation, by Maintaining Mitochondrial Dynamic Network and by Increasing IL-6 Level during Chronic Fatigue[J]. Frontiers in Pharmacology, 2016, 7(328): 1-8. |
| [13] |
Burnstock G. Purinergic signalling:from discovery to current developments[J]. Exp Physiol, 2014, 99(1): 16-34. DOI:10.1113/expphysiol.2013.071951 |
| [14] |
方伟岗, 田新霞. 肿瘤微环境中一种新型促侵袭因子的发现——细胞外ATP功能及机制的研究进展[J]. 北京大学学报(医学版), 2017, 49(2): 188-195. DOI:10.3969/j.issn.1671-167X.2017.02.002 |
| [15] |
刘秀娜, 张艳, 礼海. 益气活血复方对心肌梗死后慢性心力衰竭大鼠心肌能量代谢的影响[J]. 天津中医药大学学报, 2015, 34(1): 23-26. |
 2018, Vol. 37
2018, Vol. 37