文章信息
- 张媛, 毛浩萍, 樊官伟
- ZHANG Yuan, MAO Haoping, FAN Guanwei
- 丹参酮ⅡA药理作用研究进展
- Recent advances in study of Dan shen(salviamiltiorrhiza)
- 天津中医药大学学报, 2019, 38(1): 15-19
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(1): 15-19
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.01.05
-
文章历史
收稿日期: 2018-11-20
2. 天津中医药大学方剂学教育部重点实验室, 天津 300193
2. Ministry of Education Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Tianjin 300193, China
丹参是唇形科鼠尾草属多年生草本植物,以根入药,具有活血化瘀、调经止痛、祛瘀生新等功效,对冠心病等有良好的疗效,目前在冠心病、高血脂、高血压等治疗中被大量使用,其化学成分主要分为脂溶性和水溶性两类,研究发现丹参具有抗氧化、抑制血小板聚集和抗凝血、抑制平滑肌细胞的增殖和迁移、扩张冠状动脉及抗炎作用[1-2],因此开发丹参的药用价值、完善丹参的药理作用研究是很有意义的工作,文章对丹参中脂溶性成分丹参酮ⅡA药理作用进行概述,为进一步研究丹参的作用机制及药物的开发提供理论依据。
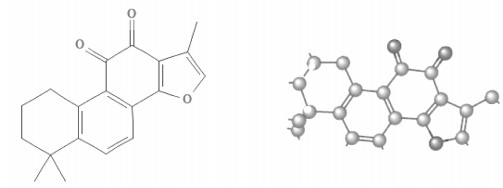
1 药理作用丹参是中国传统的活血化瘀药,丹参酮ⅡA是丹参中的脂溶性成分的代表,集中分布在丹参根的皮部,木质部没有或甚微。丹参酮ⅡA(CAS:568-72-9)为一种樱红色针状结晶,分子量为294.34,不溶或微溶于水,易溶于二甲基亚砜、乙醇、丙酮、乙醚和苯等有机溶剂。采用超临界CO2从丹参中萃取丹参酮ⅡA,工艺条件为:萃取压力25 MPa,萃取温度为40 ℃,萃取时间2 h,乙醇流量1.0 mL/min。采用PubChem Compound数据库(http://www.ncbi.nlm.nih.gov/pccompound)检索,得到丹参酮ⅡA的2D、3D化学结构图,如图 1。丹参酮ⅡA与疾病同时提出的文献中,最常提及的疾病有:肿瘤、心血管疾病、炎症、药物相关不良反应、缺血、脑血管疾病、缺氧、动脉粥样硬化、纤维化、癌症、肝细胞、脑缺血、心肌梗塞、乳腺肿瘤、肿瘤转移、缺血再灌注、白血病、心肌缺血、糖尿病、心脏病、肺肿瘤。丹参酮ⅡA与基因同时提出的文献中,最常提及的基因有肿瘤坏死因子、caspase 3、Bcl2、凋亡调节剂、Akt丝氨酸/苏氨酸激酶1、白细胞介素6、丝裂原活化蛋白激酶8、肿瘤蛋白p53、磷脂酰肌醇-4,5-二磷酸三激酶催化亚单位α、Jun原癌基因、AP-1转录因子。结合根据前期文献查阅,分析丹参酮ⅡA与常提及的疾病和基因,推断丹参酮ⅡA可能从抗炎、抗氧化、雌激素样活性等几个方面发挥作用,因此本文将探讨丹参酮ⅡA在抗炎、抗氧化、雌激素样活性及抗肿瘤方面的药理作用,以期为后续研究丹参酮ⅡA的工作提供参考,具体如下。
|
| 图 1 丹参酮IIA的2D、3D结构图 |
炎症反应在动脉粥样硬化、糖尿病、骨质疏松等疾病的发生、发展中占有重要的意义,细菌内毒素(脂多糖,LPS)是革兰氏阴性菌细胞壁的主要成分,是引起人和动物炎症反应的重要因素,LPS通过其受体TLR4将信号传导至细胞内,引起核因子NF-κB的激活,它能诱导一系列致炎基因的表达,导致多种炎症介质和细胞因子的释放,最终引起局部或全身炎症反应综合征。因而有效阻断NF-κB的异常激活可能成为临床抗炎的有效途径。
丹参酮ⅡA可降低血浆中白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)水平[3],抑制RAW264.7细胞的增殖及磷脂酶A2的产生[4],并促进RAW264. 7细胞中白细胞介素-10的释放,同时减少白细胞介素-6(IL-6)的产生及其mRNA的表达[5],另外,丹参酮ⅡA可抑制由LPS刺激引起的EA.hy926细胞中TLR4和TNF-α mRNA表达[6],发挥其抗炎活性。Tang等研究发现,丹参酮ⅡA可抑制血管细胞黏附分子-1(VCAM-1)和胞间黏附分子-1(ICAM-1)产生,并以剂量依赖方式抑制TNF-α诱导的脑微血管内皮细胞(BMVECs)中性白细胞的黏附,同时其显著抑制TNF-α诱导的活性氧及丙二醛(MDA)的产生,并抑制NF-κB的激活,表明其在脑微血管内皮细胞中调节TNF-α诱导的VCAM-1和ICAM-1的表达是通过抑制NF-κB的激活和活性氧的产生来发挥作用[7]。相关研究也证实丹参酮ⅡA可通过抑制转录因子NF-κB的激活及其相关黏附分子ICAM-1、VCAM-1mRNA表达以实现抑制动脉粥样硬化过程中的炎症反应从而发挥抗动脉粥样硬化作用[8]。丹参酮ⅡA亦通过抑制转录因子NF-κB的激活及其相关黏附分子ICAM-1[9-10]、巨噬细胞迁移抑制因子、脑缺血再灌注大鼠脑中炎症因子(MIF)的表达、TNF-α和白细胞介素(IL)-6的释放,减轻脑缺血再灌注神经保护作用[11]。另有研究证实,丹参酮ⅡA可降低辐射诱发的前炎症细胞因子的释放及NF-κBp65核转位,其作用机制为通过抑制与NF-κB信号通路相关的前炎症细胞因子基因的转录发挥其抗炎特性[12]。Jang等进一步研究发现,丹参酮ⅡA可减少LPS刺激RAW264.7细胞引起的前炎症细胞因子的产生及以剂量依赖的方式抑制IκB-α的磷酸化,并通过抑制NIK-IKK和MAPKs(p38、ERK1/2、JNK)信号通路的激活,从而抑制LPS诱导的IκB-α降解和NF-κB激活,以发挥抗炎活性[13]。
1.2 抗氧化作用巨噬细胞迁移抑制因子(MIF)酸脱氢酶(LDH)等脂质过氧化产物并引起DNA损伤,多数心血管疾病都起因于自由基脂质过氧化作用,如低密度脂蛋白(LDL)的氧化被认为是导致冠心病的主要原因;已证明ox-LDL是可致动脉粥样硬化的脂蛋白,在动脉粥样硬化患者钙化形成过程中发挥中枢作用。因此,脂质过氧化与多种疾病相关,会引起癌症、衰老、心血管疾病等多种慢性病的发生。
丹参酮可抑制LDL的氧化调节脂质代谢过程,发挥抗氧化作用[14-15]。研究发现,丹参酮ⅡA可降低血浆中ox-LDL浓度,并减少超氧阴离子和MDA的产生,同时增加Cu/Zn SOD活性,及Cu/Zn SOD mRNA和蛋白的表达,而丹参酮ⅡA抑制ox-LDL的产生不依赖于血浆中脂类、钙离子和活性维生素D的浓度,表明其对动脉粥样硬化鼠模型具有抗氧化作用[16]。在2K2C高血压大鼠模型中,丹参酮ⅡA抑制的NAD(P)H氧化酶活性及活性氧的产生,发挥抗氧化作用提高心脏功能[17]。研究发现,在过氧化氢(H2O2)所致J774巨噬细胞损伤模型[18]及线栓法致大脑中动脉闭塞复制大鼠局灶性脑缺血再灌注模型[19]中,丹参酮ⅡA均可显著地增加谷胱甘肽过氧化物酶活性。王维蓉等研究发现丹参酮ⅡA对H2O2诱导的人脐静脉血管内皮细胞株CRL21730损伤引起的过氧化物MDA和LDH产生呈剂量依赖性减少,证实丹参酮ⅡA对CRL21730氧化损伤的保护作用[20]。陈海明等的研究证实丹参酮ⅡA可剂量依赖性地抑制H2O2所致的人脐静脉内皮细胞(ECV304)活力降低,减少MDA生成,提高超氧化物歧化酶SOD活性,并可抑制细胞内皮素ET-1 mRNA的表达,增加过氧化物酶体增生物激活受体PPAR-γ mRNA的表达,从而表明丹参酮ⅡA对H2O2所致人脐静脉内皮细胞损伤具有明显的保护作用[21]。对于糖尿病肾病的硬化应激反应,丹参酮ⅡA可升高大鼠经一侧肾切除后腹腔注射链脲佐菌素致糖尿病肾病模型中的氧化应激指标MDA,降低SOD活力,起到保护肾脏延缓糖尿病肾病发生、发展的作用[22]。此外,丹参酮ⅡA通过清除脂类自由基,阻断脂质过氧化的链式反应,从而抑制DNA加成物的生成以减少细胞毒性,能有效地抑制细胞内脂质过氧化产物与DNA相互作用,发挥对DNA的保护作用[23-25]。
1.3 雌激素样作用植物雌激素(PE)是指一类非固醇植物来源的具有雌激素样活性的化合物。大多数具有与雌二醇类似的结构,可与17β-雌二醇竞争核内的雌激素受体(ER)以调节基因转录,从而发挥雌激素样活性。另外,可通过非基因组效应调节细胞信号转导有关酶的活性,如酪氨酸蛋白激酶,DNA拓扑异构酶和核糖体S6蛋白激酶等。植物雌激素对神经,心血管等方面具有保护作用,能改善围绝经期妇女的健康状况。它不仅对许多疾病有预防作用,而且还能作为一种选择性的治疗手段,其临床作用正受到众多学者的关注。
早期对丹参酮的研究发现,丹参酮增加雌性幼龄小鼠(体质量11~12 g)子宫重量,随后研究丹参酮对成年去卵巢雌性小鼠子宫重量的影响,结果发现丹参酮组与对照组子宫重量无明显差异,而与雌激素组有显著性差异,说明丹参酮的雌激素样活性是通过卵巢起作用的[26]。木海鸥等研究发现丹参酮能升高更年期大鼠降低的血清雌二醇(E2)水平,并显著降低更年期大鼠所升高的促卵泡激素(FSH)和黄体生成素(LH),同时提高其子宫、卵巢和肾上腺系数,表明丹参酮对更年期大鼠的激素紊乱具有调节作用[27]。在瞬时转染试验中发现,当ERα或ERβ表达质粒中的一者或两者在Hela细胞中共同表达时,丹参酮ⅡA(1×10-5 mol)可以雌激素受体依赖方式增加雌激素应答元件荧光素酶活性,表明其具有雌激素样活性。此外,丹参酮ⅡA以雌激素受体依赖方式抑制LPS刺激的RAW 264.7细胞NO的产生和iNOSmRNA的表达及炎症细胞因子(IL-1β、IL-6、TNF-α)的表达[28]。
1.4 抗肿瘤作用丹参酮通过对各种肿瘤细胞的杀伤、诱导分化及诱导凋亡等机制而发挥抗肿瘤作用。丹参酮除可通过抑制抗增殖细胞核抗原(PCNA)和细胞增殖相关基因表达影响DNA多聚酶δ活性,还可通过其呋喃环、醌类结构产生的自由基引起DNA损伤,抑制肿瘤细胞DNA合成;丹参酮对肿瘤细胞亦有诱导分化作用,可诱导肿瘤细胞分化成为正常细胞或接近正常细胞,而对正常细胞无杀伤作用;丹参酮可进一步诱导肿瘤细胞的凋亡。丹参酮ⅡA一方面通过对细胞周期的影响而抑制其增殖、诱导细胞分化;另一方面,通过Fas途径、增加bax/bcl-2蛋白表达比例,以诱导凋亡,此外,丹参酮ⅡA还可通过选择性的激活Caspase家族成员来发挥其抗癌作用[29]。
MosaddikMA等[30]研究发现丹参酮对小鼠类淋巴细胞白血病细胞(P388)的生长具有抑制作用,且有很强的细胞杀伤作用。Pan TL等[31]研究发现丹参酮ⅡA对多种人癌细胞系具有杀伤作用,2.5 mg/mL丹参酮ⅡA可通过干扰微管形成抑制人宫颈癌细胞生长且呈剂量和时间依赖性,导致细胞G2/M期停滞进而诱导凋亡。研究发现丹参酮ⅡA抑制Hela细胞生长[32],并显著上调人肺腺癌细胞(SPC-A-1)P53、P21基因的表达且抑制其DNA的合成,对SPC-A-1细胞增殖具有显著抑制作用[33]。丹参酮ⅡA将白血病细胞(NB 4细胞株)阻滞于G0/G1期,而S期的细胞数明显减少,c-myc、bcl-2基因蛋白表达降低,c-fos、p53基因蛋白表达增加,其可能是通过抑制细胞原癌基因、诱导肿瘤细胞分化而发挥作用[34]。丹参酮ⅡA通过抑制ERK通路而抑制卵巢癌细胞(CAOV-3)增殖,并诱导细胞凋亡,其途径与上调Bax表达,降低bcl-2表达有关[35]。相关研究发现丹参酮ⅡA诱导雌激素受体阳性乳腺癌细胞MCF-7和雌激素受体阴性细胞MDA-MB-231凋亡,丹参酮ⅡA以时间和剂量依赖的方式抑制MDA-MB-231细胞增殖,以剂量依赖的方式诱导细胞凋亡,其作用机制与抑制DNA合成,诱导凋亡相关[36]。近年研究发现丹参酮ⅡA可通过下调NF-κB途径的p65、IKK-β及其磷酸化蛋白水平抑制人胃癌SGC7901细胞增殖并促进凋亡,而对IKB-α水平无明显变化,但其磷酸化蛋白水平明显降低,同时对IKK-α及其磷酸化蛋白表达水平表达变化均不明显,据此,丹参酮ⅡA抑制人胃癌SGC7901细胞增殖并促进凋亡的作用机制需进一步研究和证实[37]。
2 结语文中丹参酮ⅡA对炎症介质和细胞因子的基因表达及其信号通路的影响进一步揭示丹参酮ⅡA在抗炎、抗氧化、抗肿瘤过程中的作用机制。目前,丹参酮ⅡA在心血管领域已得到广泛应用,随着对其雌激素样活性的进一步研究,丹参酮ⅡA可以作为一个潜在的选择性雌激素受体调节剂来治疗与抗炎、抗氧化相关的糖尿病、骨质疏松、退行性神经疾病和心血管疾病而不会增加乳腺癌的发病率,将为丹参酮ⅡA在临床应用及丹参的新药研发提供有力的理论依据。
| [1] |
张玉静, 杨星林, 任长杰. 丹参酮ⅡA对心血管影响研究的进展[J]. 临床荟萃, 2009, 18(24): 1653-1654. |
| [2] |
Gao S, Liu Z, Li H. Cardiovascular actions and therapeutic potential of tanshinone ⅡA[J]. Atherosclerosis, 2011. |
| [3] |
Li XJ, Zhou M, Li XH, Xu YH. Effects of Tanshinone Ⅱa on cytokines and platelets in immune vasculitis and its mechanism[J]. Zhongguo ShiYan Xue Ye Xue Za Zhi, 2009, 17(1): 188-192. |
| [4] |
唐涛, 郭伟强, 王珏, 等. 丹参酮Ⅱ-A在RAW264.7细胞系中的抗炎症作用机制[J]. 生物技术通讯, 2007, 18(1): 51-53. DOI:10.3969/j.issn.1009-0002.2007.01.016 |
| [5] |
郭伟强, 曹婷婷, 徐雯婧, 等. 丹参酮Ⅱ-A对细胞因子IL-6和IL-10的影响[J]. 生物技术, 2008, 18(6): 30-32. |
| [6] |
Jia LQ, Feng JY, Yang GL. Effect of tanshinone ⅡA on TLR4 and TNF-α of endothelial cells induced by LPS[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2011, 27(7): 733-735. |
| [7] |
Tang C, Xue HL, Bai CL. Regulation of adhesion molecules expression in TNF-α-stimulated brain microvascular endothelial cells by tanshinone ⅡA:involvement of NF-κB and ROS generation[J]. Phytother Res, 2011, 25(3): 375-380. |
| [8] |
崔广智, 金树梅, 赵桂峰, 等. 丹参酮ⅡA对TNF-α诱导的ECV304细胞NF-κB、IκB-α表达及粘附分子ICAM-1、VCAM-1mRNA表达的影响[J]. 中国药理学通报, 2007, 23(12): 1671-1675. DOI:10.3321/j.issn:1001-1978.2007.12.034 |
| [9] |
Dong X, Dong J, Zhang R. Anti-inflammatory effects of tanshinone ⅡA on radiation-induced microglia BV-2 cells inflammatory response[J]. Cancer Biother Radiopharm, 2009, 24(6): 681-687. DOI:10.1089/cbr.2009.0640 |
| [10] |
赵军伟.丹参酮ⅡA及丹参酮ⅡA/丹酚酸B不同配比对大鼠脑缺血再灌注后ICAM-1及MMP-9的影响[D].成都中医药大学, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2520062
|
| [11] |
张利.丹参酮ⅡA及丹参酮ⅡA/丹酚酸B不同配比的混合物对大鼠脑缺血再灌注后炎症因子TNF-α及NF-κB65的影响[D].成都: 成都中医药大学, 2012., http://cdmd.cnki.com.cn/Article/CDMD-10633-1013112056.htm
|
| [12] |
陈晏林.丹参酮ⅡA对大鼠脑缺血再灌注损伤的保护作用及机制研究[D].重庆: 重庆医科大学, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2202819
|
| [13] |
Jang SI, Kim HJ, Kim YJ. Tanshinone ⅡA inhibits LPS-induced NF-kappaB activation in RAW 264.7 cells:possible involvement of the NIK-IKK, ERK1/2, p38 and JNK pathways[J]. Eur J Pharmacol, 2006, 542(1-3): 1-7. DOI:10.1016/j.ejphar.2006.04.044 |
| [14] |
Niu X L, Ichimori K, Yang X. Tanshinone ⅡA inhibits low density lipoprotein oxidation in vitro[J]. Free Radic Res, 2000, 33(3): 305-312. DOI:10.1080/10715760000301471 |
| [15] |
Ko JS, Ryu SY, Kim YS. Inhibitory activity of diacylglycerol acyltranferase by tanshinones from the root of salvia miltiorrhiza[J]. Arch Pharm Res, 2002, 25(4): 446-448. DOI:10.1007/BF02976599 |
| [16] |
Tang F, Wu X, Wang T, Wang P. Tanshinone Ⅱ A attenuates atherosclerotic calcification in rat model by inhibition of oxidative stress[J]. Vascul Pharmacol, 2007, 46(6): 427-438. DOI:10.1016/j.vph.2007.01.001 |
| [17] |
Wang P, Wu X, Bao Y. Tanshinone ⅡA prevents cardiac remodeling through attenuating NAD (P)H oxidase-derived reactive oxygen species production in hypertensive rats[J]. Pharmazie, 2011, 66(7): 517-24. |
| [18] |
Yu -L, Gary E, Renee C. Tanshinone ⅡA reduces macrophage death induced by hydrogen peroxide by upregulatiing glutathione peroxidase[J]. Life Sci, 2008, 83(15): 557-562. |
| [19] |
韩若东, 汤其强, 肖晗, 等. 丹参酮ⅡA对早期脑缺血和脑缺血再灌注损伤的脑保护作用[J]. 安徽医科大学学报, 2012, 47(6): 655-658. DOI:10.3969/j.issn.1000-1492.2012.06.010 |
| [20] |
王维蓉, 林蓉, 彭宁, 等. 丹参酮ⅡA对过氧化氢损伤人血管内皮细胞的保护作用[J]. 中药材, 2006, 29(1): 49-51. DOI:10.3321/j.issn:1001-4454.2006.01.021 |
| [21] |
陈海明, 叶攀. 丹参酮ⅡA对血管内皮细胞氧化应激损伤的保护作用[J]. 中药材, 2008, 31(4): 569-572. DOI:10.3321/j.issn:1001-4454.2008.04.035 |
| [22] |
王俏, 吴莘, 曹征, 等. 丹参酮ⅡA对糖尿病肾病大鼠肾组织氧化应激的影响[J]. 中华临床医师杂志, 2015, 9(7): 1149-1151. DOI:10.3877/cma.j.issn.1674-0785.2015.07.016 |
| [23] |
梁勇, 羊裔明, 袁淑兰. 丹参酮药理作用及临床应用研究进展[J]. 中草药, 2000, 31(4): 304-306. DOI:10.3321/j.issn:0253-2670.2000.04.034 |
| [24] |
吴杲, 何招兵, 吴汉斌. 丹参酮的药理作用研究进展[J]. 现代中西医结合杂志, 2005, 14(10): 1382-1385. DOI:10.3969/j.issn.1008-8849.2005.10.127 |
| [25] |
李文喆, 王勇, 姚世芳. 丹参药用成分研究进展[J]. 人民军医, 2008, 3(51): 180-182. |
| [26] |
高玉桂, 王灵芝, 唐翼雪. 丹参酮的性激素样活性[J]. 中国医学科学院学报, 1980, 3(2): 189-190. |
| [27] |
木海鸥, 孙忠敏, 苏孝共. 丹参酮对更年期大鼠生殖内分泌系统的影响[J]. 药物研究, 2007, 11(16): 13. |
| [28] |
Fan GW, Gao XM, Wang H. The anti-inflammatory activities of Tanshinone ⅡA, an active component of TCM, are mediated by estrogen receptor activation and inhibition of iNOS[J]. J Steroid Biochem Mol Biol, 2009, 113(3-5): 275-80. DOI:10.1016/j.jsbmb.2009.01.011 |
| [29] |
王媛婕, 刘彦慧, 廖瑞雪. 丹参酮ⅡA对新生大鼠缺血缺氧性脑损伤后神经细胞凋亡的保护作用及机制研究[J]. 中国药理学通报, 2015, 31(3): 443-444. DOI:10.3969/j.issn.1001-1978.2015.03.030 |
| [30] |
Mosaddik MA. In vitro cyt otoxicity of Tanshinones isolated from Salvia m iltiorrhiza Bunge against P338 lymphocytic leukemia cells[J]. Phytomedicine, 2003, 10(8): 682-685. DOI:10.1078/0944-7113-00321 |
| [31] |
Pan TL, Hung YC, Wang PW. Functional proteomic and structural insights into molecular targets related to the growth inhibitory effect of tanshinone ⅡA on HeLa cells[J]. Proteomics, 2010, 10(5): 914-929. |
| [32] |
王冬, 田亚平, 姜英雁, 等. 丹参酮ⅡA抑制Hela细胞生长及诱导凋亡的体外实验研究[J]. 中国现代医学杂志, 2007, 17(6): 676-682. DOI:10.3969/j.issn.1005-8982.2007.06.010 |
| [33] |
何金涛, 周清华, 袁淑兰, 等. 丹参酮对人肺癌细胞株的增殖抑制作用及其分子机理[J]. 中国肺癌杂志, 2002, 5(2): 123-125. DOI:10.3779/j.issn.1009-3419.2002.02.13 |
| [34] |
梁勇, 宋文秀, 王井, 等. 丹参酮ⅡA诱导耐维甲酸的急性早幼粒细胞白血病细胞分化及其机制[J]. 中华内科杂志, 2005, 44(5): 366-369. DOI:10.3760/j.issn:0578-1426.2005.05.015 |
| [35] |
刘伟, 陈昊. 丹参酮ⅡA对人卵巢癌细胞株CAOV3增殖与凋亡的影响[J]. 医药导报, 2007, 26(12): 1398-1400. DOI:10.3870/j.issn.1004-0781.2007.12.002 |
| [36] |
Zhang PR, Lü QA. Study on anticancer activity of tanshinone Ⅱ A against human breast cancer[J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2009, 40(2): 245-249. |
| [37] |
赵雪峰, 魏敬妙, 李勇, 等. 丹参酮ⅡA对胃癌细胞的抑制作用及其与NF-KB信号通路的关系[J]. 中国普通外科杂志, 2014, 23(4): 483-487. |
 2019, Vol. 38
2019, Vol. 38