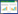文章信息
- 彭艳芳, 张莹雯, 赵映前, 王秀萍, 艾望
- PENG Yanfang, ZHANG Yingweng, ZHAO Yingqian, WANG Xiuping, AI Wang
- 紫檀芪对肺纤维化大鼠NF-κB/TGF-β1/smad 3信号通路的影响
- The impact of pterostilbene on transforming NF-κB/TGF-β1/smad3 signaling pathway of pulmonary fibrosis in rats
- 天津中医药大学学报, 2019, 38(1): 53-58
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(1): 53-58
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.01.15
-
文章历史
收稿日期: 2018-05-14
2. 湖北中医药大学, 武汉 430065;
3. 武汉大学, 武汉 400071
2. Hubei University of Traditional Chinese Medicine, Wuhan 430065, China;
3. Wuhan University, Wuhan 430071, China
肺纤维化是由多原因引起的以炎性细胞浸润、纤维母细胞增生、胶原纤维的沉积为特征的免疫介导的慢性炎性反应性疾病[1-3]。其5年生存率为30%~50%,平均生存期不足3年[4-5]。免疫炎症反应是肺纤维化的早期的主病理机制,现代医学对本病尚缺乏理想有效的药物,大量学者认为应用激素和(或)免疫抑制剂/细胞毒性药物可以控制肺纤维化的发展,20世纪50年代糖皮质激素、免抑制剂/细胞毒性被列为首选药物[6]。但长期使用其疗效局限且药物不良反应大如骨质疏松、免疫功能低下、感染不愈合等[7]。而其最有效的治疗方法是长期氧疗和肺移植,但由于各种原因,肺移植在国内的开展非常有限。因此,寻找PF新的治疗手段成为目前研究的热点与难点。紫檀芪(Pterostilbene)是从中药紫檀、血竭、蜂胶中分离得到的一个反式二苯乙烯类化合物,现代大量的研究证实紫檀芪具有抗氧化、抗炎、抗肿瘤、抗衰老、肝肾保护以及抗病原微生物等多种药理作用。目前发现紫檀芪还可以干预多种器官组织的纤维化过程,例如有报道紫檀芪可减轻二甲基亚硝胺所诱导大鼠产生肝脏纤维化[8],这可能与其抑制TGF-β1/Smads信号通路有关。器官纤维化病理过程大都是纤维组织增生,细胞外基质(ECM)沉积所致,紫檀芪能否在肺纤维化中也起到作用,国内外未见报道,而笔者预实验已提示紫檀芪可改善肺纤维化。因此本研究拟采用博莱霉素复制肺纤维化大鼠模型,观察紫檀芪的抗肺纤维化作用及对肺纤维化大鼠NF-κB/TGF-β1/smad信号通路的影响,进一步探讨其作用机制。
1 材料与方法 1.1 实验动物健康雄性SD大鼠(SPF级)50只,由武汉大学动物实验部购进,6~8周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司;动物许可证号SCXK(京)2016-0006。实验室人工光照、阴暗各12 h(暗期20:00-8:00),45%左右相对湿度,25 ℃恒温的普通设施中,进行适应性饲养。本实验方案已通过武汉大学的实验动物伦理委员会审查批准,批准编号:02517121A。
1.2 受试药物紫檀芪:日本富士株式会社,98%,HPLC;对照药物:泼尼松片:5 mg/片(生产批号:170545,国药准字:H33021207,浙江仙居制药股份有限公司生产)。泼尼松片置乳钵内研碎加生理盐水制成0.6 g/L混悬液,置4 ℃冰箱中保存备用。
1.3 试剂与主要仪器注射用盐酸博来霉素:日本化药株式会社生产,批号H20055883,15 mg/支;酶联免疫吸附测定试剂盒NF-κB、TGF-β1,购自伊莱瑞特生物工程有限公司;免疫组化试剂盒购自武汉拜意尔生物有限公司。高速冷冻离心机:湖南湘仪仪器。DYY-6C电泳仪:北京市六一仪器厂。苏木素染液:武汉阿斯本生物技术有限公司。MicroPublisher成像系统:Q-IMAGING公司。
2 方法 2.1PF模型的制备、分组实验前将所有大鼠适应性喂养2周后,参照Szapie[9]等经典造模方法诱导PF大鼠模型:各组大鼠称量体质量后,用1%戊巴比妥钠溶液按40 mg/kg腹腔内注射麻醉大鼠,然后将大鼠仰卧固定于鼠台上,用络合碘将鼠颈部皮肤消毒后逐层分离至暴露气管后,用1 mL注射器经气管软骨环间隙朝向心端穿刺,一次性气管内滴入博莱霉素生理盐水溶液0.2~0.3 mL(参考剂量为5 mg/kg)复制肺纤维化模型,空白组以相同方法滴入等体积生理盐水,注射完毕后立即将大鼠直立旋转30 s,尽量使药液向下流入肺内时能够均匀分布,然后切口局部缝合,手术过程严格无菌操作。在实验过程中各组大鼠自由进食和饮水。造模后当日将大鼠随机分为模型组(B组)及泼尼松组(C组)、紫檀芪低剂量组(D组)、紫檀芪高剂量(E组),以SD大鼠设为正常组(A组),每组10只。
2.2 干预方法于造模24 h后开始进行灌胃给药,空白组和模型组生理盐水灌胃10 mL/(kg·d),泼尼松组予以泼尼松混悬液3.0 mg/(kg.d),紫檀芪低、高剂量组分别以15 mg/(kg·d)、30 mg/(kg·d)给药。各组大鼠每日灌胃1次,连续4周。
2.3 观察指标及标本留取各亚组大鼠均于给药后第28天,用1%戊巴比妥钠溶液按40 mg/kg腹腔内注射麻醉大鼠,摘眼球取血3 mL,脱颈处死。大鼠处死后打开胸腔,结扎左肺门,分离气管和肺组织,避免损伤肺组织,尽量剔除结缔组织及周围脂肪,冰生理盐水冲洗后予以滤纸吸干,称量肺湿重并记录,计算肺指数;取肺组织完全浸泡于福尔马林溶液中固定,分别行HE染色和石蜡包埋备做病理切片,同时进行免疫组化染色。
2.3.1 肺组织病理学观察HE染色观察各组大鼠肺组织形态学的变化;病理学评分标准:参照Szapiel等[9]的方法对肺组织的肺泡炎及肺纤维化程度进行评分。
2.3.2 ELISA法检测血清NF-κB、TGF-β1的水平各亚组大鼠摘除眼球取血备用,收集血液样本待血液凝固后,4 ℃ 2 000 g×10 min离心,收集上清,-20 ℃或更低温度保存备用,用于大鼠血清中NF-κB、TGF-β1的测定,测定方法严格按试剂盒说明书进行。
2.3.3 免疫组化检测大鼠肺组织TGF-β1、Smad3的表达石蜡切片脱蜡水化,PBS液浸泡,一抗孵育过夜,PBS冲洗,标记二抗,缓冲液冲洗后DAB显色,自来水充分冲洗,复染,脱水,透明干燥,封片。胞质内出现棕黄色颗粒为阳性反应。使用全自动计算机图像分析系统Image Pro-Plus6.0对免疫组化染色结果进行半定量分析,计算积分光密度值(IOD)。每张免疫组化切片均采取400倍视野下观察并采集图像,随机选择5个视野进行采图,测定其阳性染色的IOD值,以其均值反映表达量。
2.3.4 统计学处理采用采用SPSS 19.0统计软件,计量资料以均数±标准差(x±s)表示,多样本间比较用单因素方差分析,组间两两比较在方差齐时采用LSD法,方差不齐时用Duunett’s T3法。P<0.05表示差异有统计学意义。
3 结果 3.1 病理改变 3.1.1 肺大体肉眼观察正常组双肺呈粉红色,表面光滑,弹性良好。模型组双肺呈灰白色,体积缩小,表面可见出血点和坏死灶,质地较硬,弹性差。紫檀芪组和泼尼松组肺组织较模型组颜色稍红,弹性较模型组软,肺表面出血点、坏死灶较少,见图 1。
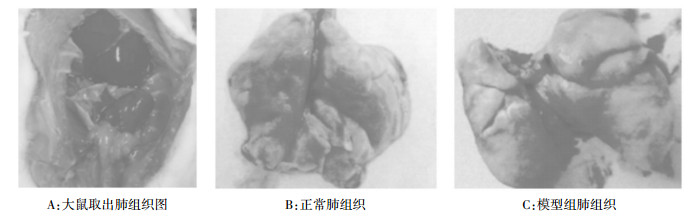
|
| 图 1 肺组织大体观察图 |
从大鼠肺组织HE染色结果分析,空白组肺组织结构清晰,肺泡壁未见增厚,偶见炎性细胞,无间质纤维组织增生;模型组的肺组织结构紊乱,有大量纤维组织增生及胶原沉积,炎性细胞浸润,融合成片,纤维化明显。紫檀芪组、强的松组肺泡炎及纤维化程度均较模型组轻,肺泡间隔增厚程度相对较轻,病变范围局限,其中紫檀芪高剂量组改善更明显,见图 2。
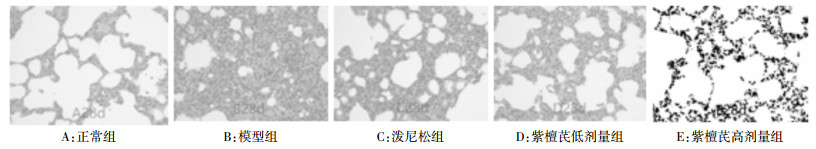
|
| 图 2 第28天各组大鼠肺组织HE染色观察(HE染色,200×) |
与空白组比较,其他组血清中TGF-β1、NF-κB含量升高(P<0.01);与模型组比较,泼尼松组和紫檀芪组均降低大鼠血清中TGF-β1、NF-κB含量(P<0.01);与泼尼松组相比,紫檀芪高剂量组差异具有统计学意义(P<0.01)。结果见表 1。
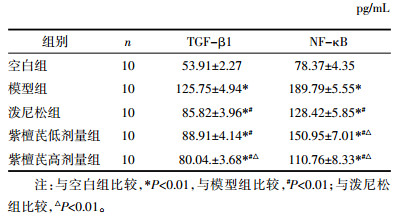
大鼠肺组织中TGF-β1蛋白表达主要位于肺泡巨噬细胞、上皮细胞、内皮细胞及成纤维细胞等细胞质中,呈黄色或棕黄色颗粒。空白组大鼠呈弱阳性表达,模型组大鼠肺组织TGF-β1含量较空白组明显增高,有统计学意义(P<0.01)。与模型组比较,紫檀芪各组肺组织TGF-β1表达在均有降低,且有统计学意义(P<0.01);与泼尼松对照组相比,紫檀芪高剂量组出现肺内TGF-β1下降(P<0.01)。见图 3、表 2。
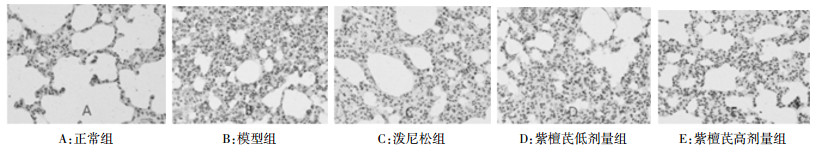
|
| 图 3 第28天各组大鼠肺组织TGF-β1蛋白表达(免疫组化,400×) |
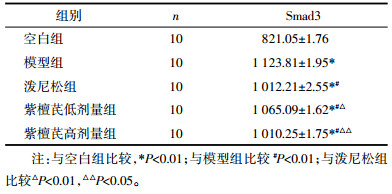
免疫组化染色显示:正常组大鼠肺组织中仅有少数细胞胞浆被染成浅黄色,强度较弱,主要在肺泡巨噬细胞及支气管上皮细胞分布,而模型组大鼠肺组织细胞的阳性表达呈棕黄色,较对照组染色增强,阳性表达主要位于支气管上皮细胞、肺泡巨噬细胞和肺泡上皮细胞的细胞核内;泼尼松组、紫檀芪组各剂量组染色阳性细胞数量介于同期空白对照组与模型对照组之间。见图 4、表 3。
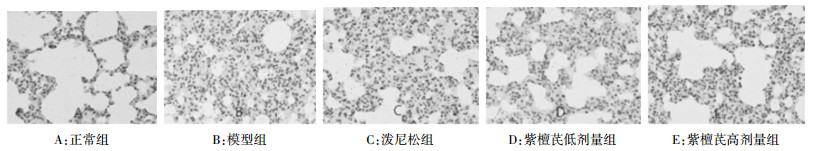
|
| 图 4 第28天各组大鼠肺组织Smad3蛋白表达(免疫组化,400×) |
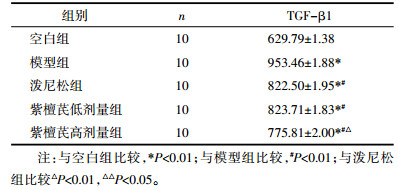
由表 3可知,与模型组相比,各给药组大鼠肺组织Smad3的表达均有下降,差异显著(P<0.01);与泼尼松对照组相比,紫檀芪高剂量组出现肺内Smad3的低表达状态(P<0.05)。
4 讨论肺纤维化是一种常见的纤维増生性疾病,呈进行性发展,是呼吸系统最严重的慢性疾病之一,目前公认的观点为肺纤维化是一种多因素多途径共同作用的疾病。上皮细胞在外在的环境和内在的基因等多因素作用下,会发生损伤,损伤后炎症反应被激活,细胞信号等多重途径得到启动,多个信号途径导致了肺内促纤维化及抗纤维化因子的失衡,而活化的因子反过来又激活多种细胞,导致细胞大量表达炎症介质和细胞因子,在细胞因子介导的多信号通路,细胞间相互发生作用,从而最终导致肺纤维化的形成[10]。在多种引起肺纤维化的细胞因子中,TGF-β1是最重要的调控因子[11]。一方面TGF-β1可促进肺成纤维细胞异常增殖,刺激成纤维细胞合成细胞外基质,使细胞外基质在肺间质和肺泡间过度积聚。另一方面,TGF-β1可诱导蛋白酶抑制剂的表达,最终导致基质的异常积聚和纤维形成[12]。因此,通过影响TGF-β1的合成或阻断其信号转导通路来抑制纤维化的进程,成为肺纤维化治疗的研究热点。
有学者证明在肺纤维化疾病中NF-κB、TGF-β的活性和(或)量是明显增加的,而通过抑制NF-κB和(或)抑制TGF-β的产生能够明显的减轻肺部纤维化的发生发展[13-14],提示NF-κB、TGF-β的含量及活性与肺纤维化的发生发展有着密不可分的关系。NF-κB通过对肺泡巨噬细胞、TGF-β等多种细胞因子过度表达,介导肺泡炎和肺纤维化进程[15]。肺泡炎是发生肺间质纤维化的中心环节,NF-κB被激活又是发生炎症反应的中心环节,NF-κB是TGF-β1表达的上游调节基因,NF-κB激活后与TGF-β1的启动子结合,诱导TGF-β1的表达[16],这点可以从模型组NF-κB高表达看出,同时伴有TGF-β1表达增高。因此干预TGF-β1、NF-κB被认为是抗肺纤维化药物治疗的关键分子靶点[17]。Qureshi等[18]发现,紫檀芪具有抑制核因子NF-κB活化的能力,从而抑制促炎性细胞因子和一氧化氮合酶基因的活化,导致肿瘤坏死因子α、白介素1β、白介素6分泌减少,从而减轻炎症的刺激反应。我们的实验中也发现紫檀芪可降低血清中NF-κB,与报道相一致。Smad蛋白是TGF-β下游信号转导和调节分子,参与TGF-β信号细胞内传导[19]。磷酸化的Smad2、3与Smad4形成Co-Smads进入细胞核调控靶基因转录,诱导肺组织纤维化改变[20]。TGF-β1可启动和放大级联瀑布式促纤维化效应,Smad3是TGF-β1受体激活后的主要作用靶点,在TGF-β1介导的肺纤维化起着不可替代的作用[21]。Smad3参与了TGF-β1介导的多个促纤维化反应过程,因此,以NF-κB /TGF-β1/Smad信号通路为作用靶点的治疗手段将会成为肺纤维化的有效治疗方案。本研究中,与模型组相比,各给药组大鼠肺组织NF-κB /TGF-β1/Smad的表达在均有下降,差异显著(P<0.01)。
天然的植物活性成分用于各种慢性疾病的防治与治疗已越来越受到关注,多酚类化合物紫檀芪(Pterostilbene)是一种天然的植物活性成分,且紫檀芪由于具有广泛的药理活性而备受重视。在自然界中,紫檀芪分布广泛,由于最初在紫檀[22]中发现,故而命名为紫檀芪。后来,在蓝莓(Vaccinium)、龙血竭(ChineseDragon’ s Blood)、交趾黄檀(Dalbergiacochinchinensis)、苜蓿(Medicago sativa Linn)以及葡萄(Vitis spp.)中均有发现紫檀芪[23-28, 29]。周艳林等[31]采用HPLC-DPPH法评价剑叶龙血树中芪类化合物的抗氧化活性发现其活性强弱依次为紫檀芪(73.19%,清除率,下同)>白藜芦醇(71.10%)>龙血素B(39.01%)>龙血素A(12.14%)。该结果与Nichols等[30]的研究报道一致。紫檀芪是白藜芦醇的一种衍生物,其化学结构较白藜芦醇多出两个甲氧基,两者具有相似的药理特性。实验表明,在同等情况下,紫檀芪比白藜芦醇有更高的生物利用率和生物活性[31]。口服吸收度更好[32]。在紫檀芪的安全性方面,将紫檀芪以3 000 mg/(kg·d)的剂量作用于动物时未见明显毒副作用[33]。因此,紫檀芪较白藜芦醇可能更适于进一步开发并应用于临床。目前实验及临床已经证实白藜芦醇[34-35]能够降低肺纤维化程度,故本课题选用紫檀芪来治疗肺纤维化。本次实验结果显示模型组肺泡炎、肺纤维化程度明显高于强的松组、紫檀芪组,提示紫檀芪可改善肺组织病理变化,延缓肺纤维化进展,而且紫檀芪高剂量组治疗效果更好;紫檀芪能够有效降低博莱霉素所致的肺纤维化大鼠血清、肺组织炎性指标NF-κB、TGF-β1、Smad3的浓度值,改善肺泡炎症,进而抑制肺纤维化,这可能是紫檀芪防治肺纤维化的作用机制之一。本实验是对紫檀芪治疗肺纤维化的作用进行初步探索,有待于今后更进一步的研究。
| [1] |
Zhao L, Wang X, Chang Q, et al. Neferine, a bisbenzylisoquinline alkaloid attenuates bleomycin-induced pulmonary fibrosis[J]. Eur J Pharmacol, 2010, 627: 304-312. DOI:10.1016/j.ejphar.2009.11.007 |
| [2] |
Groves AM, Johnston CJ, Misra RS, et al. Effects of IL-4 on pulmonary fibrosis and the accumulation and phenotype of macrophage subpopulations following thoracic irradiation[J]. Int J Radiat Biol, 2016, 92(12): 754-765. DOI:10.1080/09553002.2016.1222094 |
| [3] |
Wang YC, Liu JS, Tang HK, et al. miR 221 targets HMGA2 to inhibit bleomycin induced pulmonary fibrosis by regulating TGF β1/Smad3-induced EMT[J]. Int J Mol Med, 2016, 38(4): 1208-1216. DOI:10.3892/ijmm.2016.2705 |
| [4] |
Juarez MM, Chan AL, Norris AG, et al. Acute exacerbation of idiopathic pulmonary fibrosis-a review of current and novel pharmacotherapies[J]. J Thorac Dis, 2015, 7(3): 499-519. |
| [5] |
Li X, Peng S, Wei L, et al. Relevance analysis of clinical and lung function parameters changing and prognosis of idiopathicpulmonary fibrosis[J]. Int J Clin Exp Med, 2014, 7(12): 4759-4769. |
| [6] |
Hara A, Sakamoto N, Ishimatsu Y, et al. S100A9inBALFisacandidate biomarker of idiopathic pulmonary fibrosis[J]. RespirMed, 2012, 106: 571-580. |
| [7] |
李翠东, 刘桂桃. 肺纤维化的诊治新进展[J]. 世界最新医学信息文摘, 2018, 18(18): 75-77. |
| [8] |
宋琳.紫檀芪抑制miR-34a/Sirtl/p53和TGF-β1/smads信号通路减轻高果糖诱导肝纤维化机制研究[D].南京: 南京大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10284-1017097289.htm
|
| [9] |
Szapiel SV, Elson NA, Fulmer JD, et al. Bleomycin-induced interstitial pulmonary disease in the nude, athymic mouse[J]. Am RevResp Dis, 1979, 120(4): 893-899. |
| [10] |
King TE Jr, Pardo A, Selman M. Idiopathic pulmonary fibrosis[J]. Lancet, 2011, 378(9807): 1949-1961. DOI:10.1016/S0140-6736(11)60052-4 |
| [11] |
Rittie L. Another dimension to the importance of the extracellular matrix in fibrosis[J]. Journal of Cell Communication Signaling, 2015, 9(1): 99-100. DOI:10.1007/s12079-015-0282-x |
| [12] |
Nho RS, Polunovsky V. Translational control of the fi-broblast-extracellular matrix association:An application to pulmonary fibrosis[J]. Translation, 2013. DOI:10.4161/trla.23934 |
| [13] |
Sato N, Takasaka N, Yoshida M, et al. Metformin attenuates lung fibrosis development via NOX4 suppression[J]. Respiratory Research, 2016, 17(1): 107-119. |
| [14] |
Fan Z, Yao J, Li Y, et al. Anti-inflammatory and antioxidant effects of curcumin on acute lung injury in a rodent model of intestinal ischemia reperfusion by inhibiting the pathway of NF-Kb[J]. International Journal of Clinical & Experimental Pathology, 2015, 8(4): 3451-3459. |
| [15] |
AkgedikR, Akgedik S, Karamanli H, et al. Effect of resveratrol on treatment of bleomycin- induced pulmonary fibrosis in rats[J]. Inflammation, 2012, 35(5): 1732-1741. DOI:10.1007/s10753-012-9491-0 |
| [16] |
Marut W, Kavian N, Servettaz A, et al. Amelioration of systemic fibrosis in mice by angiotensin Ⅱ receptor blockade[J]. Arthritis Rheum, 2013, 65(5): 1367-1377. DOI:10.1002/art.37873 |
| [17] |
Fagone E, Conte E, Gili E, et al. Resveratrol inhibits transforming growth factor-β-induced proliferation and differentiation of ex vivo human lung fibroblasts into myofibroblasts through ERK/Akt inhibition and PTEN restoration[J]. Exp Lung Res, 2011, 37(3): 162-174. DOI:10.3109/01902148.2010.524722 |
| [18] |
Qureshi AA, Guan XQ, Reis JC, et al. Inhibition of nitric oxide and inflammatory cytokines in LPS-stimulated murine macrophages by resveratrol, a potent proteasome inhibitor[J]. Lipids Health Dis, 2012, 11: 76. DOI:10.1186/1476-511X-11-76 |
| [19] |
Attisano L, Wrana JL. Signal transduction bythe TGF-bata superfamily[J]. Science, 2002, 296(5573): 1646-1647. DOI:10.1126/science.1071809 |
| [20] |
Zaringhalam J, Akhtari Z, Eidi A, et al. Relationship between serum IL10 Level and p38MAPK enzyme activity on behavioral and cellular aspects of variation of hyperalgesia during different stages of arthritis in rats[J]. Inflammopharmacology, 2014, 22(1): 37-44. DOI:10.1007/s10787-013-0174-8 |
| [21] |
Roberts AB, Tian F, Byfield SD, et al. Smad3 is key to TGF-β1-mediated epithelial-to-mesenchymal transition, fibrosis, tumor suppression and metastasis[J]. Cytokine Growth Factor Rev, 2006, 17: 19-27. DOI:10.1016/j.cytogfr.2005.09.008 |
| [22] |
Senadri R. Polyphenols of pterocarpus and dalbergia woods[J]. Phytochemistry, 1972, 11: 881-898. DOI:10.1016/S0031-9422(00)88430-7 |
| [23] |
陈介甫, 李亚东, 徐哲. 蓝莓的主要化学成分及生物活性[J]. 药学学报, 2010, 45(4): 422-429. |
| [24] |
刘星, 王蓓, 高姬, 等. 龙血竭不同类型酚性成分的分离及紫外光谱特征[J]. 天然产物研究与开发, 2013, 25(11): 1060-1066. |
| [25] |
钟艳霞, 黄日明, 周孝君, 等. 交趾黄檀心材化学成分的研究[J]. 天然产物研究与开发, 2013, 25(11): 1515-1518. |
| [26] |
Hanif M, Al-Maskari A, Al-Sabahi J, et al. Chemical characterisation of bioactive compounds in Medicago sativa growing in thedesertofOman[J]. NatProd Res, 2015, 29(24): 2332-2335. |
| [27] |
杨勇, 杨俊祥, 宫霞, 等. 葡萄及葡萄属植物中的天然活性物质研究与利用现状[J]. 酿酒科技, 2011(6): 75-79. |
| [28] |
黄方爱, 张波, 杨晓燕, 等. 葡萄芪类物质的研究进展[J]. 广州化工, 2012, 40(6): 3-5. |
| [29] |
周艳林, 阂建国, 邹准, 等. HPLC-DPPH评价剑叶龙血树中抗氧化活性成分及构效关系[J]. 中草药, 2015, 46(12): 1797-1799. DOI:10.7501/j.issn.0253-2670.2015.12.016 |
| [30] |
Nichols JA, Katiyar SK. Skin photoprotection by natural polyphenols:anti-inflammatory, antioxidant and DNA repair mechanisms[J]. Arch DermatolRes, 2010, 302(2): 71-83. DOI:10.1007/s00403-009-1001-3 |
| [31] |
McCormack D, McFadden D. Pterostilbene and cancer:current review[J]. J Surg Res, 2012, 173(2): e53-61. |
| [32] |
Kapetanovic LM, Muzzio M, Huang Z, et al. pharmacokinetics, oral bio availability, and metabolic profile of resveratrol and its dimethyletheranalog, pterostilbene, inrats[J]. Cancer Chemotherapy & pharmacology, 2011, 68: 593-601. |
| [33] |
Ruiz MJ, Fernandez M, Pico Y, et al. Dietary administration of high doses of pterostilbene and quercetin to mice is not toxic[J]. J Agric Food Chem, 2009, 22, 57(8): 3180-3186. |
| [34] |
李迎春, 江星, 符凤英, 等. 白藜芦醇联合厄贝沙坦对大鼠肺纤维化及TGF-β1、NF-κB的影响[J]. 临床和实验医学杂志, 2015, 14(2): 83-86. DOI:10.3969/j.issn.1671-4695.2015.02.002 |
| [35] |
周萍, 僧靖静, 赵高峰, 等. 白藜芦醇对肺纤维化大鼠E-cadherin、α-SMA表达的影响[J]. 临床肺科杂志, 2018, 23(4): 674-677. DOI:10.3969/j.issn.1009-6663.2018.04.025 |
 2019, Vol. 38
2019, Vol. 38