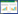文章信息
- 高艳, 郑梦成, 杜守颖, 白洁, 陆洋, 李鹏跃
- GAO Yan, ZHENG Mengcheng, DU Shouying, BAI Jie, LU Yang, LI Pengyue
- 桂皮醛脂质体制备工艺研究
- Preparation technology of Cinnamaldehyde liposomes
- 天津中医药大学学报, 2019, 38(2): 180-185
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(2): 180-185
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.02.19
-
文章历史
收稿日期: 2018-11-20
皮肤光老化是由于皮肤暴露于紫外线下而造成的慢性损伤,可诱发脂溢性角化病、胶样粟丘疹、光线性肉芽肿、日光性角化病等一系列增生性病变,严重者可能发生皮肤癌、基底细胞癌等恶性肿瘤[1],但目前通过临床研究的有效治疗措施较少。0.05%全反式维生素A酸霜是目前惟一被美国FDA批准治疗皮肤光老化的产品[2],但维生素A酸类药有引起肌肉疼痛,体内中性粒细胞减少等问题[3]。非甾体抗炎类药物如阿司匹林虽可延缓或减轻红斑效应及预防治疗慢性光损伤[4],但有增加晒伤细胞形成,诱导皮肤产生红斑等[5]问题。
桂皮醛是中药材肉桂挥发油的主要成分。相关研究表明,桂皮醛对治疗皮肤光老化具有一定的作用,可抑制黑素瘤细胞增殖并促进其凋亡[6-7]。在不影响皮肤成纤维细胞正常生长的情况下能抑制UVA诱导的MAPK通路活化,进而抑制MMP-1和MMP-3产生;在体外能抑制二维和三维培养的黑素瘤A375细胞的侵袭能力,抑制二维和三维培养的A375细胞内NF-κB的活化,具有抗黑素瘤的能力[8]。这些药理活性为皮肤光老化的预防与治疗以及黑素瘤的治疗提供新的研究方向,因此本研究考虑将桂皮醛应用于皮肤光老化的预防治疗中。
但由于桂皮醛分子中存在烯醛结构,在空气中易被氧化,稳定性较差。同时桂皮醛难溶于水,导致临床上口服吸收较差,生物利用度低,影响其使用与疗效。现有治疗皮肤光老化的手段之一则是将药物作用于表皮与真皮之间,因此采用外用给药技术,可增强桂皮醛改善皮肤光老化的作用[9]。因此,为改善桂皮醛的生物利用度,提高桂皮醛的稳定性,研究尝试将脂质体技术应用于桂皮醛中,进行桂皮醛脂质体的制备。本文采用薄膜-超声分散法制备桂皮醛脂质体,采用超滤法对其进行包封率测定,并采用正交法进行处方优化筛选。
1 仪器与试剂LC-20AD高效液相色谱仪(日本岛津公司,SPD-M20A,PDA检测器,LC Solution色谱工作站);赛多利斯BT 25S电子分析天平(北京赛多利斯公司);KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司,编号:01C266);RE-52AA旋转蒸发器(上海亚荣生化仪器厂);Nano series SZ-100型激光粒度仪(英国马尔文公司);Millipore超滤离心管(0.5 mL,30 kDa,上海俊晟生物科技有限公司);JEM-1230透射式电子显微镜(日本电子株式会社)
桂皮醛对照品(上海源叶生物科技有限公司,批号:H02M6Q1);桂皮醛提取物(上海麦克林生化科技有限公司,批号:C10054406);卵磷脂(德国Lipoid公司,批号:579010-1150050-11/903);胆固醇(美国amresco公司,批号:0786C157);甲醇(Fisher公司,色谱纯);乙腈(Fisher公司,色谱纯);其他试剂均为分析纯。
2 方法与结果 2.1 桂皮醛脂质体的制备称取处方量桂皮醛提取物、胆固醇、卵磷脂于250 mL茄形瓶中,加入无水乙醇溶解。置于旋转蒸发仪上,50 ℃水浴,无水乙醇完全回收后,茄形瓶内壁上形成一层乳白色均匀薄膜。加入磷酸盐缓冲液20 mL,水浴加热旋转,均匀混合后,于细胞破碎仪下超声5 min(超声5 s,停顿5 s,300 W),得乳白色均匀混悬液,依次过0.8、0.45、0.22 μm微孔滤膜,即为桂皮醛脂质体。4 ℃下保存备用。
2.2 脂质体中桂皮醛含量测定方法的建立 2.2.1 色谱条件采用Diamosil-C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈:0.1%磷酸=55:45;检测波长290 nm;流速1.0 mL/min;柱温30 ℃;进样量10 μL。在此色谱条件下,桂皮醛峰形对称,分离度良好。且空白脂质体在该处无吸收,说明辅料对其含量测定无影响。测定色谱图见图 1。
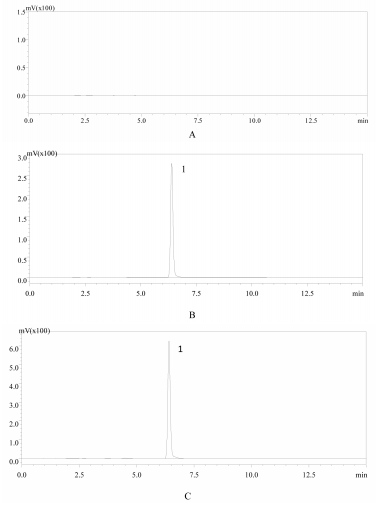
|
| A.空白脂质体;B.对照品;C.脂质体;1.桂皮醛 图 1 桂皮醛对照品及脂质体色谱图 |
精密称取桂皮醛对照品16.45 mg,置于10 mL棕色量瓶中,甲醇溶解并稀释至刻度,得到浓度为1 645 μg/mL的桂皮醛储备液,用甲醇分别稀释为82.25、41.125、32.90、20.56、8.225、3.29 μg/mL对照品溶液。
2.2.3 供试品溶液的制备精密量取脂质体溶液0.5 mL,置于5 mL棕色量瓶中,加入甲醇溶解超声处理30 min,定容至刻度,摇匀,即得。
2.2.4 线性范围的考察按照“2.1.2”项下方法处理对照品溶液,分别得到浓度为82.25、41.125、32.90、20.56、8.225、3.29 μg/mL的对照品溶液,在选定的色谱条件下,采用高效液项色谱法(HPLC)分析,测定桂皮醛的峰面积,以峰面积Y为纵坐标,质量浓度X(μg/mL)为横坐标进行线性回归,得到回归方程Y=102 744X+50 214,R2=0.999 8,线性范围为3.29~82.25 μg/mL。
2.2.5 精密度、重复性、稳定性考察取32.9 μg/mL桂皮醛对照品溶液,连续HPLC进样测定6次,精密度的RSD为0.15%,小于2%,表明仪器的精密度良好。精密量取上述脂质体6份,按照“2.1.3”项下方法处理样品,HPLC进样测定峰面积,重复性的RSD为1.21%,小于2%,表明实验的重复性良好。按照“2.1.3”项下方法处理样品,分别于不同时间(0、2、4、8、12、24 h)HPLC进样测定峰面积,稳定性的RSD为0.35%,小于2%,表明样品的稳定性良好。
2.2.6 回收率考察精密量取已知含量的脂质体0.5 mL各9份,置于5 mL棕色量瓶中,分别加入低、中、高浓度的桂皮醛对照品溶液。加入甲醇超声处理30 min,定容至刻度,摇匀,测定。结果见表 1。
由以上结果可知,低、中、高浓度桂皮醛的平均回收率分别为99.76%、100.07%、100.52%,处于95%~105%之间,RSD均小于2%,说明本法具有良好的回收率。
2.3 桂皮醛脂质体包封率测定方法的建立 2.3.1 超滤法测定包封率取0.5 mL桂皮醛脂质体,超纯水定容至5 mL,取0.4 mL置于30 KD超滤管中,4 000 r/min离心5 min,取下层离心液体至10 mL容量瓶中,甲醇洗涤超滤管3次,与上述离心液合并,定容至10 mL。HPLC测得脂质体中游离药物的含量(C游离);按2.1.3测定脂质体中桂皮醛的含量(C总)。根据包封率(EE)的计算公式计算样品中桂皮醛的包封率。
包封率(EE)=(C总-C游离)/C总×100%
2.3.2 超滤管预饱和次数考察实验发现超滤膜会对桂皮醛产生一定程度的吸附,需要在使用前对超滤膜进行预饱和,以桂皮醛的甲醇溶液对饱和次数进行了考察,结果见表 2。
由结果可知,预饱和2次后回收率已符合要求,在95%~105%之间,因此在接下来实验中,需对超滤管预饱和2次后再进行相关操作。
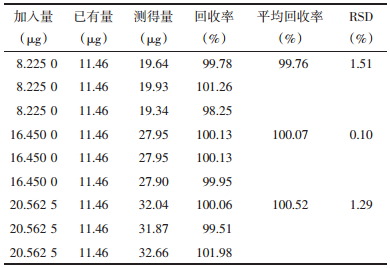
2.3.3 超滤法方法回收率考察配制低、中、高3种含量的桂皮醛的甲醇溶液,取0.4 mL置于已饱和的30 KD超滤管中,4 000 r/min离心5 min,取下层离心液体至10 mL容量瓶中,甲醇洗涤超滤管3次,与上述离心液合并,定容至10 mL。测定桂皮醛的含量。每一浓度平行3份,计算回收率。结果见表 3。
由上表结果可知,低、中、高不同含量的桂皮醛甲醇溶液经过预饱和的超滤管后,回收率均在95%~105%之间,RSD小于2%,说明已饱和的超滤膜对桂皮醛无吸附作用。
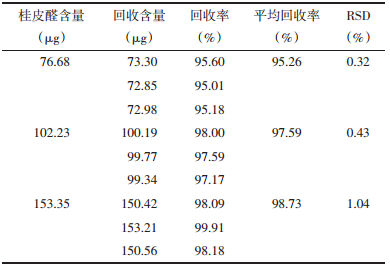
2.3.4 桂皮醛脂质体包封率加样回收率考察精密量取空白桂皮醛脂质体0.5 mL,各9份,置于5 mL棕色量瓶中,分别加入不同含量的桂皮醛溶液至容量瓶中,定容至5 mL,摇匀。取0.4 mL置于30 KD超滤管中,4 000 r/min离心5 min,取下层离心液体至10 mL容量瓶中,甲醇洗涤超滤管3次,与上述离心液合并,定容至10 mL。高效液相色谱法(HPLC)测桂皮醛的含量,计算其加样回收率。结果见表 4。
由上表结果可知,低、中、高不同含量的桂皮醛溶液加入到空白脂质体中后,回收率均在95%~105%之间,RSD小于2%,说明超滤法可有效分离脂质体中未包封的药物,可用于脂质体包封率的测定。
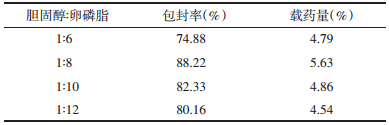
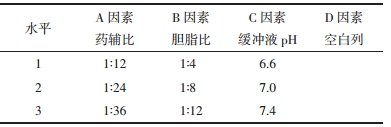
2.4 单因素考察筛选处方 2.4.1 胆固醇与卵磷脂质量比例的考察固定药脂比为1:16,即桂皮醛含量10 mg,磷脂与胆固醇总量为160 mg,磷酸盐缓冲液pH 7.4,水化成膜温度55 ℃。设置胆固醇与磷脂的比例为1:6、1:8、1:10、1:12,按2.3.1分别测定脂质体的包封率及载药量,每组平行操作两份,结果见表 5。
实验结果显示,其余制备条件不变,随着磷脂胆固醇比例的改变,脂质体的包封率及载药量有明显变化(P < 0.05),当胆固醇:磷脂比例在1:8时,制备的脂质体包封率及载药量最大。因此,以胆固醇:磷脂质量比为1:8为基础,选取不同比例作为后期考察优化的条件。
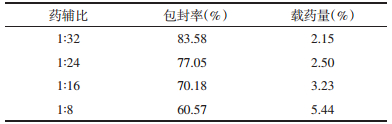
2.4.2 桂皮醛与辅料质量比例的考察固定磷脂胆固醇比例为1:8,即桂皮醛含量10 mg,磷酸盐缓冲液pH 7.4,水化成膜温度55 ℃。设置桂皮醛与胆固醇磷脂的质量比例为1:8、1:16、1:24、1:32,按2.3.1分别测定脂质体的包封率及载药量,每组平行操作两份,结果见表 6。
实验结果显示,其余制备条件不变,随着药辅比的改变,脂质体的包封率及载药量有明显变化(P < 0.05)。随着药辅比的增加,包封率不断增大,但随着药辅比增高,载药量也随之降低。因此,选取不同桂皮醛与辅料的质量比,以综合评分的方式作为后期考察优化的条件。
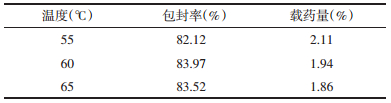
2.4.3 水化温度的考察固定磷脂胆固醇的比例为1:8,桂皮醛与磷脂胆固醇总量比例为1:32,即桂皮醛含量10 mg,胆固醇355.55 mg,磷脂2 844.44 mg,磷酸盐缓冲液pH 7.4,改变水化温度分别为55 ℃、60 ℃、65 ℃,按2.3.1分别测定脂质体的包封率及载药量,每组平行操作两份,结果见表 7。
实验结果显示,随着水化温度的改变,在相同的制备条件,55、60、65 ℃不同的水化温度下,桂皮醛脂质体包封率及载药量无明显变化(P>0.05)。基于资源节约的角度考虑,选定55 ℃作为水化温度,后期不列入正交考察处方范围内。
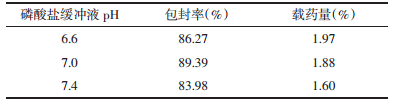
2.4.4 磷酸盐缓冲液pH值的考察固定磷脂胆固醇的比例为1:8,桂皮醛与磷脂胆固醇总量比例为1:32,即桂皮醛含量10 mg,胆固醇355.55 mg,磷脂2 844.44 mg,水化温度为55 ℃,改变磷酸盐缓冲液pH值分别为6.6、7.0、7.4,按2.3.1分别测定脂质体的包封率及载药量,每组平行操作两份,结果见表 8。
实验结果显示,相同的制备条件下,随着磷酸盐缓冲液pH的改变,脂质体的包封率有明显变化(P < 0.05),pH值为7.0时,包封率和载药量相对较大,因此,以pH7.0为基础,选取不同pH的磷酸盐缓冲液作为后期考察优化的条件。
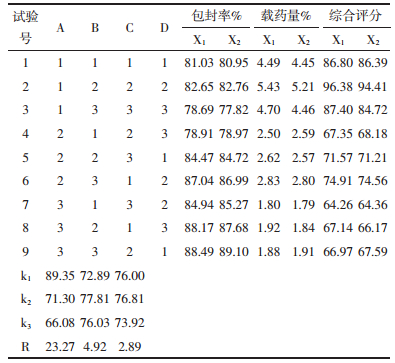
2.5 正交法优化处方 2.5.1 正交实验通过单因素考察,确定主要影响制备的因素为桂皮醛与辅料的比例(A)、胆固醇与卵磷脂的比例(B)、磷酸盐缓冲液的pH值(C),以桂皮醛脂质体的包封率及载药量为参考指标,每个因素设计三个水平,选用L9(34)正交表,进行正交试验。正交结果见表 9-11。
以包封率与载药量权重各50%进行综合评分。综合评分的公式为Y=Ai/AmaxX 50%+=Bi/BmaxX 50%(Y为综合评分,A为包封率,B为载药量)。由正交试验结果显示,极差的大小顺序为A>B>C,桂皮醛脂质体制备工艺中影响包封率的主次因素顺序为A>B>C,即桂皮醛与辅料的比例影响最大,胆固醇与磷脂质量比例次之,磷酸盐缓冲液pH最小。经方差分析,桂皮醛与辅料的比例(A)、胆固醇与卵磷脂的比例(B)对包封率有统计学意义,磷酸盐缓冲液的pH值(C),对包封率有统计学意义。
以综合评分为指标,最佳处方工艺为A1B2C2,为正交表中第2号试验。即桂皮醛与辅料质量为1:12,胆固醇与磷脂质量比为1:8,磷酸盐缓冲液pH为7.0,水化温度55 ℃下,为桂皮醛脂质体制备的最佳工艺。
2.5.2 正交验证实验按上述最佳处方采用薄膜-超声分散法制备3批桂皮醛脂质体,测定包封率分别为82.16%、81.04%、82.38%;载药量为5.58%、5.18%、5.57%。表明3批桂皮醛脂质体的包封率无显著性差异,制备工艺重现性良好。
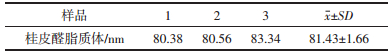
2.6 桂皮醛的表征及稳定性试验 2.6.1 脂质体粒径测定制备桂皮醛脂质体各3份,用纯净水稀释到适当倍数,用激光粒度分析仪测定其粒径分布情况。结果见表 12,图 2。脂质体平均粒径为81.43 nm,多分散性系数为0.209,分布均匀,符合脂质体的制备要求。
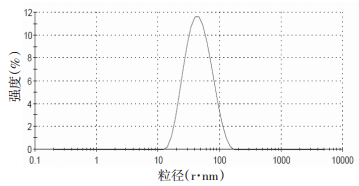
|
| 图 2 桂皮醛脂质体粒径分布图 |
肉眼观察桂皮醛脂质体为均一乳白色胶体溶液,稀释可见乳光;采用透射电镜观察其形态,结果见图 3。脂质体形态单一稳定。

|
| 图 3 桂皮醛脂质体60 000x透射电镜照片 |
取2.6.3中验证试验中制备的桂皮醛脂质体,4 ℃保存,观察脂质体溶液依旧透明澄清,无明显沉淀出现,14 d后测定其渗漏率。结果如下表 13。桂皮醛脂质体溶液的渗漏率均小于2%,所制备的脂质体较为稳定。
在脂质体处方中,卵磷脂与胆固醇能够起到膜流动性调节剂的作用,卵磷脂及胆固醇比例的改变对成膜效果有着重要的影响;成膜后加入水化溶液在一定的温度下可形成脂质体。因此单因素试验中考察了胆脂比、药辅比、水化成膜温度、磷酸盐缓冲液pH,实验结果表明,除水化温度外,随着胆脂比、药辅比、磷酸盐缓冲液pH的改变,桂皮醛脂质体的包封率及载药量均有较为显著的变化,因此后期将其列入进一步优化的水平。
本实验对超滤管的预饱和次数进行了考察;对超滤后的液体通过加甲醇洗涤、定容的方式进行处理,保证了游离药物测定的准确性。脂溶性药物难溶于水,易溶于有机溶剂,但有机溶剂的加入会造成脂质体的破乳。因此超滤法测定脂溶性药物时还存在较难考察回收率的问题。本实验通过采用微量注射器进样注入微量高浓度桂皮醛甲醇溶液避免了对脂质体造成破乳。通过对桂皮醛脂质体包封率的测定,证明可采用超滤法测定脂溶性药物包封率。实验中制备的脂质体粒径为81.43nm,可携带药物透过皮肤角质层屏障,在皮下形成药物储库。因此,桂皮醛脂质体对皮肤光老化的治疗具有一定的临床意义。作为一种外用剂型,桂皮醛脂质体的具体给药形式,经皮渗透行为及长期稳定性等都会直接影响疗效,实验后期也将继续完善此部分内容。
| [1] |
Levine JA, Sorace M, Spencer J, et al. The indoor UV tanning industry:a review of skin cancer risk, health benefit claims, and regulation[J]. Journal of the American Academy of Dermatology, 2005, 53(6): 1038. DOI:10.1016/j.jaad.2005.07.066 |
| [2] |
王强. 光老化预防和治疗的新进展[J]. 国际皮肤性病学杂志, 2001, 27(2): 83-85. DOI:10.3760/cma.j.issn.1673-4173.2001.02.006 |
| [3] |
吴秋菊, 马鹏程, 陈志强. 维A酸类药物系统用药的常见不良反应及其对策[J]. 国外医学.皮肤性病学分册, 2013(6): 336-339. |
| [4] |
Uliasz A, Spencer JM. Chemoprevention of skin cancer and photoaging[J]. Clinics in Dermatology, 2004, 22(3): 178. DOI:10.1016/j.clindermatol.2003.12.012 |
| [5] |
Rendon MI, Berson DS, Cohen JL, et al. Evidence and considerations in the application of chemical peels in skin disorders and aesthetic resurfacing[J]. Journal of Clinical & Aesthetic Dermatology, 2010, 3(7): 32. |
| [6] |
周凌, 伍津津, 鲁元刚, 等. 肉桂醛对黑素瘤A375细胞凋亡和VEGFMMP-9表达的影响[J]. 中国皮肤性病学杂志, 2013(8): 763-766. |
| [7] |
Kwon HK, Hwang JS, So JS, et al. Cinnamon extract induces tumor cell death through inhibition of NF kappaB and AP1[J]. BMC cancer, 2010, 10(1): 392. DOI:10.1186/1471-2407-10-392 |
| [8] |
周凌, 晏洪波. 肉桂醛对UVA照射后体外成纤维细胞表达MMP-1, MMP-3和MAPK信号的影响[J]. 中国皮肤性病学杂志, 2015(2): 114-117. |
| [9] |
侯慧茹, 赵丽, 于凌. 皮肤光老化的机制及延缓皮肤衰老方法的研究[J]. 中国组织工程研究, 2004, 8(26): 5629-5631. DOI:10.3321/j.issn:1673-8225.2004.26.097 |
 2019, Vol. 38
2019, Vol. 38