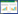文章信息
- 韩润萍, 刘志东, 皮佳鑫, 王舒雅, 刘博缨, 常梦春
- HAN Runping, LIU Zhidong, PI Jiaxin, WANG Shuya, LIU Boying, CHANG Mengchun
- 苦黄栓的制备与刺激性评价
- The preparation and irritation evaluation of Kuhuang suppository
- 天津中医药大学学报, 2019, 38(2): 186-189
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(2): 186-189
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.02.20
-
文章历史
收稿日期: 2018-11-21
2. 天津中医药大学现代中药发现与制剂技术教育部工程研究中心, 天津 301617
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin 301617, China
阴道炎是一种很常见的妇科疾病,分为霉菌性阴道炎、滴虫性阴道炎、细菌性阴道炎(非特异性阴道炎),常见症状为白带增多,阴道灼热瘙痒等,严重影响着女性的身心健康[1]。如果不能及时治疗,会导致以下危害:影响夫妻生活,造成不孕,诱发宫颈糜烂,甚至引起宫颈癌恶疾,影响胎儿发育等[2]。从中医角度看,阴道炎的发病机制在于肝肾阴虚,肝郁气滞,湿热下注[3]。除此之外,不良习惯或过度清洁,免疫力低下和绝经后内分泌失调等因素也可引发阴道炎。中医治疗阴道炎以驱除湿热之邪为主[4]。苦黄栓处方由苦参,儿茶,黄柏,紫草及冰片组成。苦参有抑菌作用,可杀死阴道滴虫,对湿热下注及带下色黄效果明显;儿茶有活血散瘀、生肌止血、收湿的功效;黄柏有清热燥湿、泻火解毒及抑菌的功效;紫草有抑菌消炎、活血解毒的作用;冰片有清热止痛、消肿解毒的作用。本课题组拟制备中药妇科栓剂苦黄栓,并考察其阴道给药的安全性。
1 材料与方法 1.1 实验动物初成年SD大鼠,雌性,体质量(180~200)g,北京华阜康生物科技股份有限公司提供,合格证号SCXK(京)2009-0004。
1.2 仪器JA2103N千分之一电子天平(上海民桥),加热磁力搅拌(德国IKA集团),RBY-4融变时限检查仪(天津药典标准仪器厂),美国Millipore去离子水机。
1.3 药品与试剂聚氧乙烯(40)单硬脂酸酯(南京威尔化工有限公司),聚乙二醇1500(南京威尔化工有限公司),聚乙二醇1000(南京威尔化工有限公司),SUPPOCIRE NAS50(上海嘉法狮贸易有限公司提供),SUPPOCIRE BS2X(上海嘉法狮贸易有限公司提供);混合药粉(药厂提供),冰片(药厂提供),乙酸乙酯(分析纯),儿茶素标准品(中国食品药品检定研究院,其量以97.2%计,批号110877-201203),儿茶对照药材(中国药品生物制品检定研究院,批号121397-200401),甲醇(天津市康科德科技有限公司,色谱纯),三氯甲烷(天津市江天化工技术有限公司,分析纯),甲酸(天津市化学制剂批发公司,分析纯),去离子水,生理盐水(中国大冢制药有限公司)。
1.4 方法 1.4.1 苦黄栓的制备工艺加热基质(80 ℃)至完全融化,于50 ℃,以600 r/min的转速搅拌约5 min;加入已混匀的药粉,于50 ℃,以600 r/min的转速搅拌5 min至均匀;再加入研细且过80目筛的冰片粉,于50 ℃,常压条件下,以600 r/min的转速搅拌5 min至均匀;注模,室温冷却。
1.4.2 苦黄栓的基质筛选考察的油溶性基质有SUPPOCIRE NAS50、SUPPOCIRE BS2X。考察的水溶性基质有聚氧乙烯(40)单硬脂酸酯(S40)、聚乙二醇1500(PEG 1500)及聚乙二醇1000(PEG 1000)。分别采用油溶性基质与水溶性基质制备苦黄栓,以制备外观光滑完整,色泽均匀,硬度适宜,融变时限符合中国药典规定的苦黄栓。
栓剂的硬度评分等级:--(软);-(较软);0(适中);+(较硬);++(硬)。
1.4.3 儿茶的薄层色谱鉴别取苦黄栓2粒,置具塞锥形瓶内,在90 ℃水浴中加热融化,取出,趁热加入乙酸乙酯100 mL,充分振摇,放冷,置4 ℃的冰箱内20 min,取出,滤过,于5 mL滤液内加入2 mL去离子水,上层液作为供试品溶液。称取儿茶素标准品,加入甲醇,制成每1 mL含有2 mg的溶液,作为标准品溶液。称取儿茶对照药材0.2 g,加甲醇10 mL,浸渍20 min,滤过,滤液作为对照药材溶液。吸取上述供试品溶液、标准品溶液及对照药材溶液各2 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-甲酸(20:5:2)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105 ℃加热至斑点显色清晰[5]。
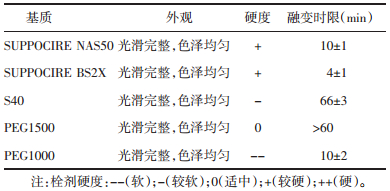
1.4.4 SUPPOCIRE NAS50基质苦黄栓的大鼠阴道黏膜刺激性研究健康的SD雌性大鼠40只,按随机数字表法随机分为4组,每组10只,分别为空白组(不给药)、低剂量组[30 mg/(只·次)]、中剂量组[60 mg/(只·次)]及高剂量组[120 mg/(只·次)],连续给药7 d,每日2次。每日观察并记录大鼠状态、阴道及外阴是否有充血、红斑或水肿和分泌物等情况,第8天处死,分离阴道组织,肉眼观察阴道黏膜是否有红肿、破溃、出血及分泌物等情况,10%甲醛溶液固定阴道样本,脱水、浸蜡、包埋、切片、苏木精-伊红(HE)染色,显微镜下进行病理学检查及分析[8-10]。
1.4.4.1 病理切片评价标准根据黏膜层鳞状上皮、角化层的完整性,基底细胞的状态及炎症细胞的浸润情况进行评价。
0级:低倍镜下黏膜层鳞状上皮及角化层完整清晰,基底细胞未见增生;高倍镜下黏膜层未见或偶见1~2个炎症细胞,黏膜下见少量炎症细胞浸润。
1级:低倍镜下黏膜层鳞状上皮及角化层基本完整,< 1/3区域角化层变薄或基底细胞呈增生状态;高倍镜下黏膜层可见3~8个炎症细胞,黏膜下见少量炎症细胞浸润。
2级:低倍镜下黏膜层鳞状上皮及角化层连续性较好,>1/3区域角化层变薄、缺失或基底细胞呈增生状态;高倍镜黏膜层可见较多(8~20个)炎症细胞或黏膜层变薄,黏膜下见较多炎症细胞浸润。
3级:低倍镜下黏膜层鳞状上皮及角化层连续性较差,< 1/3区域角化层缺失及表皮脱落坏死;高倍镜下黏膜层可见大量(>20个)炎症细胞浸润,黏膜上皮细胞坏死脱落,黏膜下见大量炎症细胞浸润。
4级:低倍镜下黏膜层鳞状上皮及角化层连续性差,>1/3区域角化层缺失及表皮脱落坏死;高倍镜下黏膜层见大量(>20个)炎症细胞浸润,黏膜上皮细胞坏死脱落,黏膜下见大量炎症细胞浸润。
1.4.4.2 统计方法采用SPSS17.0统计软件,Kruskal-Wallis H秩和检验进行统计分析。
2 结果 2.1 基质的筛选分别选择SUPPOCIRE NAS50、SUPPOCIRE BS2X及聚氧乙烯(40)单硬脂酸酯(S40)、聚乙二醇1 500、聚乙二醇1 000为基质时,所制栓剂的评价结果见表 1。
由表 1可知,选用SUPPOCIRE为苦黄栓的基质时,栓剂偏硬,融变时限符合药典规定。当选用聚氧乙烯(40)单硬脂酸酯(S40)为基质时,栓剂较软,融变时限偏长;选用PEG 1500为基质时,栓剂硬度适中,融变时限偏长;选用PEG 1000为基质时,栓剂软,融变时限短。综合考虑,采用SUPPOCIRE NAS50作为苦黄栓的基质。
2.2 儿茶的薄层色谱鉴别为初步建立苦黄栓的质量标准,进行了儿茶的薄层色谱鉴别。在与对照品色谱和对照药材色谱相应的位置上,供试品色谱显相同颜色的荧光斑点,阴性无干扰。见图 1。
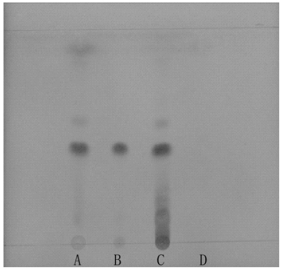
|
| A:苦黄栓;B:儿茶素标准品;C:儿茶对照药材;D:儿茶阴性栓 图 1 儿茶薄层色谱鉴别 |
连续给药3 d后,每天第2次给药时,可发现高剂量组部分大鼠有少量药栓残留;连续给药7 d期间,除上述情况外,未见充血、红斑或水肿现象。
第8天解剖取材,可见,高剂量组大鼠出现微量药物残留3例,腔道发干2例;中剂量组出现腔道发干1例;未见红肿、破溃、出血现象。
2.3.2 病理切片分析 2.3.2.1 显微镜下分析空白组:黏膜层细胞结构清晰完整,未见明显炎症细胞浸润。低剂量组:黏膜层细胞形态结构正常,未见明显异常。中剂量组:黏膜层结构完整清晰,细胞形态结构正常,未见明显炎症细胞浸润。高剂量组:黏膜层结构较完整,但局部散在点状上皮细胞脱落。见图 2。
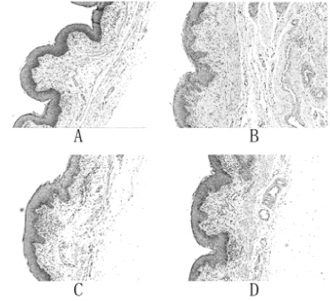
|
| A:分别为空白组、B:低剂量组、C:中剂量组、D:高剂量组 图 2 大鼠阴道病理切片显微镜(HE,×400) |
按“1.4.3.1”项下的方法进行评级分析,结果见表 2。
4组大鼠阴道病理切片评级结果差异性比较,采用非参数检验,得到χ2=0.337,P>0.05,无统计学差异。
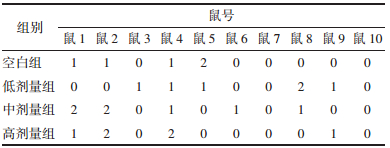
统计学分析中,各组两两比较的P值见表 3。P值均大于0.05,表示各组间无统计学差异。
阴道给药有见效快、疗效好、生物利用度高和不良作用少的优点[9],是一种非创伤治疗方式。临床上多采用西药栓剂为阴道炎患者治疗,虽可以得到良好效果,但很难从根本上治愈病症[10]。长期使用的患者容易对药物产生耐药性或依赖性[11],使得病情反复发作,且可引发严重的阴道炎并发症,重者导致阴道内菌群失衡,较大影响女性患者的生活质量和身体健康[12]。纯中药制剂苦黄栓具有清热解毒,燥湿杀虫及生肌之功效,其作用温和,直接作用于病患处,针对性强,对机体内环境干扰少,可用于阴道炎的治疗。
基质赋予栓剂外形,对制剂中药物的释放和吸收有一定的影响[13]。马慧平等[14]研究了3种不同基质苯巴比妥栓剂的药物动力学,结果有显著性差异。笔者采用SUPPOCIRE NAS50作为基质以制备苦黄栓,将进一步研究其动物体内的药物动力学。
除药效之外,阴道给药药物的刺激性试验受到了越来越多的重视[15-16]。本实验中,各给药组大鼠阴道均无红肿,破溃及出血现象;解剖后,高剂量组大鼠有微量药物残留现象,无其他异常;低倍及高倍镜下观察病理切片,各组大鼠阴道黏膜层结构完整清晰,细胞形态正常,未见明显炎症细胞浸润,统计学分析表明,给药组与空白组之间无显著差异。以上可得,苦黄栓为纯中药制剂,对大鼠阴道黏膜无明显刺激性,安全性较好,其临床药效待进一步研究。
| [1] |
林雨晴. 女性各种阴道炎的症状及危害[J]. 求医问药, 2007, 5(4): 30-31. |
| [2] |
孙翠珍, 张雪芬. 孕妇患霉菌性阴道炎对新生儿的危害[J]. 人口战线, 1994, 8(2): 64. |
| [3] |
李影. 中医治疗阴道炎的临床方案探析[J]. 中国医药指南, 2012, 10(26): 245-246. |
| [4] |
梁卫勇. 湿热郁蒸致女性外阴炎、阴道炎发病机制探讨[J]. 长春中医药大学学报, 2012, 28(2): 198-199. DOI:10.3969/j.issn.1007-4813.2012.02.004 |
| [5] |
国家药典委员会. 中华人民共和国药典[M]. 一部.北京: 化学工业出版社, 2015: 1435-1436.
|
| [6] |
田芳, 周红精, 王玉柱, 等. Nifeviroc微乳热敏原位凝胶对大鼠阴道和阴道细胞的毒性研究[J]. 毒理学杂志, 2013, 27(6): 447-450. |
| [7] |
迟晓娟, 朱志杰, 张淞, 等. 治糜康栓的黏膜刺激性研究[J]. 现代中医药, 2013, 33(6): 88-89. |
| [8] |
国家食品药品监督管理局. 中药、天然药物刺激性和溶血性研究的技术指导原则[M]. 北京: 人民卫生出版社, 2005.
|
| [9] |
张恒, 普俊学, 王乙鸿, 等. 中药栓剂的临床应用及其新剂型[J]. 安徽医药, 2015, 9(10): 1841-1844. DOI:10.3969/j.issn.1009-6469.2015.10.002 |
| [10] |
吴茗玉, 张海虹. 克霉唑与氟康唑联合治疗复发性念珠菌性阴道炎疗效观察[J]. 现代中西医结合杂志, 2013, 22(20): 2204-2206. DOI:10.3969/j.issn.1008-8849.2013.20.016 |
| [11] |
康玖玉. 炎复康栓治疗阴道炎的疗效观察[J]. 实用妇科内分泌杂志(电子版), 2016, 3(6): 32-33. |
| [12] |
王娜梅, 崔琳, 马春芬, 等. 苦参凝胶联合氟康唑胶囊治疗霉菌性阴道炎的临床观察[J]. 中国中药杂志, 2015, 40(5): 978-980. |
| [13] |
孙敏哲, 赵健铤, 李修琴, 等. 栓剂的研究与应用进展[J]. 广州化工, 2016, 44(13): 1-3, 28. DOI:10.3969/j.issn.1001-9677.2016.13.001 |
| [14] |
马慧平, 何晓英, 葛欣, 等. 三种不同基质的苯巴比妥栓在家兔体内的药物动力学研究[J]. 华西药学杂志, 1999, 14(5-6): 349-351. |
| [15] |
刘用国, 王江融, 李鸣. 赛霉安阴道栓对家兔阴道黏膜刺激试验[J]. 海峡药学, 2007, 19(4): 27-29. DOI:10.3969/j.issn.1006-3765.2007.04.014 |
| [16] |
孙志强.苦柏洁阴栓的研制[D].济南: 山东中医药大学, 2015.
|
 2019, Vol. 38
2019, Vol. 38