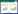文章信息
- 欧阳慧子, 何俊
- OUYANG Huizi, HE Jun
- 淫羊藿化学成分分析及其药代动力学研究进展
- Research progress on the quantitative analysis of chemical constituents in Epimedium herb and its pharmacokinetics
- 天津中医药大学学报, 2019, 38(3): 219-227
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(3): 219-227
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.03.04
-
文章历史
收稿日期: 2019-02-11
2. 天津中医药大学, 天津 301617;
3. 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 301617
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Tianjin State Key Laboratory of Modern Chinese Medicine, Co-construction of Province and Ministry, State Key Laboratory Breeding Base, Tianjin 301617, China
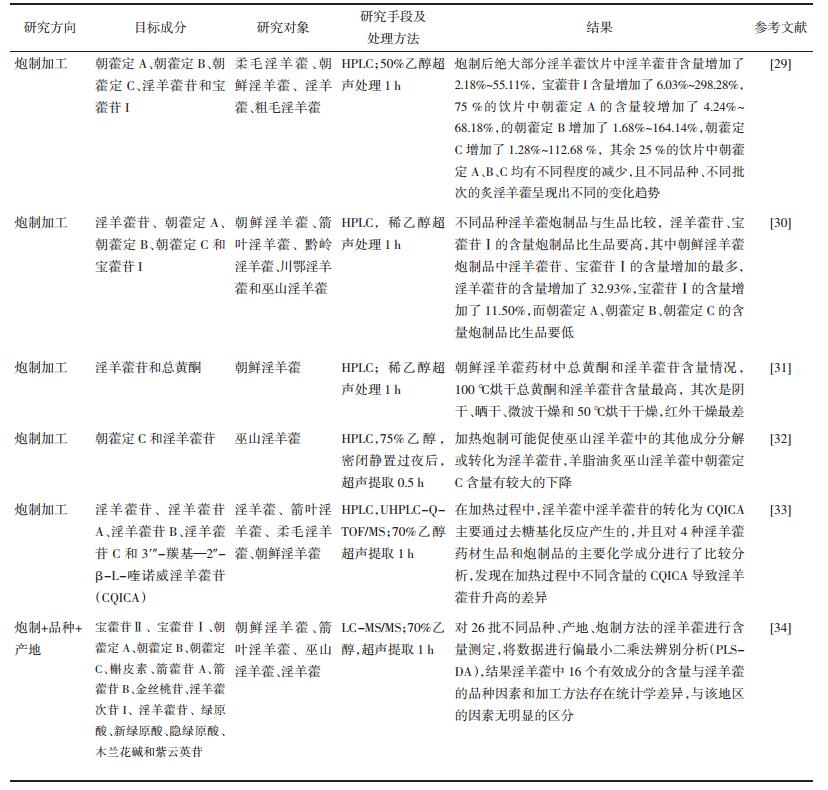
淫羊藿(Epimedium davidii Franch)为中国传统的补益中药,始载于《神农本草经》,有补肾阳,强筋骨,祛风湿的功效[1-2]。研究表明淫羊藿具有防治骨质疏松、抗抑郁、抗哮喘以及抗老年痴呆等功效[3-10]。淫羊藿成分复杂,见图 1。其成分变化将直接影响体内过程,进而影响临床药效。笔者以整理淫羊藿各化学成分分析及药代动力学研究为切入点,对饮片化学成分与品种、产地、部位、加工炮制关联性研究及近年来相关药代动力学研究进行回顾,为开发淫羊藿新的药物制剂及临床用药提供依据。
|
| 图 1 淫羊藿中代表性化学成分结构 |
中国淫羊藿资源丰富且分布广泛。全国有淫羊藿属植物43种,除了《中华人民共和国药典》收载的小檗科植物淫羊藿(Epimedium brevicornu Maxim.)、箭叶淫羊藿[Epimedium sagittatum(Sieb.et Zucc.)Maxim.]、柔毛淫羊藿(Epimedium pubescens Maxim.)及朝鲜淫羊藿(Epimedium koreanum Nakai)以外,已形成商品流通的药材品种有十余种[11],主要分布在四川、重庆、贵州及东北各省区,其他南方各省区也有少量分布[12]。此外,淫羊藿的采收部位、采收时间及加工炮制亦等因素影响着药材质量的稳定性和有效性。因此,淫羊藿有效成分的定量研究主要集中于产地、植物基源、不同药用部位及加工炮制的相关方面见表 1-4。
纵观近年来淫羊藿分析测定方法的研究报道,UV分光光度法适于测定总黄酮类成分;高效液相色谱法(HPLC)适于用作淫羊藿及淫羊藿相关产品中黄酮类、酚酸类及生物碱成分质量控制方法的建立;超高效液相色谱法(UPLC)的应用,既可节约淫羊藿的分析时间、对降低试剂消耗量;高效液相色谱与谱联用技术(LC-MS/MS)的发展在淫羊藿含量测定研究方面发挥着巨大的作用,尤其对组分复杂、化学结构相近、难分离的淫羊藿成分分析具有重要的意义[13-14]。
1.2 指标成分淫羊藿有效成分含量研究主要集中于黄酮类成分,如淫羊藿苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿次苷Ⅰ、宝藿苷Ⅰ和宝藿苷Ⅱ等,酚酸类及生物碱类成分亦可见少量报道,且研究思路从关注一种指标成分到同时测定十几种,再升级为由十几种指标成分归纳出最终质控成分[15]。此外,“一测多评”技术,建立淫羊藿多指标成分控制的方法,开展药材-饮片-中成药整体的质量评价,以满足其复杂成分的质量控制需求[16]。
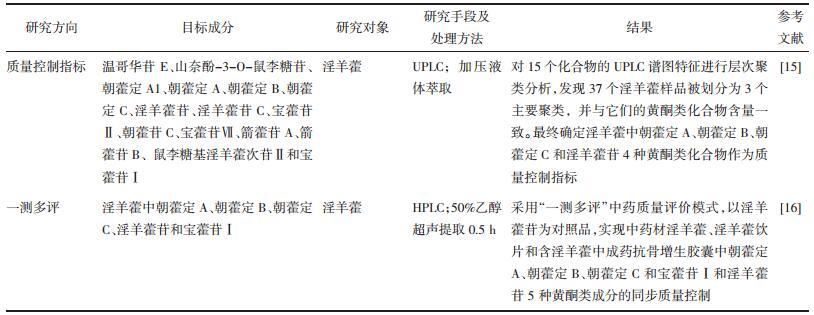
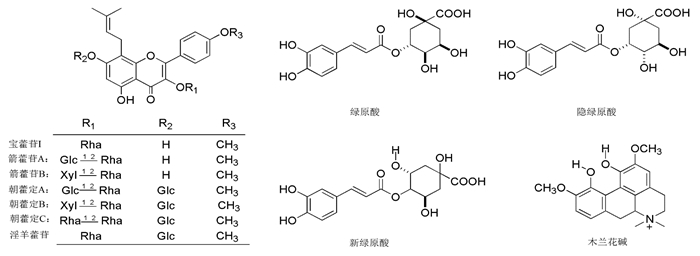
1.3 产地淫羊藿有效成分在植株体内存在相互转化关系,影响其转化的关键酶基因对光、热、温度等生态因素较为敏感,因此,产地气候环境的不同造成有效成分的差异,从而造成其临床疗效的差异。从表 1中可以看出四川、甘肃产的淫羊藿药材中几种黄酮类成分的含量普遍较高[17-22],本课题组发现见图 2。不同产地的淫羊藿药材中槲皮素、隐绿原酸、朝藿定B、箭藿苷A、绿原酸、箭藿苷B存在较大差异。
|
| 图 2 不同产地的淫羊藿PLS-DA分析VIP值图 |
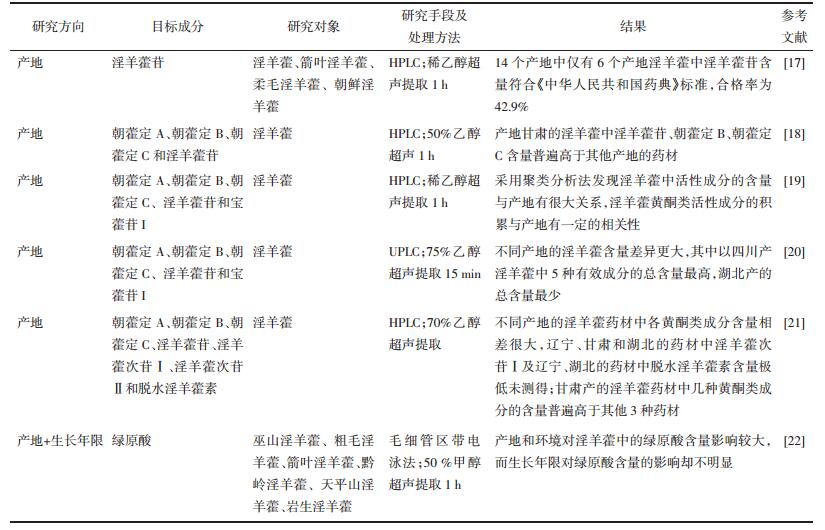
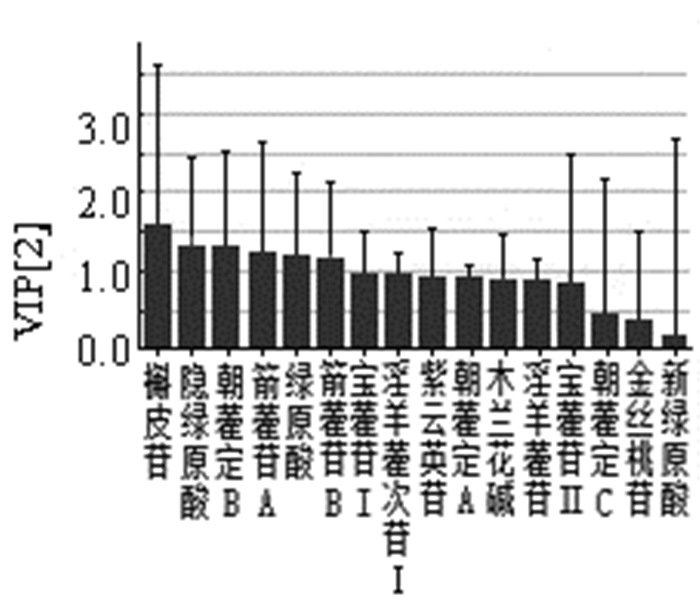
不同品种的淫羊藿中有效成分(如:隐绿原酸、朝藿定C、绿原酸、淫羊藿苷、木兰花碱、朝藿定A、新绿原酸和宝藿苷Ⅰ)含量差异较大,见图 3,部分淫羊藿品种市场上常常相互混杂,因此区分不同品种淫羊藿的有效成分差异,对淫羊藿药材的质量评价具有重要意义[23-25]。同时,中国的淫羊藿品种有40多种,但《中华人民共和国药典》仅收录5种,因此根据淫羊藿有效成分-品种的相关性进行细化研究,从而扩大淫羊藿的药源。
|
| 图 3 不同品种的淫羊藿PLS-DA分析VIP值图 |
淫羊藿不同生长部位的有效成分含量也存在很大差异,如淫羊藿苷及总黄酮含量趋势为叶>地上部分>全草>根>茎,多糖含量趋势为根>叶>茎和叶柄,朝鲜淫羊藿中各部位中根茎中木兰花碱含量最高[26-28]。此外,从主要成分的构成和相对含量来看,叶与茎相似,而地下部分却极不相同,这些情况会造成临床药效上的差异。由此,明确不同部位有效成分的分布规律,可促进淫羊藿药用部位的合理利用,进而提高淫羊藿资源利用度。
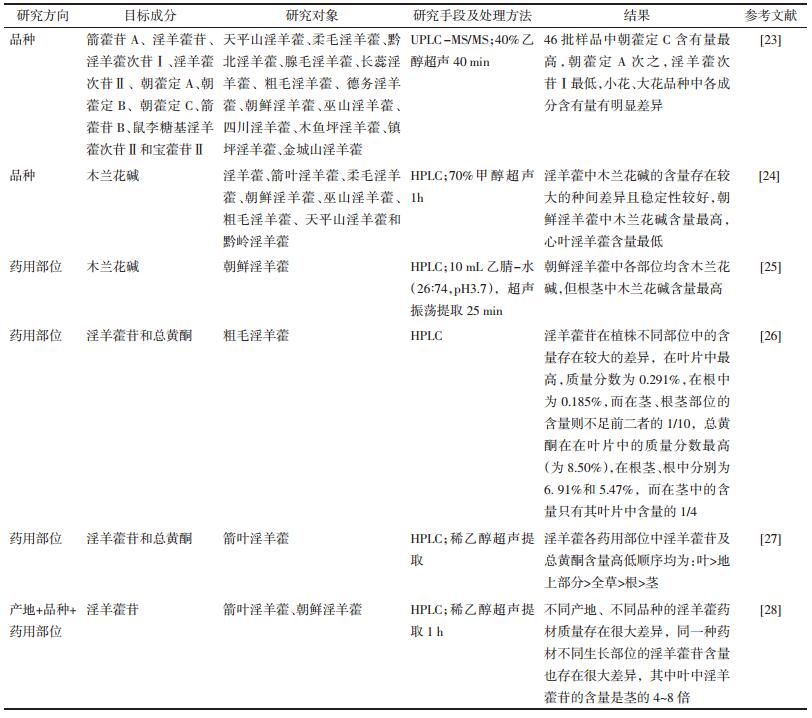
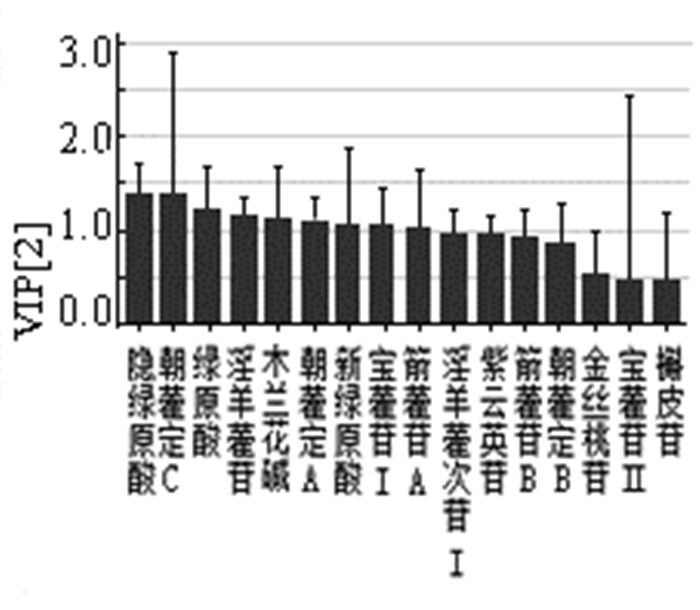
1.6 炮制加工淫羊藿中很多黄酮苷类成分具有相同的母核,在结构上仅有糖基的连接位置、种类及数目的差异,其有效成分受加工炮制的影响较大,大部分淫羊藿经炮制后淫羊藿苷、宝藿苷Ⅰ的含量增加,而朝藿定A、朝藿定B、朝藿定C的含量减少,并且炮制加工的工艺、温度、辅料均能影响其含量变化[29-32]。如图 4所示,本课题组研究发现饮片炮制前后淫羊藿次苷Ⅰ、宝藿苷Ⅱ、箭藿苷B和箭藿苷A含量差异较大。通过研究淫羊藿饮片炮制过程中化学物质的变化规律,发现尤其是黄酮类有效成分转化规律及明确其转化来源,对阐明淫羊藿饮片炮制的科学内涵具有重要意义[33-34];细化不同炮制品的淫羊藿的质量控制标准,揭示其不同炮制品的成分差别与功效差别相关性,可为淫羊藿炮制品质量及临床合理使用提供理论依据。
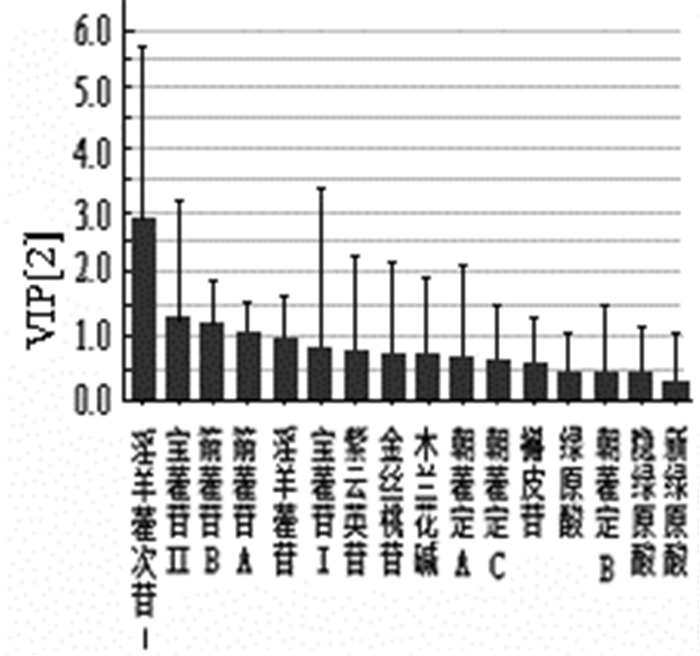
|
| 图 4 炮制前后淫羊藿PLS-DA分析VIP值图 |
近年来,淫羊藿有效成分的体内药代动力学过程日渐成为热点,笔者对近年来淫羊藿有效成分体药代动力学研究进行总结归纳,见表 6。
在淫羊藿类化合物生物样本检测方法中,使用较多的为HPLC法和LC-MS/MS法。HPLC法具有仪器使用及维护简单,成本低等优点,但存在着检测方法灵敏度不高等缺点,LC-MS/MS法由于灵敏度高选择性强,应用日益广泛。除了传统的液液萃取法、蛋白沉淀法,新兴的移液器尖端固相萃取技术也应用到淫羊藿生物样品处理过程中。
在淫羊藿体内药动研究中,指标成分多为单一或多个朝藿定A、B、C及淫羊藿苷等黄酮类成分[35],其他黄酮类成分(如宝藿苷Ⅱ、箭藿苷A、箭藿苷B)、酚酸类及生物碱类等成分亦有少量报道,目前可同时检测体内有效成分多达十几种[36]。已开展的体内研究中,多以大鼠为实验对象,以犬或人作为研究对象的报道较少,并且研究发现淫羊藿成分吸收代谢等动力学过程可能存在种属差异[37]。大多数研究表明朝藿定A、B、C及淫羊藿苷具有吸收快、峰浓度高、消除中速等动力学特点,其中朝藿定C相对其他3种化合物来说吸收和消除最慢。部分研究也发现[35-37],淫羊藿苷在人体内未检测到原型,但在大鼠和犬体内可以检测得到,在大鼠体内的药物吸收程度略高于Beagle犬。淫羊藿总黄酮类成分药代动力学特点与单个黄酮成分有所差异,总黄酮组大鼠淫羊藿苷及淫羊藿次苷Ⅱ血药浓度均低于单个黄酮成分组[38]。
在组方配伍对淫羊藿黄酮类药物动力学参数影响的研究中,结果二仙汤中黄酮类成分吸收程度低于黄酮类提取物给药,具有统计学差异[39]。在疾病对淫羊藿药物动力学影响的研究中,9种黄酮类成分的药-时曲线均呈现双峰现象,骨质疏松会对淫羊藿总黄酮提取物在大鼠体内产生吸收速率明显减慢,吸收程度显著降低的影响[40]。
在炮制对淫羊藿黄酮类药动学参数影响的研究中,炙淫羊藿中的淫羊藿苷在大鼠体内的吸收量有所提高,炮制可提高淫羊藿苷的生物利用度[41]。另有研究发现3种规格淫羊藿炮制品中,以宝藿苷Ⅰ为检测指标,达峰浓度(Cmax)、药时曲线下面积(AUC)等药动学参数大小为油炙品>加热品>生品,推测羊脂油能促进淫羊藿提取物中宝藿苷Ⅰ的口服吸收[42]。
在淫羊藿非口服给药的药代动力学研究中,大鼠肌肉注射给予喘可治注射液(由中药淫羊藿和巴戟天配伍组成)后,4种淫羊藿黄酮成分(朝藿定A、B、C及淫羊藿苷)血药浓度迅速升高,在10~15 min左右达峰,随后很快消除,除朝藿定C外其他化合物血药浓度均维持在较低水平[43];大鼠腹腔注射10 mg/kg淫羊藿素,淫羊藿素在大鼠体内迅速代谢成葡萄糖醛酸Ⅱ相代谢物(即淫羊藿素葡萄糖醛酸代谢物),并且在2 h其代谢产物达到最大浓度[44]。在药物相互作用研究中,学者发现淫羊藿对达泊西汀在大鼠体内的药动力学过程未造成影响[45]。传统的液液萃取、沉淀蛋白样品处理;但淫羊藿可显著降低西地那非的血药浓度及生物利用度,故提示临床上应避免淫羊藿相关制剂和西地那非的联合使用[46]。
3 结语与展望近年来,淫羊藿在治疗生殖系统疾病、乳腺疾病和骨质疏松症等方面均取得了较好的临床疗效[47],淫羊藿化学成分分析及药代动力学研究已成为国内外研究的焦点。因此,寻找合适的分析方法是解决目前淫羊藿质量控制问题的前提,其次对不同品种、不同产地、不同采收期和不同加工炮制方法的淫羊藿进行系统性的研究,进而提供高效精准的淫羊藿质控手段。此外,淫羊藿的重金属及农药残留的研究少有报道,应考虑研究并建立相关评价标准,为栽培基地的选择及栽培过程把控提供依据。
在体内药动学研究中,淫羊藿中有效成分并非以原型进入人血液中发挥作用,因此应积极寻找适宜的指标性成分并开展相关的药动学研究。组方配伍、药物相互作用及机体病理状态均对其指标性成分的药动力学参数具有显著影响。淫羊藿提取物对CYP450代谢酶有调节作用[48],但尽管已有淫羊藿中西药相互作用的报道,然而相互作用对淫羊藿的药动学影响尚未报道,相互作用是否因改变肠道菌群、转运蛋白或P450代谢酶等机制所致尚有待考证。
笔者系统综述了淫羊藿的化学成分分析及药代动力学研究,整体把握产地品种-种植采收-加工炮制-组方配伍-体内过程的影响因素,对淫羊藿质量控制、合理用药以及新药开发有着重要的意义。
| [1] |
国家药典委员会. 中华人民共和国药典一部[J]. 北京:中国医药科技出版社, 2015, 327-328. |
| [2] |
孟宁, 孔凯, 李师翁. 淫羊藿属植物化学成分及药理活性研究进展[J]. 西北植物学, 2010, 30(5): 1063-1073. |
| [3] |
陈旭凤, 喻澜, 夏秦. 淫羊藿苷促前成骨细胞MC3T3-E1成骨分化的实验研究[J]. 中国中西医结合杂志, 2018, 38(6): 687-692. |
| [4] |
赵锦, 朱雯. 淫羊藿苷对IgA肾病大鼠纤维化和炎症反应的调控作用[J]. 免疫学杂志, 2018, 34(5): 385-392. |
| [5] |
夏世金, 沈自尹, 俞卓伟, 等. 基于基因表达谱研究淫羊藿总黄酮干预老年大鼠海马炎性衰老的效果与机制[J]. 实用老年医学, 2010, 24(1): 24-27. DOI:10.3969/j.issn.1003-9198.2010.01.008 |
| [6] |
朱翠香, 彭玲玲, 潘宇政, 等. 淫羊藿对气管切开插管留置大鼠免疫功能的影响[J]. 广西医学, 2018, 40(7): 803-807. |
| [7] |
Wang GQ, Li DD, Huang C, et al. Icariin reduces dopamin-ergic neuronal loss and Microglia-Mediated inflammation in vivo and in vitro[J]. Front Mol Neurosci, 2017, 10: 441. |
| [8] |
Chi A, Shen Z, Zhu W, et al. Characterization of a proteinbound polysaccharide from Herba Epimedii and its metabolic mechanism in chronic fatigue syndrome[J]. J Ethnopharmacol, 2017, 203: 241-251. DOI:10.1016/j.jep.2017.03.041 |
| [9] |
Shou D, Zhang Y, Shen L, et al. Flavonoids of herba epimedii enhances bone repair in a rabbit model of chronic osteomyelitis during post-infection treatment and stimulates osteoblast proliferation in vitro[J]. Phytother Res, 2017, 31(2): 330-339. DOI:10.1002/ptr.v31.2 |
| [10] |
Cho JH, Jung JY, Lee BJ, et al. Epimedii herba:A promis-ing herbal medicine for neuroplasticity[J]. Phytother Res, 2017, 31(6): 838-848. DOI:10.1002/ptr.5807 |
| [11] |
袁航, 曹树萍, 陈抒云, 等. 淫羊藿的化学成分及质量控制研究进展[J]. 中草药, 2014, 45(24): 3630-3640. DOI:10.7501/j.issn.0253-2670.2014.24.024 |
| [12] |
Jiang J, Song J, Jia XB. Phytochemistry and ethnopharma-cology of Epimedium L. species[J]. Chinese Herbal Medicines, 2015, 7(3): 204-222. |
| [13] |
李遇伯, 孟繁浩, 鹿秀梅, 等. 淫羊霍化学成分的研究[J]. 中国中药杂志, 2005, 30(8): 586. DOI:10.3321/j.issn:1001-5302.2005.08.007 |
| [14] |
郭青, 吴晓燕, 宁青, 等. 淫羊藿茎叶中5种黄酮类成分分析及质量评价[J]. 中草药, 2011, 42(10): 2028-2032. |
| [15] |
Chen XJ, Ji H, Zhang QW, et al. A rapid method for simul-taneous determination of 15 flavonoids in Epimedium using pressurized liquid extraction and ultra-performance liquid chromatography[J]. Journal of Pharmaceutical and Biomedi-cal Analysis, 2008, 46(2): 226-235. DOI:10.1016/j.jpba.2007.09.016 |
| [16] |
冯伟红, 李春, 张锴镔, 等. "一测多评"模式在淫羊藿药材、饮片及含淫羊藿中成药黄酮类成分检测中的一体化研究[J]. 中国中药杂志, 2016, 41(15): 2843-2854. |
| [17] |
吴文辉, 冯健, 耿媛媛, 等. 14个产地淫羊藿中淫羊藿苷含量测定[J]. 亚太传统医药, 2014(18): 8-9. |
| [18] |
王世杰, 高云佳, 周书繁, 等. 高效液相色谱法测定淫羊藿药材及饮片中朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的含量[J]. 中国医院用药评价与分析, 2018, 18(2): 156-159. |
| [19] |
牛晓静, 鲁静, 段晓颖, 等. 基于聚类分析的淫羊藿黄酮类成分的质量分析研究[J]. 中华中医药杂志, 2016, 31(6): 2386-2389. |
| [20] |
陈春雪, 马元春, 刘焱文, 等. UPLC法同时测定淫羊藿中5种黄酮类成分的含量[J]. 湖北中医药大学学报, 2017, 19(4): 40-45. DOI:10.3969/j.issn.1008-987x.2017.04.10 |
| [21] |
黄弥娜, 周燕妮, 柳强, 等. HPLC法测定不同产地淫羊藿中7种主要黄酮类成分的含量[J]. 第二军医大学学报, 2015, 36(12): 1352-1355. |
| [22] |
高言明, 陈惠玲, 魏升华, 等. 毛细管区带电泳法测定几个不同种的淫羊藿中绿原酸的含量[J]. 中国药学杂志, 2006, 24(7): 1903-1905. |
| [23] |
秦伟瀚, 刘翔, 张军, 等. 不同产地15个品种淫羊藿的质量评价[J]. 中成药, 2017, 39(9): 1889-1895. DOI:10.3969/j.issn.1001-1528.2017.09.027 |
| [24] |
高敏, 刘京晶, 孙欣光, 等. 中药淫羊藿主要资源种类木兰花碱含量的研究[J]. 中国中药杂志, 2011, 36(1): 16-18. |
| [25] |
张萍, 孔维军, 鄢丹, 等. 基于淫羊藿苷测定及HPLC指纹图谱分析的淫羊藿药材质量差异评价[J]. 中草药, 2010, 41(11): 1901-1904. |
| [26] |
陈翠萍, 沙明, 杨松松, 等. 朝鲜淫羊藿中木兰碱的定量研究[J]. 中国中药杂志, 1996, 21(11): 41-42. |
| [27] |
周涛, 张小波, 郭兰萍, 等. 粗毛淫羊藿不同部位、不同生境中淫羊藿苷、总黄酮含量的变化分析[J]. 中国中药杂志, 2012, 37(13): 1917-1921. |
| [28] |
罗堃, 王元清, 张智敏, 等. 箭叶淫羊藿不同部位中淫羊藿苷及总黄酮含量测定[J]. 亚太传统医药, 2016, 12(8): 24-26. |
| [29] |
金晓勇, 贾晓斌, 孙娥, 等. 炙淫羊藿炮制过程中5种黄酮类成分变化规律研究[J]. 中国中药杂志, 2009, 34(21): 2738-2742. DOI:10.3321/j.issn:1001-5302.2009.21.011 |
| [30] |
陈彦, 贾晓斌, 范晨怡, 等. 不同品种淫羊藿生品与炮制品中5种黄酮类成分的含量比较[J]. 中华中医药杂志, 2009, 24(5): 565-567. |
| [31] |
曾雯雯, 王晶, 贾凌云, 等. 不同干燥和炮制方法对朝鲜淫羊藿中黄酮类化合物的影响[J]. 沈阳药科大学学报, 2011, 28(7): 559-563. |
| [32] |
谢娟平, 向纪明, 王浩东. 不同方法炮制对巫山淫羊藿中主要成分朝藿定C和淫羊藿苷的影响[J]. 药物分析杂志, 2011, 31(4): 674-677. |
| [33] |
Sun X, Qi L, Jie Z, et al. The reason leading to the increase of icariin in Herba Epimedii by heating process[J]. Journal of Pharmaceutical & Biomedical Analysis, 2018, 149: 525-531. |
| [34] |
Zhang HM, Wang H, Wei J, et al. Comparison of the active compositions between raw and processed epimedium from different species[J]. Molecules, 2018, 23: 1656-1662. DOI:10.3390/molecules23071656 |
| [35] |
Wang NN, Huang XW, Wang XP, et al. Pipette tip solid-phase extraction and high-performance liquid chromatogra-phy for the determination of flavonoids from Epimedii herba in rat serum and application of the technique to pharma-cokinetic studies[J]. Journal of Chromatography B, 2015, 990: 64-72. DOI:10.1016/j.jchromb.2015.03.012 |
| [36] |
Sun M, Yin Y, Wei J, et al. Development and validation of a HPLC-MS/MS method for simultaneous determination of twelve bioactive compounds in epimedium:application to a pharmacokinetic study in rats[J]. Molecules, 2018, 23(6): 1322-1325. DOI:10.3390/molecules23061322 |
| [37] |
张锡玮, 陈颖萍, 夏素霞. LC-MS/MS法检测健康人血浆淫羊藿苷及药动学探索研究[J]. 辽宁中医杂志, 2014, 41(1): 133-135. |
| [38] |
刘晓燕, 王本杰, 魏春敏, 等. 淫羊藿苷单体及淫羊藿总黄酮提取物大鼠药动学特征比较[J]. 中国医院药学杂志, 2011, 31(22): 1858-1863. |
| [39] |
Wu CS, Zhang JL, Zhou TH, et al. Simultaneous determina-tion of seven flavonoids in dog plasma by ultra-performance liquid chromatography-tandem mass spectrometry and its application to a bioequivalence study of bioactive compo-nents in Herba Epimedii and Er-Xian Decoction[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 54(1): 186-191. DOI:10.1016/j.jpba.2010.07.010 |
| [40] |
刘聪燕, 高霞, 陈彦, 等. 淫羊藿总黄酮在骨质疏松大鼠体内的药动学行为[J]. 中成药, 2017, 39(8): 1595-1600. DOI:10.3969/j.issn.1001-1528.2017.08.010 |
| [41] |
周一帆, 胡昌江, 张雪洁, 等. 淫羊藿炮制前后在大鼠体内的药代动力学研究[J]. 中成药, 2013, 35(12): 2717-2720. DOI:10.3969/j.issn.1001-1528.2013.12.036 |
| [42] |
钱浅, 孙娥, 樊宏伟, 等. 羊脂油对淫羊藿炮制品提取物中宝藿苷Ⅰ在大鼠体内药动学特征的影响[J]. 中草药, 2012, 43(10): 1981-1985. |
| [43] |
许舜军, 朱雅玲, 余捷婧, 等. 喘可治注射液中朝藿定A, 朝藿定B, 朝藿定C和淫羊藿苷在大鼠体内的药物动力学研究[J]. 中国中药杂志, 2016, 41(1): 129-133. |
| [44] |
张双庆, 孙丽翠, 黄振武. 大鼠体内淫羊藿素葡萄糖醛酸代谢物的定量研究[J]. 卫生研究, 2015, 44(1): 91-94. |
| [45] |
Hsueh TY, Ho JK, Lin LC, et al. Herb-drug interaction of Epimedium extract on the pharmacokineticof dapoxetine in rats[J]. Journal of Chromatography B, 2016, 1014: 64-69. DOI:10.1016/j.jchromb.2016.02.001 |
| [46] |
Hsueh TY, Wu YT, Lin LC, et al. Herb-drug interaction of Epimedium sagittatum (Sieb. et Zucc.) maxim extract on the pharmacokinetics of sildenafil in rats[J]. Molecules, 2013, 18(6): 7323-7335. DOI:10.3390/molecules18067323 |
| [47] |
Li C, Li Q, Mei Q, et al. Pharmacological effects and phar-macokinetic properties of icariin, the major bioactive com-ponent in Herba Epimedii[J]. Life Sciences, 2015, 126: 57-68. DOI:10.1016/j.lfs.2015.01.006 |
| [48] |
胡道德, 顾磊, 姚慧娟, 等. Cocktail探针药物评价淫羊藿提取物对大鼠CYP450酶的影响[J]. 中国新药与临床杂志, 2009, 28(5): 337-341. |
 2019, Vol. 38
2019, Vol. 38