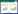文章信息
- 向涛, 张佩兰
- XIANG Tao, ZHANG Peilan
- rt-PA治疗合并重度牙周炎的急性缺血性卒中患者疗效评价
- Efficacy evaluation of rt-PA in the treatment of acute ischemic stroke complicated with severe periodontitis
- 天津中医药大学学报, 2019, 38(3): 255-258
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(3): 255-258
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.03.13
-
文章历史
收稿日期: 2019-03-15
2. 天津市环湖医院, 天津 300350
2. Tianjin Huanhu hospital, Tianjin 300350, China
中国是全球卒中危险因素暴露水平较高的国家之一[1]。缺血性卒中是导致成人残疾的第3大原因[2],存活下来的患者大多留有不同程度的残疾,严重影响日常生活和工作。对于急性缺血性卒中,1985年Justin Allen Zivin医生开创重组组织型纤溶酶原激活剂(rt-PA)治疗卒中的研究,到1995年美国国立神经疾病与卒中研究所随机对照试验(NINDS)证实在急性缺血性卒中发病3 h内静脉应用rt-PA对缺血性卒中的预后有明显的改善[3],随后美国国家食品药品监督管理局(FDA)批准rt-PA作为缺血性卒中的治疗药物。静脉溶栓在降低急性缺血性卒中患者病死率和严重致残率的同时显著改善生存患者的生活质量,但是在临床实践中发现,合并牙周炎的急性缺血性卒中患者接受rt-PA静脉溶栓治疗时易出现牙龈出血,但其是否影响预后及安全性,尚无相关报道。本研究旨在探究合并重度牙周炎的急性缺血性卒中患者接受rt-PA静脉溶栓治疗的安全性及有效性,为临床实践提供一定参考。
1 资料与方法 1.1 一般资料回顾性选取天津市环湖医院神经内科2018年3-7月住院的合并重度牙周炎的急性缺血性卒中患者118例,其中溶栓组患者58例,对照组患者60例,对其进行回顾性研究。溶栓组患者发病4.5 h内给予阿替普酶(商品名为爱立通,规格:20 mg和50 mg)静脉溶栓治疗,剂量为0.9 mg/kg,最大剂量≤90 mg,总药量的10% 1 min静脉推注,剩余90%的rt-PA于250 mL 0.9%生理盐水中稀释,1 h输液泵静脉滴注完毕。溶栓24 h后行影像学检查排除颅内出血,继续进行基础治疗,即:阿司匹林肠溶片(商品名为拜阿司匹林)100 mg 1次/日联合氯吡格雷(商品名为波立维)75 mg 1次/日口服抗血小板聚集治疗,14 d后改为阿司匹林100 mg 1次/日口服抗血小板聚集治疗(对阿司匹林不耐受者,可改为氯吡格雷)。对照组患者入院后常规基础治疗。两组患者在基线资料比较中差异无统计学意义(P>0.05),见表 1。
溶栓组纳入标准:1)急性缺血性卒中患者。2)有静脉溶栓治疗指征[4]。3)年龄≥18岁。4)合并重度牙周炎[5-6]。5)患者或家属签署知情同意书。对照组纳入标准:1)急性缺血性卒中患者,但无静脉溶栓治疗指征或者家属拒绝行溶栓治疗而接受常规基础治疗者。2)合并重度牙周炎[5-6]。3)患者或家属签署知情同意书。
排除标准:口腔牙齿数量少于20颗;全身慢性感染性疾病,如糖尿病、肾脏疾病等;心脏病,如房颤、心瓣膜病等,心脏介入治疗6个月内;牙周基础治疗6个月内,3个月内使用过任何抗生素、免疫抑制剂、非甾体类药物。
1.3 有效性评价早期有效标准:治疗后24 h及7 d NIHSS评分下降>4分或神经功能缺损症状完全消失[7]。患者治疗3个月时改良Rankin评分(mRS)为0~2分定义为预后良好,mRS评分3~6分定义为预后不良。
1.4 安全性评价评估两组患者不良事件发生情况:症状性颅内出血、非症状性颅内出血、牙龈出血、皮下出血、消化系出血、泌尿系出血以及卒中相关死亡,对其安全性进行评价。
1.5 统计学方法本研究采用SPSS 22.0软件进行统计分析,对于符合正态分布的计量资料,应用均数±标准差(x±s)表示,组间比较采用两独立样本t检验;对于不符合正态分布的计量资料,采用M(P25~P75)表示,组间比较采用秩和检验。计数资料以构成比(%)或率(%)表示,组间比较应用卡方检验,P < 0.05为差异有统计学意义。
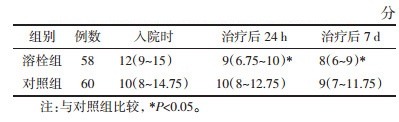
2 结果 2.1 溶栓组与对照组基线资料及预后比较两组患者在基线资料比较中差异无统计学意义(P>0.05,见表 1)。溶栓组与对照组相比较,溶栓组早期神经功能缺损明显改善,治疗24 h及7 d的NIHSS评分水平明显低于对照组,差异存在统计学意义(P<0.05),见表 2。治疗3个月时远期预后良好率溶栓组60.3%(35例)优于对照组43.3%(26例),差异存在统计学意义(P<0.05),见表 3。
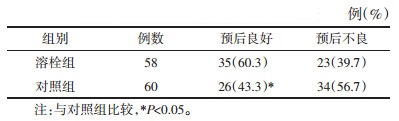
溶栓组病死率为1.7%(1例),而对照组为3.3%(2例),两组之间差异无统计学意义(P>0.05),见表 4。溶栓组与对照组3个月内的不良反应中,发生牙龈出血的比例溶栓组41.4%(24例)比对照组16.7%(10例)明显偏高,差异具有统计学意义(P<0.05),见表 4。两组非症状性颅内出血、皮下出血、消化系出血之间的差异无统计学意义(P>0.05),见表 4。两组均未出现症状性颅内出血及泌尿系出血。
研究发现牙周炎与全身疾病如心脑血管疾病、糖尿病、动脉硬化、肺部疾病等密切相关。在一般人群中,牙周炎的估计患病率为20%~50%[8]。Grau等[9]研究发现,缺血性卒中与牙周炎等慢性炎症反应相关,牙周炎导致血管内皮细胞损伤,引起局部脑血管炎症,导致脑血管堵塞,脑组织供血不足。Leira等[10]对牙周炎与缺血性卒中之间关系进行荟萃分析发现,这两种疾病之间的关系有其生物合理性,牙周炎可能是缺血性卒中的中度至强度危险因素,预防牙周炎在卒中预防中起重要作用。Pillai等[11]研究发现牙周炎和牙齿脱落与中风独立相关,并且预防和干预牙周炎能够降低中风风险。Slowik等[12]通过统计分析发现,患有重度牙周炎的急性缺血性卒中患者入院时神经功能缺损更严重,出院时mRS评分更高。Abolfazli等[13]研究发现牙周炎是脑缺血的独立危险因素,尤其在男性中。吕宗凯等[14]对牙周炎与缺血性卒中相关性进行分析,他们发现缺血性卒中与牙周炎存在显著相关性,牙周炎是缺血性卒中的重要危险因素之一。
牙周炎与缺血性卒中相关性的可能机制:1)牙周致病菌侵入血液循环系统导致短暂菌血症[15-16]。牙周结缔组织经常发生这种短暂菌血症,使大量循环炎症介质,例如白细胞介素(IL)-1β、IL-6和肿瘤坏死因子-α(TNF-α)从结合上皮细胞、结缔组织成纤维细胞和巨噬细胞中释放,而这些炎症因子会导致动脉硬化,增加脑卒中风险[17-19]。
另外,这些炎症介质可以使血小板激活、数量增加,促进血小板凝聚,使机体更容易发生凝血,导致缺血性卒中事件的发生。牙龈卟啉单胞菌不仅间接诱导血小板凝聚,还能黏附和侵入血管内皮细胞,导致脑血管内皮功能障碍[20]。2)诱导全身免疫反应及炎症反应:进一步加剧动脉硬化,增加卒中机率[22]。
目前,rt-PA针对急性缺血性卒中静脉溶栓治疗是唯一通过美国FDA批准的治疗方法[23],也是中国指南推荐使用的静脉溶栓药物。研究发现,牙周炎是脑卒中相关危险因素,同时,笔者在临床实践过程中也发现牙周炎患者接受静脉溶栓治疗时牙龈出血发生率显著高于非溶栓患者(41.4% vs 16.7%),且差异具有统计学意义。由于牙周组织长期处于慢性炎症状态,组织中毛细血管扩张和充血,动脉血管内皮细胞损伤,血管通透性增加,加之rt-PA本身具有导致纤溶亢进易出血的特点,从而导致溶栓时牙龈更易出血。那么卒中合并重度牙周炎的患者接受静脉溶栓治疗是否安全,其严重并发症如症状性颅内出血发生率是否增加,截至目前鲜有报道。本研究旨在探究卒中合并重度牙周炎患者静脉溶栓的安全性及有效性,以期科学评价静脉溶栓出血风险,进一步指导临床实践。
| [1] |
王陇德, 王金环, 彭斌, 等. 《中国脑卒中防治报告2016》概要[J]. 中国脑血管病杂志, 2017, 14(4): 217-224. DOI:10.3969/j.issn.1672-5921.2017.04.010 |
| [2] |
López-Espuela F, Pedrera-Zamorano JD, Jiménez-Caballero PE, et al. Functional Status and Disability in Patients After Acute Stroke:A Longitudinal Study[J]. Am J Crit Care, 2016, 25: 144-151. DOI:10.4037/ajcc2016215 |
| [3] |
Group NIoNDaSrSS. Tissue plasminogen activator for acute ischemic stroke[J]. N Engl J Med, 1995, 333(24): 1581-1587. DOI:10.1056/NEJM199512143332401 |
| [4] |
中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48(4): 246-257. DOI:10.3760/cma.j.issn.1006-7876.2015.04.002 |
| [5] |
中华口腔医学会牙周病学专业委员会. 重度牙周炎诊断标准及特殊人群牙周病治疗原则的中国专家共识[J]. 中华口腔医学杂志, 2017, 64(1): 67-71. |
| [6] |
孟焕新. 牙周病学[M]. 第3版. 北京: 人民卫生出版社, 2008: 155-156.
|
| [7] |
Lyden P, Brott T, Tilley B, et al. Improved reliability of the NIH Stroke Scale using video training. NINDS TPA Stroke Study Group[J]. Stroke, 1994, 25: 2220. DOI:10.1161/01.STR.25.11.2220 |
| [8] |
Albandar JM, Rams TE. Global epidemiology of periodontal diseases:an overview[J]. Periodontol, 2002, 29: 7-10. DOI:10.1034/j.1600-0757.2002.290101.x |
| [9] |
Grau AJ, Urbanek C, Palm F. Common infections and the risk of stroke[J]. Nat Rev Neurol, 2010, 6: 681-694. |
| [10] |
Leira Y, Seoane J, Blanco M, et al. Association between periodontitis and ischemic stroke:a systematic review and meta-analysis[J]. Eur J Epidemiol, 2016, 32: 1-11. |
| [11] |
Pillai RS, Iyer K, Spin-Neto R, et al. Oral health and brain injury:causal or casual relation[J]. Cerebrovasc Dis Extra, 2018, 8: 1-15. DOI:10.1159/000484989 |
| [12] |
Slowik J, Wnuk MA, Grzech K, et al. Periodontitis affects neurological deficit in acute stroke[J]. J Neurol Sci, 2010, 297: 82-84. DOI:10.1016/j.jns.2010.07.012 |
| [13] |
Abolfazli NGA, Ayramlu H, et al. Periodontal disease and risk of cerebral ischemic stroke[J]. Journal of Neurological Sciences, 2011, 28(3): 307-316. |
| [14] |
吕宗凯, 郑杨灿, 杨映阳, 等. 牙周炎与缺血性脑卒中相关性研究的Meta分析[J]. 口腔医学, 2018, 38(2): 263-267. |
| [15] |
Forner L, Larsen T, Kilian M, et al. Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation[J]. J Clin Periodontol, 2006, 33(6): 401-407. DOI:10.1111/cpe.2006.33.issue-6 |
| [16] |
Papapanagiotou D, Nicu EA, Bizzarro S, et al. Periodontitis is associated with platelet activation[J]. Atherosclerosis, 2009, 202(2): 605-611. DOI:10.1016/j.atherosclerosis.2008.05.035 |
| [17] |
Ramseier CA, Kinney JS, Herr AE, et al. Identification of pathogen and host-response markers correlated with periodontal disease[J]. J Periodontol, 2009, 80: 436-446. DOI:10.1902/jop.2009.080480 |
| [18] |
Humphrey LL, Fu R, Buckley DI, et al. Periodontal disease and coronary heart disease incidence:a systematic review and meta-analysis[J]. J Gen Intern Med, 2008, 23: 2079. DOI:10.1007/s11606-008-0787-6 |
| [19] |
Pussinen PJ, Alfthan G, Jousilahti P, et al. Systemic expo-sure to porphyromonas gingivalis predicts incident stroke[J]. Atherosclerosis, 2007, 193: 222-228. DOI:10.1016/j.atherosclerosis.2006.06.027 |
| [20] |
Koizumi K, Wang G, Park L. Endothelial dysfunction and amyloid-β-Induced neurovascular alterations[J]. Cellular & Molecular Neurobiology, 2016, 36(2): 155-165. |
| [21] |
Nguyen CM, Kim JW, Quan VH, et al. Periodontal associations in cardiovascular diseases:The latest evidence and understanding[J]. Journal of Oral Biology & Craniofacial Research, 2015. |
| [22] |
Slade GD, Offenbacher S, Beck JD, et al. Acute-phase inflammatory response to periodontal disease in the US population[J]. J Dent Res, 2000, 79(1): 49. DOI:10.1177/00220345000790010701 |
| [23] |
Donnan GA, Fisher M, Macleod M, et al. Stroke[J]. Lancet, 2008, 371: 1612-1623. DOI:10.1016/S0140-6736(08)60694-7 |
 2019, Vol. 38
2019, Vol. 38