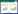文章信息
- 胡维, 熊丹, 黄娟
- HU Wei, XIONG Dan, HUANG Juan
- 补肾活血汤抑制糖尿病肾病引起的足细胞损伤及EMT发生机制研究
- Mechanism of Bushen Huoxue decoction in inhibiting podocyte injury and EMT induced by diabetic nephropathy
- 天津中医药大学学报, 2019, 38(3): 262-266
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(3): 262-266
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.03.15
-
文章历史
收稿日期: 2019-01-30
糖尿病肾病(DN)是糖尿病患者全身性微血管病变表现之一,也是糖尿病引发危害最大的一种慢性并发症,亦是糖尿病患者死亡的主要原因之一[1]。糖尿病患者早期主要的临床表现是尿蛋白,而蛋白尿是由足细胞损伤引起的[2]。有研究显示,足细胞损伤的早期主要表现是足细胞通过上皮间充质转化(EMT)的发生引起足细胞结构和功能的破坏,最终引起蛋白尿[3]。Rac1在机体生理病理过程中发挥重要作用,如细胞增殖、黏附及细胞骨架调节等过程[4-5]。在糖尿病肾病发生和发展的过程中炎症反应及氧化应激与Rac1的激活异常密切相关[6]。Rac1是PAK1、p38MAPK等多条信号通路中发挥中枢纽带作用。高糖诱导肾小管上皮细胞可通过激活p38MAPK信号通路诱发EMT[7]。补肾活血汤具有活血止痛、补肾壮筋的功效,在临床上常用于治疗糖尿病肾病。已有研究证实,补肾活血汤在糖尿病肾病中具有很多功能,如其可改善糖脂代谢,降低血脂水平等[8],但其作用机制目前还缺乏深入研究。补肾活血汤在多种肿瘤中具有抑制EMT过程[9],而其在糖尿病肾病中是否具有类似作用尚不明确,因此,本课题探究补肾活血汤在糖尿病肾病中改善足细胞损伤和减少EMT过程中发挥的作用并对其是否通过调控Rac1信号通路的分子机制进行研究。旨在深入研究补肾活血汤在糖尿病肾病中的作用机制,为临床应用补肾活血汤进行糖尿病治疗,解决目前糖尿病肾病缺乏特效治疗手段等提供科学依据和转化指导。
1 材料与方法 1.1 材料细胞:永生化的小鼠足细胞系MPC5购于上海弘顺生物科技有限公司。主要试剂:胎牛血清、RPMI 1640培养基购于美国Hyclone公司;噻唑蓝(MTT)购于美国Sigma公司;Transwell小室购于美国Corning公司;Annexin V-FITC/PI凋亡检测试剂盒购于碧云天生物技术有限公司;二喹啉甲酸(BCA)蛋白浓度检测试剂盒购于北京索莱宝科技有限公司;底物电化学发光(ECL)试剂盒购于北京艾德莱生物科技有限公司;聚偏二氟乙烯(PVDF)膜购于上海化科实验器材有限公司;GTP-Rac1抗体、p-PAK1抗体、p-p38抗体、p-β-catenin抗体、p65抗体及二抗均购于美国Abcam公司。
1.2 细胞培养和分组处理体外培养永生化小鼠足细胞系MPC5,在Ⅰ型胶原包被的培养瓶中,用RPMI 1640(含10%FBS)+10 U/mL重组小鼠γ-干扰素,于33 ℃条件下培养足细胞,当融合度达到80%左右进行换液操作。用不含γ-干扰素培养基在37 ℃条件下,于含5% CO2培养箱中培养,2~3 d换液1次,约14 d左右可见足细胞胞核胞体均显著增大,胞浆有分枝状不规则突起,此时为足细胞分化成熟。成熟的足细胞分为以下几组进行处理:对照组,使用含有5.6 mmol/L葡萄糖的RPMI-1640完全培养基培养48 h;高糖组(糖尿病肾病足细胞损伤模型组),在含有30 mmol/L葡萄糖的培养基中刺激48 h;补肾活血汤组,在含有30 mmol/L葡萄糖、0.1 mmol/L补肾活血汤的培养基中刺激48 h;NSC23766+高糖组,在含有30 mmol/L葡萄糖、10 μmol/L Rac1抑制剂NSC23766的培养基中刺激48 h;NSC23766+补肾活血汤组,在含有30 mmol/L葡萄糖、0.1 mmol/L补肾活血汤、10 μmol/L抑制剂NSC23766的培养基中刺激48 h;PMA+高糖组,在含有30 mmol/L葡萄糖、50 nmol/L激活剂PMA的培养基中刺激48 h;PMA+补肾活血汤组在含有30 mmol/L葡萄糖、0.1 mmol/L补肾活血汤、50 nmol/L激活剂PMA的培养基中刺激48 h。
1.3 MTT法检测各组足细胞增殖情况对照组、高糖组、补肾活血汤组细胞按上所述处理48 h后,采用MTT法测定各组足细胞增殖情况。每孔中加入10 μL(浓度为10 mg/mL的MTT溶液,轻轻混匀后置于37 ℃培养箱中培养4 h,取出细胞培养板,除去培养液,分别在每孔中加入150 μL二甲基亚砜溶液,混匀后置于震荡仪上,低速震荡反应10 min,于酶标仪490 nm处测定吸光度值(A值)。
1.4 流式细胞术检测各组大肠癌细胞凋亡情况将对照组、高糖组、补肾活血汤组细胞以前述条件下处理48 h后,用磷酸缓冲盐溶液(PBS)润洗1次,加入无乙二胺四乙酸(EDTA)的胰蛋白酶消化1~2 min,加入完全培养基终止消化,以500 g离心5 min,以无菌预冷的PBS轻轻吹洗2次,并重悬制成密度为1×106/mL的单细胞悬液。将每组细胞悬液分别转移至Falcon管,加入5 μL Annexin V-FITC及PI染料,置于避光处轻轻混合均匀,孵育15 min;各组Falcon管中分别加入400 μL binding buffer,1 h内上机检测,Annexin V-FITC阳性且PI阴性细胞为凋亡细胞,并统计各组足细胞的凋亡率。
1.5 Transwell实验和划痕实验检测各组足细胞迁移能力Transwell实验:在Transwell小室的上室加入200 μL无血清培养基,下室加入600 μL无血清培养基,置培养箱中孵育2 h,将待检测的对照组、高糖组、补肾活血汤组足细胞用0.25%的胰蛋白酶消化收集,用无血清培养基制备单细胞悬液。除去平衡后的Transwell小室无血清培养基,在Transwell下室加入含FBS的培养基500 μL,上室加入200 μL细胞悬液,在培养箱中培养48 h后取出Transwell小室,用棉签拭去上室细胞及细胞碎片,用2 mL多聚甲醛固定10 min后加入500 μL结晶紫溶液进行染色,PBS清洗后,在倒置显微镜下观察、拍照、计数穿膜细胞个数,以对照组为参照,计算相对迁移指数表示细胞迁移能力。
划痕实验:用记号笔在6孔板背后均匀划横线,大约每隔0.5~1 cm一道,横穿过孔,每孔至少穿过5条线。加入5×105/孔待测各组足细胞于6孔板中,以过夜能铺满孔板为宜,第2天用200 μL枪头尽量垂直于6孔板背后横线划痕,枪头要垂直,不能倾斜,用PBS洗涤细胞3次,去除划下的细胞,加入无血清培养基。置于37 ℃含体积分数为5%CO2的培养箱中进行培养。24 h取样拍照,测量各组细胞转移的距离,以对照组为参照,计算相对迁移指数表示细胞迁移能力。
1.6 RT-PCR检测各组细胞采用Trizol法提取总核糖核酸(RNA),用M-MLV反转录酶试剂盒将RNA反转录合成cDNA,用SYBR Green PCR Master Mix进行荧光定量PCR,反应体系为20 μL,反应条件为:95 ℃,10 min预变性;95 ℃,30 s,65 ℃,1 min,共40个循环。每个样品设置3个复管,以β-actin为内参,用相对定量2-ΔΔCT进行分析。
1.7 Western blot检测各组细胞处理后培养48 h,收集各组细胞提取总蛋白,以BCA蛋白浓度检测试剂盒测量提取蛋白浓度,将蛋白样品与加样缓冲液按体积比4:1混合后,95 ℃变性10 min,加入40 μg变性蛋白至聚丙烯酰胺凝胶电泳每个泳道孔中,在浓缩胶中采用80 V电压,待溴酚蓝进入到分离胶和浓缩胶边缘时,调整电压为130 V,电泳结束后将凝胶上的蛋白转移至PVDF聚偏二氟乙烯膜上,转膜结束后用TBS缓冲液漂洗,将膜置于含5%的脱脂奶粉封闭液中封闭2 h。除去封闭液,分别加入含相应一抗进行杂交,4 ℃条件下过夜孵育,再用二抗进行杂交,室温孵育2 h。转移至暗室,以ECL化学发光试剂盒进行发光,以成像仪曝光后采用Image J图像分析系统分析各条带灰度值,以β-actin为内参,分析各组足细胞中待测蛋白的表达量。
1.8 统计学分析所得实验数据均采用软件SPSS 21.0进行统计分析,数据以均数±标准差(x±s)表示,多组间差异比较采用单因素方差分析,组间多重比较采用SNK-q检验,P < 0.05表示差异具有统计学意义。
2 结果 2.1 补肾活血汤改善高糖诱导的足细胞增殖抑制及凋亡处理后48 h分别以MTT法和流式细胞术检测各组足细胞增殖和凋亡情况,结果如表 1所示,与对照组相比,高糖组细胞吸光度(A值)降低,凋亡率增加,差异具有统计学意义(P < 0.05);与高糖组相比,补肾活血汤+高糖组A值升高,凋亡率降低,差异具有统计学意义(P < 0.05)。提示高糖处理可抑制足细胞增殖,诱导细胞凋亡;补肾活血汤可改善高糖诱导的足细胞增殖抑制作用,减少高糖诱导的足细胞凋亡。说明补肾活血汤对高糖诱导的足细胞具有一定的保护作用。
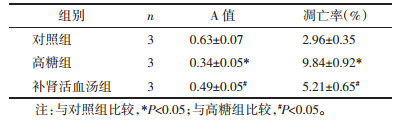
各组足细胞处理48 h后以Transwell和划痕实验检测各组足细胞体外迁移能力,结果如表 2所示,与对照组相比,高糖组细胞迁移指数升高,差异具有统计学意义(P < 0.05);与高糖组相比,补肾活血汤组迁移指数降低,差异具有统计学意义(P < 0.05)。提示高糖处理可促进足细胞迁移能力,补肾活血汤可减弱高糖诱导的足细胞的迁移能力。
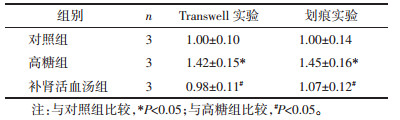
各组足细胞处理48 h后以RT-PCR检测各组足细胞及EMT发生过程标志指标的表达水平,结果如表 3所示,与对照组相比,高糖组足细胞特异性指标P-cadherin、ZO-1 mRNA的表达水平均明显降低,EMT发生过程标志desmin、FSP-1 mRNA的表达水平显著升高,差异具有统计学意义(P < 0.05);与高糖组相比,补肾活血汤组足细胞P-cadherin、ZO-1 mRNA的表达水平明显升高,desmin、FSP-1 mRNA和蛋白的表达量显著降低,差异具有统计学意义(P < 0.05)。足细胞特异性指标P-cadherin、ZO-1的表达减少提示高糖可诱导足细胞损伤,而补肾活血汤可减少高糖诱导的足细胞损伤;高糖组足细胞间充质标志蛋白的高表达说明高糖诱导足细胞发生了EMT,而补肾活血汤可逆转足细胞EMT的发生。
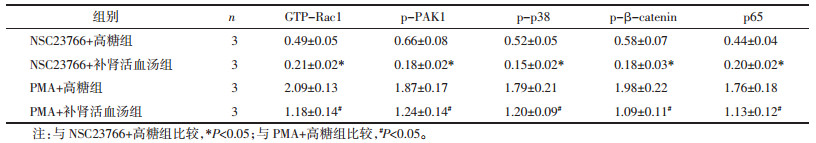
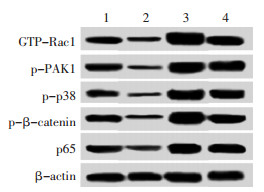
各组足细胞处理48 h后,以Western blot检测各组足细胞中GTP-Rac1、p-PAK1、p-p38、p-β-catenin、p65蛋白表达水平,结果如表 4和图 1所示,与NSC23766+高糖组相比,NSC23766+补肾活血汤组足细胞中GTP-GTP-Rac1、p-PAK1、p-p38、p-β-catenin、p65蛋白的表达水平均显著降低,差异具有统计学意义(P < 0.05);与PMA+高糖组相比,PMA+补肾活血汤组足细胞中GTP-GTP-Rac1、p-PAK1、p-p38、p-β-catenin、p65蛋白的表达水平均显著降低,差异具有统计学意义(P < 0.05)。说明补肾活血汤可抑制Rac1及下游信号通路的激活。
|
| 1:NSC23766+高糖组;2:NSC23766+补肾活血汤组;3:PMA+高糖组;4:PMA+补肾活血汤组 图 1 Western blot检测各组足细胞中GTP-Rac1、p-PAK1、p-p38、p-β-catenin、p65蛋白的表达水平 |
糖尿病肾病的发病机制和病因目前还不十分明确,但根据糖尿病肾病的病程和病理生理过程可发现,蛋白尿与糖尿病肾病进展关系密切[10]。研究表明,糖尿病肾病中足细胞的损伤是导致尿蛋白的主要原因之一[11]。高糖诱导足细胞中核内活化T细胞核因子蛋白介导的过氧化物酶体增殖物激活受体γ共激活因子1α的表达下调引起足细胞凋亡[12]。本研究结果显示,高糖诱导下抑制足细胞增殖,诱导足细胞凋亡,足细胞上皮标志P-cadherin、ZO-1表达量减少,间充质标志desmin、FSP-1的表达显著升高,提示引发足细胞发生EMT,且足细胞迁移能力增加。
补肾活血汤是治疗糖尿病肾病常用的中药药剂,在糖尿病肾病治疗中具有良好的治疗效果,可明显改善肾功能及血糖水平。近期研究显示,糖尿病肾病患者以补肾活血汤治疗后,患者病情发展得到有效控制,且尿蛋白排出量减少[13]。补肾活血汤对自发性高血压所致大鼠心肌细胞损伤通过抑制心肌细胞凋亡,对心肌细胞具有一定的保护作用[14]。体外培养人乳腺癌MDA-MB-231细胞,在培养基中添加不同浓度的补肾活血汤,结果显示补肾活血汤可抑制乳腺癌细胞生长和迁移,其作用机制是补肾活血汤与调控SDF-1/CXCR4信号通路活性有关[15]。本实验结果显示,补肾活血汤可缓解高糖诱导的细胞凋亡,提高足细胞增殖活性,减少高糖诱导的足细胞迁移,逆转足细胞EMT的发生。
Rac1表达可通过与p21激活的激酶1(PAK1)和p38丝裂原活化蛋白激酶(p38MAPK)信号传导途径相互作用改变细胞EMT[16]。PAK1、p38MAPK、β-catenin、p65作为Rac1下游重要的效应激酶和基因,这些激酶和基因的激活反应相应信号通路的激活。本实验在高糖诱导的足细胞中加入Rac1抑制剂或激活剂后,GTP-Rac1、p-PAK1、p-p38、p-β-catenin、p65的表达水平均有不同程度的下调或上调,补肾活血汤处理后逆转了这些蛋白的表达水平,说明补肾活血汤可调控Rac1及下游信号通路的活性。
综上所述,足细胞在高糖诱导下发生凋亡、损伤及EMT,补肾活血汤可缓解高糖诱导的足细胞损伤,逆转足细胞EMT的发生,其作用机制与补肾活血汤调控Rac1及下游信号通路的活性有关。为解决临床应用活血补肾汤改善糖尿病患者肾损害提供实验依据和理论基础。
| [1] |
Löffler I, Wolf G. Pathophysiology of diabetic nephropathy[J]. Nephrology Nursing Journal Journal of the American Nephrology Nurses Association, 2017, 12(6): 391-399. |
| [2] |
Ferrandi M, Molinari I, Rastaldi MP, et al. Rostafuroxin pro-tects from podocyte injury and proteinuria induced by ad-ducin genetic variants and ouabain[J]. Journal of Pharma-cology & Experimental Therapeutics, 2014, 351(2): 278. |
| [3] |
Tang R, Yang C, Tao JL, et al. Epithelial-mesenchymal transdifferentiation of renal tubular epithelial cells induced by urinary proteins requires the activation of PKC-α and βI isozymes[J]. Cell Biology International, 2011, 35(9): 953. DOI:10.1042/CBI20100668 |
| [4] |
Myant KB, Cammareri P, McGhee EJ, et al. ROS production and NF-κB activation triggered by RAC1 facilitate WNTDriven intestinal stem cell proliferation and colorectal cancer initiation[J]. Cell Stem Cell, 2013, 12(6): 761-773. DOI:10.1016/j.stem.2013.04.006 |
| [5] |
张英, 周莉, 姜春玲, 等. Nogo-B通过Rac1 GTPase激活途径调控巨噬细胞的胞葬功能[J]. 中国实验诊断学, 2018, 22(1): 104-107. DOI:10.3969/j.issn.1007-4287.2018.01.037 |
| [6] |
Lv Z, Hu M, Fan M, et al. Podocyte-specific Rac1 deficien-cy ameliorates podocyte damage and proteinuria in STZ-in-duced diabetic nephropathy in mice[J]. Cell Death & Dis-ease, 2018, 9(3): 342-353. |
| [7] |
Zhang X, Liang D, Chi Z H, et al. Effect of zinc on high glu-cose-induced epithelial-to-mesenchymal transition in renal tubular epithelial cells[J]. International Journal of Molecu-lar Medicine, 2015, 35(6): 1747-1754. DOI:10.3892/ijmm.2015.2170 |
| [8] |
梁洪. 用补肾活血汤治疗糖尿病肾病的效果观察[J]. 当代医药论丛, 2015, 13(22): 17-18. |
| [9] |
黄敏敏, 陈迎秀. 补肾活血汤对妇科肿瘤放化疗后卵巢功能的影响[J]. 中医学报, 2016, 31(6): 774-776. |
| [10] |
Tagawa A, Yasuda M, Kume S, et al. Impaired podocyte au-tophagy exacerbates proteinuria in diabetic nephropathy[J]. Diabetes, 2016, 65(3): 755-767. |
| [11] |
Teng B, Duong M, Tossidou I, et al. Role of Protein Kinase C in Podocytes and Development of Glomerular Damage in Diabetic Nephropathy[J]. Frontiers in Endocrinology, 2014, 25(5): 179. |
| [12] |
陈恩平, 杜丽根, 邬银伟, 等. 高糖通过下调PGC-1α激活NFAT并促进足细胞凋亡[J]. 中国病理生理杂志, 2017, 33(4): 620-626. DOI:10.3969/j.issn.1000-4718.2017.04.008 |
| [13] |
钟一禾. 补肾活血汤治疗糖尿病肾病对尿蛋白的影响[J]. 中外医学研究, 2018, 16(4): 123-124. |
| [14] |
李雨真.补肾活血汤对慢性心衰大鼠血清sFas、MMP-2水平的影响[D].济南: 山东中医药大学, 2012.
|
| [15] |
杨争, 胡金辉, 王希, 等. 补肾活血汤对SDF-1α诱导的人乳腺癌MDA-MB-231细胞增殖及迁移的影响[J]. 时珍国医国药, 2016(8): 1868-1870. |
| [16] |
Leng R, Liao G, Wang H, et al. Rac1 expression in epithe-lial ovarian cancer:effect on cell EMT and clinical outcome[J]. Medical Oncology, 2015, 32(2): 329-5. |
 2019, Vol. 38
2019, Vol. 38