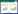文章信息
- 薛志峰, 张兵, 陈静, 吴玉梅, 卢鹏, 张永苗, 祁东利, 刘志东
- XUE Zhifeng, ZHANG bing, CHEN Jing, WU Yumei, LU Peng, ZHANG Yongmiao, QI Dongli, LIU Zhidong
- 松果菊苷固体脂质纳米粒的表征及体外细胞摄取评价
- Characterization and in-vitro cellular uptake evaluation of solid lipid nanoparticles loaded with echinacoside
- 天津中医药大学学报, 2019, 38(3): 290-295
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(3): 290-295
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.03.20
-
文章历史
收稿日期: 2019-12-20
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 301617
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin 301617, China
白内障是一种由于晶状体损伤和蛋白质变性引起的晶状体退化从而影响患者视力的疾病,并已成为全球失明的主要原因[1-2]。然而,除手术干预外,目前没有有效的白内障治疗方法[3]。紫外线B的照射、年龄的增加、肥胖、糖尿病、吸烟和高血压等都是白内障的发病因素[4-5]。研究表明,紫外线B照射是白内障的重要诱发因素[6],紫外线B进入眼睛后,通过光化学反应产生活性氧(ROS),然后对细胞产生氧化应激作用[7-9]。随着一些抗氧化剂(还原酶,抗坏血酸和还原型谷胱甘肽)的减少,细胞膜和其他生理结构(一些晶状体间隙连接蛋白:Cx43,Cx46和Cx50)被氧化和破坏[8-9]。此外,紫外线B照射会诱导促凋亡的Bax基因,并在转录和蛋白水平上抑制抗凋亡的Bcl-2基因。紫外线B照射在人晶状体上皮细胞(HLEC)中的同时,观察到线粒体功能障碍的快速丧失,然后促进HLEC的凋亡,最终导致白内障的形成。因此局部给予抗氧化剂可以避免氧化应激反应并治疗白内障。已有研究表明熊去氧胆酸和咖啡因这样具有抗氧化作用的药物可以用于治疗氧化性白内障[10]。
松果菊苷(Echinacoside)是一种从肉苁蓉(Cistanche deserticola Y.C.Ma)或管花肉苁蓉Cistanche tubulosa(Schenk)Wight的干茎中分离出的一种苯乙醇苷(见图 1),其具有很强的抗氧化活性,可以显著降低氧化应激作用。研究表明,松果菊苷可以提高超氧化物歧化酶的活性,降低活性氧从而缓解被紫外线B照射引起的皮肤损伤,还可以起到改善血管性痴呆型大鼠学习记忆功能和对急性肝损伤大鼠的保护作用[11-13]。因此,松果菊苷理论上可用于治疗氧化性白内障疾病。
|
| 图 1 松果菊苷化学结构式 |
目前,液体滴眼剂和软膏是最主要的眼科制剂形式,然而其较低的生物利用度限制了它们的应用[14-16]。固体脂质纳米粒(SLN)在纳米药物载体中起重要作用,可用于治疗眼部疾病。它可以将药物吸附或包裹于类脂核中制成的粒径为10~1 000 nm的纳米给药系统,具有可控制药物释放、避免药物泄漏或降解以及良好的靶向性等优点[17-19]。本研究根据本实验室前期优化的处方制备了ECH-SLN[20],运用DSC和XRD表征ECH-SLN的物理性质,并利用人角膜上皮HCEpiC细胞和人晶状体上皮SRA01/04细胞对SLN的体外细胞摄取情况进行评价。为证明SLN能够有效地将松果菊苷递送到眼细胞中,进而为发挥抗氧化活性来治疗白内障的可行性。
1 材料 1.1 仪器CoMetro高效液相色谱系统(CoMetro,美国),Milli-Q超纯水系统(Millipore,美国),AX205电子天平(Mettler toledo,瑞士),JD-16A精密恒温水浴槽(上海锴凯科技贸易有限公司),FDU-2100冷冻干燥机(日本东京理化有限公司),Nano-ZS激光粒径测定仪(英国马尔文公司),差示扫描量热仪(Jade DSC,美国),X射线衍射仪(Rigaku D/max 2500 v/pc,日本),RW200S25电动搅拌(IKA德国),超声波细胞破碎仪(宁波新芝生物科技有限公司),CO2恒温培养箱(Thermo Fisher,美国),BDS200倒置显微镜(奥特光学,中国),高速冷冻离心机(Thermo,美国),多功能酶标仪(Perkin Elmer,美国),Ti-U倒置荧光显微镜(Nikon,日本),Operetta高内涵筛选系统(Perkin Elmer仪器有限公司)。
1.2 药品及试剂松果菊苷对照品(天津中新药业,批号82854-37-3,含量>98%),卵磷脂(Lipoid,美国),Myrj52(辽阳奥克纳米材料有限公司),超滤离心管(10 kDa,美国Millipore公司),DMEM/F12、MEM培养基(Hyclone,美国),胎牛血清(PAA),双抗(Invitrogen),0.25%胰蛋白酶(Gibco,美国),CCK-8试剂盒(日本同仁化学研究所),罗丹明123(90%,Solarbio,北京索莱宝科技有限公司),多聚甲醛(PFA)(天津光复科技发展有限公司),其他试剂均为分析纯。
2 方法与结果 2.1 ECH-SLN的制备精密称取处方量Myrj52加入超纯水8 mL,75 ℃水浴中磁力搅拌溶解,作为水相。精密称定处方量松果菊苷、卵磷脂于适量无水乙醇,再称取70 mg单硬脂酸甘油酯加热溶解构成有机相。75 ℃水浴中,将有机相缓慢注入搅拌的水相中,继续搅拌有机相挥发至原体积的1/4时,将剩余药液经微孔滤膜过滤,4 ℃固化2 h,即得ECH-SLN混悬液[26]。
2.2 ECH-SLN的粒径和Zeta电位测定取“2.1”项下制备得到的ECH-SLN适量,用去离子水稀释至适当浓度,室温下用激光粒径测定仪分别测定ECH-SLN的粒径及Zeta电位。结果显示,其粒径为(79.15±0.76)nm,多分散指数(PDI)为(0.25±0.01);Zeta电位为(-20.27±2.39)mV。
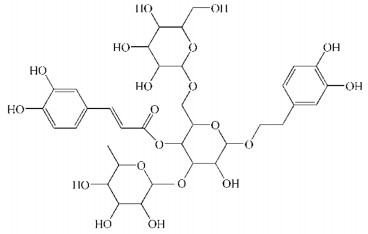
2.3 差示扫描量热(DSC)研究精密称取松果菊苷对照品、空白SLN冻干粉、ECH-SLN冻干粉、物理混合物(空白SLN:松果菊苷=5:1)样品各7 mg,利用DSC进行分析,以空铝钳锅为参比,另一铝钳锅分别放入以上4种样品,升温速率为10 ℃/min,扫描范围为30~270 ℃,氮气流速为50 mL/min,DSC曲线图,见图 2。
|
| 注:松果菊苷(A),空白SLN(B),ECH-SLN(C)和物理混合物(D,空白SLN:松果菊苷=5:1) 图 2 DSC图谱 |
结果显示,松果菊苷和物理混合物在150 ℃下显示出松果菊苷的熔化吸热特征峰,而该峰在空白SLN和ECH-SLN中消失。空白SLN,ECH-SLN和物理混合物在110 ℃和230 ℃下显示出两个熔化的吸热峰,而该峰在松果菊苷中并未出现。表明松果菊苷是以分子分散形式被包裹在SLN中。
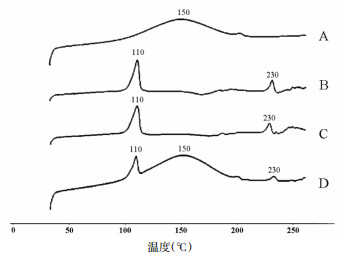
2.4 X射线衍射(XRD)研究精密称取松果菊苷对照品、空白SLN冻干粉、ECH-SLN冻干粉、物理混合物(空白SLN:松果菊苷=5:1)样品约5 mg,分别用XRD测定,条件及参数如下:使用Ni-滤波器,Cu-Ka射线,波长为1.540 56 Å,40 kV电压和200 mA电流。在5~90°的2θ范围,以2 °/min的速率进行扫描,结果见图 3。
|
| 注:松果菊苷(A), 空白SLN(B), ECH-SLN(C)和物理混合物(D, 空白SLN:松果菊苷=5:1) 图 3 样品XRD图谱 |
XRD结果显示,松果菊苷和物理混合物在20°时表现出明显的松果菊苷峰值,而在空白SLN和ECH-SLN中该峰值降低。空白SLN,ECH-SLN和物理混合物在20°~25°范围内显示SLN范围特征峰,而该峰在松果菊苷中并未出现。结果表明松果菊苷存在于SLN是以分子分散形式而不是游离形式,与DSC的结论一致。
2.5 体外细胞摄取研究 2.5.1 细胞的培养将人角膜上皮HCEpiC细胞悬液置于离心管中,加入DMEM/F12完全培养基(胎牛血清终浓度为10%,双抗终浓度为1%),1 000 r/min离心3 min,弃去上清液,再次加入完全培养基,轻轻吹匀细胞,以1×104个/mL密度接种至培养瓶,置入5% CO2、37℃细胞培养箱培养。2 d后更换培养液,每4 d传代1次。SRA 01/04加入MEM/EBSS完全培养基(胎牛血清终浓度为10%,双抗和Hepes终浓度均为1%)重复上述操作,进行传代、培养。
2.5.2 细胞毒性研究将Rh 123作为荧光探针,并按照ECH-SLN的制备方法制备Rh 123-SLN。采用细胞增殖-毒性检测试剂盒(CCK-8)评价不同浓度的游离Rh 123和Rh 123-SLN对HCEpiC细胞和SRA01/04细胞的细胞毒性。取正常生长的消化、混悬后的HCEpiC细胞和SRA01/04细胞消化、混悬,分别以1×104个/mL的密度接种至96孔板,在37 ℃、5%CO2下培养24 h至细胞贴壁80%融合,弃掉DMEM/F12完全培养基及MEM/EBSS完全培养基,PBS液漂洗两次,HCEpiC细胞和SRA01/04细胞再分别加入DMEM/F12、MEM/EBSS同步化24 h。之后将100 μL空白培养基及不同浓度样品(Rh 123、Rh 123-SLN)加入到孔中,设平行孔每组为6。37 ℃培养24 h后,弃去培养基,细胞用PBS液洗涤3次,每孔中分别加入终浓度为10%的CCK-8溶液,37℃孵育1 h,多标记酶标仪在450 nm波长处测定其光密度(OD)值。
经测定,空白孔的OD值并记录为A空白,对照孔的OD值记录为A对照,含有Rh 123和Rh 123-SLN的给药孔的OD值并记录为A测定。根据公式(2)计算细胞活力(%)。根据结果选择适当浓度的Rh 123和Rh 123-SLN用于进一步的细胞摄取研究。

|
(2) |
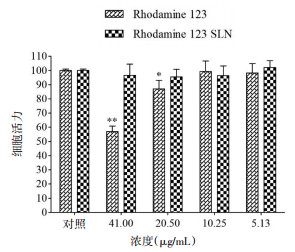
Rh 123和Rh 123-SLN对HCEpiC细胞和SRA 01/04细胞活力的影响结果如图 4、5,在5.13 μg/mL和10.25 μg/mL浓度下Rh 123和Rh 123-SLN对两种细胞均无明显毒性,与对照组相比无显著性差异。当Rh 123的浓度为20.50 μg/mL和41.00 μg/mL时,对两种细胞均产生显著毒性。因此,选择浓度为5.13 μg/mL和10.25 μg/mL的Rh 123-SLN进行细胞摄取研究。
|
| 与对照组比较,**P < 0.01,*P < 0.05 图 4 Rh 123和Rh 123-SLN对HCEpiC细胞活力的影响 |

|
| 与对照组比较,**P < 0.01,*P < 0.05 图 5 Rh 123和Rh 123-SLN对SRA 01/04细胞活力的影响 |
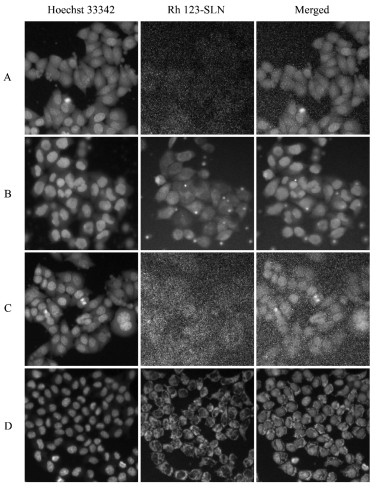
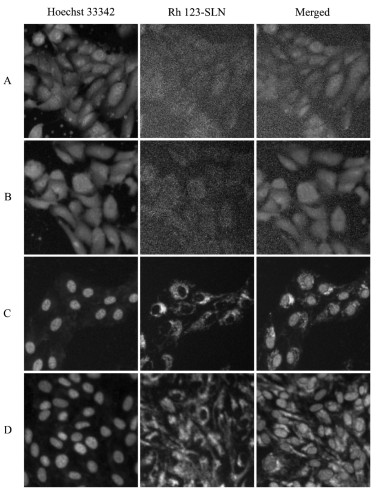
取正常生长的HCEpiC细胞与SRA 01/04细胞消化、混悬,将HCEpiC细胞以2×104/孔、SRA 01/04细胞以1×104/孔的密度分别接种于96孔培养板中,在37 ℃、5% CO2下培养24 h使细胞贴壁生长。经同步化后,分别将100 μL浓度为5.13 μg/mL和10.25 μg/mL的Rh 123和Rh123-SLN样品加入到不同孔中。37 ℃下培养4 h和8 h后,弃去含样品的培养基,PBS洗涤两次,4%多聚甲醛固定20 min,PBS洗涤3次,采用Hoechst33342对细胞核进行染色,PBS洗涤后用高内涵成像系统拍照成像,使用Columbus图像数据处理和分析系统来处理实验数据和图像,结果见图 6、7。
|
| 图 6 5.13 μg/mL(A)和10.25 μg/mL(C)Rh 123-SLN共培养4 h后,以及5.13 μg/mL(B)和10.25 μg/mL(D)的Rh 123-SLN共培养8 h后HCEpiC细胞的高内涵图像 |
|
| 图 7 5.13 μg/mL(A)和10.25 μg/mL(C)Rh 123-SLN共培养4 h后,以及5.13 μg/mL(B)和10.25 μg/mL(D)的Rh 123-SLN共培养8 h后SRA01/04细胞的高内涵图像 |
结果表明,随着Rh 123-SLN孵育时间从4 h延长至8 h,浓度从5.13 μg/mL增加至10.25 μg/mL,HCEpiC细胞和SRA01/04中的绿色荧光强度增强。如图 6、7所示,图C、D中的荧光强度均强于图A、B中的荧光强度,表明随着Rh-123浓度的增加,细胞中的荧光强度也增加。图B和图D中的荧光强度分别强于图A、C中的荧光强度,表明细胞中的荧光强度随孵育时间的延长而增加。图 7表明,绿色荧光主要分布在细胞核周围,即Rh 123-SLN被SRA01/04细胞摄取后主要存在于细胞质中。表明Rh 123-SLN可以被HCEpiC细胞和SRA01/04细胞吸收,且细胞摄取量与药物浓度和孵育时间呈正相关。
3 讨论DSC是医药学领域中最广泛使用的热力学方法之一。通过测量程序升温期间药物焓和温度的变化,可以研究药物的纯度,转化热,反应热和无定形状态等[21-22]。该研究通过DSC分别对ECH、空白SLN、ECH-SLN及物理混合物的吸热峰进行研究表征及比较分析,证明了松果菊苷在SLN中以分子分散状态存在。XRD是一种晶体检测方法。通过XRD衍射图谱,可以获得材料的成分、材料内部原子或分子的结构或形态,在制药工业中,主要用于确定晶体的原子和分子结构来判断晶体类型和组成。该研究通过XRD分析,松果菊苷在SLN中是以分子分散形式而不是晶体形式。DSC和XRD两种物理表征方式确定了松果菊苷在SLN中的存在形式。
松果菊苷为水溶性药物,本研究中应选择水溶性的荧光标记物来替代松果菊苷制备荧光标记的SLN,而Rh 123能溶于水及乙醇,溶解性与松果菊苷较为相似,且无毒性,不会损伤细胞,并且它可以通过细胞膜的选择性染色活细胞线粒体而呈黄绿色荧光,Rh 123荧光标记物单独对细胞作用时不能进入细胞,故采用Rh 123包载的SLN能通过荧光以证明细胞对SLN的摄取情况,因此选择Rh 123为荧光标记物进行细胞摄取研究。研究表明,以Rh 123溶液为荧光标记物标记HCEpiC细胞和SRA 01/04细胞,并用Hoechst 33342对细胞核染色。表明10.25 μg/mL的Rh 123溶液与人晶状体上皮HCEpiC细胞或人角膜上皮SRA 01/04细胞共孵育8 h后,均未见明显绿色荧光。初步判断Rh 123溶液在实验孵育时间内不能进入两种细胞或进入细胞量很少不能被观测到,故排除了荧光标记物Rh 123自身对Rh 123-SLN摄取的影响。
本研究制备的ECH-SLN拓展了松果菊苷抗氧化活性的应用及松果菊苷在白内障治疗中的潜在作用,并验证了SLN在眼部给药系统中的有效性。虽然证实了Rh 123-SLN可被HCEpiC和SRA01/04细胞摄取,及以SLN为载体时,松果菊苷可顺利进入细胞,但松果菊苷进入细胞后的抗氧化活性作用的机制及效果需进一步研究。
| [1] |
Khairallah M, Kahloun R, Bourne R, et al. Number of peo-ple blind or visually impaired by cataract worldwide and in world regions, 1990 to 2010[J]. Invest Ophthalmol Vis Sci, 2015, 56(11): 6762-6769. DOI:10.1167/iovs.15-17201 |
| [2] |
Okoye O, Eze BI, Chuka-Okosa CM. Eliminating the barri-ers to uptake of cataract surgery in a resource-poor setting:A focus on direct surgical cost[J]. Niger J Clin Pract, 2015, 18(3): 333-336. DOI:10.4103/1119-3077.151768 |
| [3] |
Ranjini H, Murthy PR, Murthy GJ, et al. Femtosecond laser-assisted cataract surgery versus 2.2 mm clear corneal phacoemulsification[J]. Indian J Ophthalmol, 2017, 65(10): 942-948. DOI:10.4103/ijo.IJO_152_17 |
| [4] |
Lu ZQ, Sun WH, Yan J, et al. Cigarette smoking, body mass index associated with the risks of age-related cataract in male patients in northeast china[J]. Int J Ophthalmol, 2012, 5(3): 317-322. |
| [5] |
Leske MC, Wu SY, Hennis A, et al. Diabetes, hypertension, and central obesity as cataract risk factors in a black popu-lation-the barbados eye study[J]. Ophthalmology, 1999, 106(1): 35-41. DOI:10.1016/S0161-6420(99)90003-9 |
| [6] |
Ji Y, Cai L, Zheng T, et al. The mechanism of uvb irradia-tion induced-apoptosis in cataract[J]. Mol Cell Biochem, 2015, 401(1-2): 87-95. DOI:10.1007/s11010-014-2294-x |
| [7] |
Varma SD, Kovtun S, Hegde KR. Role of ultraviolet irradia-tion and oxidative stress in cataract formation-medical pre-vention by nutritional antioxidants and metabolic agonists[J]. Eye Contact Lens, 2011, 37(4): 233-245. DOI:10.1097/ICL.0b013e31821ec4f2 |
| [8] |
Qi HP, Wei SQ, Gao XC, et al. Ursodeoxycholic acid pre-vents selenite-induced oxidative stress and alleviates cataract formation:In vitro and in vivo studies[J]. Mol Vis, 2012, 18(15-18): 151-160. |
| [9] |
陈林, 霍红娜, 孙立丽, 等. Fe3O4磁性纳米粒子对花旗松素的吸附能力[J]. 天津中医药大学学报, 2017, 36(1): 49-53. |
| [10] |
Varma SD, Hegde KR, Kovtun S. Inhibition of selenite-in-duced cataract by caffeine[J]. Acta Ophthalmol, 2010, 88(7): e245-249. DOI:10.1111/aos.2010.88.issue-7 |
| [11] |
Zhang D, Lu C, Yu Z, et al. Echinacoside alleviates uvb ir-radiation-mediated skin damage via inhibition of oxidative stress, DNA damage, and apoptosis[J]. Oxid Med Cell Longev, 2017, 2017(3): 1-15. |
| [12] |
Liu X, Luo QH, Zhou J, et al. Effects of echinacoside on gdnf expression and mitochondrial oxidative stress levels in vascular dementia rats[J]. Int J Clin Exp Med, 2017, 10(5): 7752-7759. |
| [13] |
Wu Y, Li L, Wen T, et al. Protective effects of echinacoside on carbon tetrachloride-induced hepatotoxicity in rats[J]. Toxicology, 2007, 232(1-2): 50-56. DOI:10.1016/j.tox.2006.12.013 |
| [14] |
Karbhari VN, Warad TA. Current trends on ocular drugs de-livery system[J]. World journal of pharmacy and pharmaceu-tical sciences, 2016, 5(10): 1248-1258. |
| [15] |
Kavitha K, Kumar PS, Rupeshkumar M, et al. Developments and advanced approaches of ophthalmic drug delivery sys-tem:A review[J]. Int J Curr Pharm Res, 2013, 5(2): 4-9. |
| [16] |
Sultana Y, Jain R, Aqil M, et al. Review of ocular drug de-livery[J]. Curr Drug Deliv, 2006, 3(2): 207-217. DOI:10.2174/156720106776359186 |
| [17] |
Abul Kalam M, Sultana Y, Ali A, et al. Part ⅱ:Enhancement of transcorneal delivery of gatifloxacin by solid lipid nanoparticles in comparison to commercial aqueous eye drops[J]. J Biomed Mater Res A, 2013, 101(6): 1828-1836. |
| [18] |
Hao J, Fang X, Zhou Y, et al. Development and optimization of solid lipid nanoparticle formulation for ophthalmic deliv-ery of chloramphenicol using a box-behnken design[J]. Int J Nanomedicine, 2011, 6(1): 683-692. |
| [19] |
Attama AA, Reichl S, Muller-Goymann CC. Diclofenac sodium delivery to the eye:In vitro evaluation of novel solid lipid nanoparticle formulation using human cornea con-struct[J]. Int J Pharm, 2008, 355(1-2): 307-313. DOI:10.1016/j.ijpharm.2007.12.007 |
| [20] |
陈静, 佟玲, 刘志东, 等. 松果菊苷固体脂质纳米粒处方筛选的研究[J]. 天津中医药大学学报, 2015, 34(6): 353-356. |
| [21] |
Attia AK, Abdel-Moety MM, Abdel-Hamid SG. Thermal analysis study of antihypertensive drug doxazosin mesi-late[J]. Arab J Chem, 2017, 10(S1): S334-S338. |
| [22] |
Li Y, Chow PS, Tan RB. Quantification of polymorphic im-purity in an enantiotropic polymorph system using differen-tial scanning calorimetry, x-ray powder diffraction and ra-man spectroscopy[J]. Int J Pharm, 2011, 415(1-2): 110-118. DOI:10.1016/j.ijpharm.2011.05.058 |
 2019, Vol. 38
2019, Vol. 38