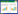文章信息
- 杨星哲
- YANG Xingzhe
- 中西医痤疮病因病机研究撷要
- Research on the pathogenesis of acne in traditional Chinese and western medicine
- 天津中医药大学学报, 2019, 38(4): 329-335
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(4): 329-335
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.04.05
-
文章历史
收稿日期: 2019-01-10
痤疮是一种严重损容性甚至毁容性毛囊皮脂腺疾病[1],好发于额部及胸背部等机体富含皮脂腺的部位,临床上的常见症状是,粉刺、丘疹、脓疱、结节、囊肿等多种类型的皮疹,多伴有皮脂溢出,痤疮病变处伴有瘙痒或疼痛。痤疮病程长,不仅导致患者身体上的病变,也给患者带来心理上的痛苦[2]。随着人们工作和生活节奏的加快和心理压力加大,痤疮的发病率越来越高[3]。在一些中重度痤疮患者中,炎症丘疹及脓疱期消退后的皮损,在患者皮肤上会形成凹陷状萎缩性瘢痕,加重了患者的精神负担。痤疮发病因素极其复杂。近年来,学者们就痤疮的病因病机,进行了大量的研究,但对于具体的发病机制,尚未完全阐明。本文将从中医、西医的视角对痤疮的病因病机进行归纳思考。
1 从中医视角观察形成痤疮的病因病机痤疮,中医称“粉刺”,以中医的视角来看,痤疮属于“肺风粉刺”。《医学宗鉴·外科心法要诀》阐明了痤疮形成的原因和症状表现,并指明了痤疮的治疗方法。认为痤疮形成的原因是“肺经血热”,常“发于面鼻”,形状如“黍屑”,色红肿痛,“破出白粉汁”,“日久皆成白屑”。在治疗方面,以“内服枇杷清肺饮,外敷颠倒散”而起效[4]。作为一种毛囊皮脂腺慢性炎症性皮肤病,痤疮是由多种因素导致而起。中医学认为,痤疮多因肺经风热、熏蒸肌肤、脾失健运、脾胃蕴湿积热而引起[5]。究其中医病因病机,归纳起来,主要有以下几方面。
1.1 外受风邪,肺经蕴热指身体在阳热积聚于肺经时,外受风邪,风邪熏蒸于面部,而发为痤疮。据巢元方在其成书于隋朝的,中国现存的第一部病因病理学专著——《诸病源候论·面体病诸候》中的描述,“面疙者”,生于面部,是由于“风热气生疙”,疙头像米粒一样大小,有的像谷粒一样大小,颜色呈白色。《圣济总录卷第一百一·面体门》中说,颜面部的痤疮,“细起如粟谷状”,是由于“风热相搏而生”,原因是“诸阳在于头面”。而风热之邪,乘虚而入,郁结不散,导致了痤疮的形成。认为痤疮是因外受风邪,肺经蕴热而起。风热,是风和热相结合的病邪,风热之邪犯表、肺气失和而成痤疮。治则以疏风清热为主。《外科正宗》载:“又有好饮者,胃中糟粕之味,熏蒸肺脏而成。”痤疮患者的皮损处多呈丘疹样,颜色赤红,皮损处常伴有痒痛和脓疱,兼见有“口渴喜饮、便秘、尿赤”,同时还有“舌红苔薄黄、脉弦滑”的临床表现。治疗上,“方用枇杷清肺饮加减”[6]。
1.2 湿热蕴结,痰湿互结指由于湿热积聚在身体内部,不能流注,致使各脏腑经络的运行受到阻碍,而发为痤疮。《素问·生气通天论篇第三》中,是这样记载的:“汗出偏沮,使人偏枯。汗出见湿,乃生痤疿。膏梁之变,足生大丁,受如持虚。劳汗当风,寒薄为皶,郁乃痤。……魄汗未尽,形弱而气烁,穴俞以闭,发为风疟。故风者,百病之始也……”长期过量食用辛辣、肥甘厚味的人,易有湿热郁积,湿热聚结日久,使湿化热,湿热互相交结,迁延日久,形成囊肿。“久则气血凝滞或痰血瘀洁、肝失疏泄、外犯肌肤而成”[7]。面部、胸背部皮肤黏腻,病变处红肿疼痛,或有脓疱出现,常常伴有口臭,临床上往往脉滑数,同时伴有尿黄便秘,舌红苔黄腻的现象。“湿热蕴结型,方用批把清肺饮合黄连解毒汤加减;痰湿互结型,方用海藻玉壶汤或参苓白术散合四物汤加减”[6]。
1.3 毒热互结,肝肾阴虚此类病因造成的痤疮患者,病程绵延日久且反复发作,并且由于久病,造成脾胃失运化,此时,水湿停留、凝聚在一起,就形成了痰;或因肺胃积热,郁结于内,聚湿生痰,日久痰瘀互结,聚于皮肤,导致痤疮迁延难愈[8]。上乘土位则消谷善饥,循阳明经而上熏于面,则面起痤疮[9]。又或是先天禀赋特殊,自父母所受的体质、皮肤性质决定,先天素体的肾阴不足,肾之阴阳平衡失调,一旦到了青春期,肾气充盈,女子天癸至,男子相火旺,循经上蒸头面而致病发[10]。《外科正宗·肺风粉刺酒鼻第八十一》中认为,“肺风”“粉刺”“酒鼻”,为同种病的3个名称,其中,“粉刺”病位在肺,“酒鼻”病位在脾,都是因为“血热郁滞不散”而致。《外科启玄》也持相类观点,认为痤疮是由于“肺气不清”,受风寒之邪而形成;或者是由于常用冷水清洗面部,导致“热血凝结于面”。治疗上宜清肺消风活血药治之,外上擦药消之”。因“毒热互结、肝肾阴虚”而致的痤疮患者,临床上表现为皮损呈暗红色,主要以皮肤的结节、囊肿和瘢痕为主,病程长而迁延不愈,以致形成难治性痤疮。有的患者伴有腹胀纳差,舌苔暗红而腻,脉弦滑。对于此型痤疮,临床宜灵活用方,细辨证论治,多方合用化裁。
1.4 冲任失调有学者提出,冲任不调也是痤疮的病因。禤国维[11]临证多年发现,还有因肾阴不足、冲任失调型的痤疮患者,不仅仅局限于肺胃血热。肾阴不足,冲任失调,相火妄动,虚火上熏蒸于头面而生痤疮,是此类型痤疮发病的病因病机。冲任失调型的一部分女性患者,多有在月经前后痤疮发作或加重;或伴有月经失调、痛经等的表现。女性患者情绪不稳定,与男性患者相比,较易肝郁化火,冲任失调。临床上,如果患者为女性,辨证为冲任不调型痤疮的要点是,痤疮的发生、病情的发展及预后转归等,与其月经周期关系密切。病机在于素体肾阴不足,相火过旺,肝失疏泄,冲任不调,从而导致痤疮随月经而发[12]。临床上以颜面部、胸背部皮肤油腻,中间散在多个丘疹、脓疱、结节,病变部位夹杂有黑头粉刺、白头粉刺等,舌淡红苔白腻,脉弦滑为常见表现。有的临床和研究人员以“女子以肝为先天”作为理论依据,就女性迟发性痤疮,认为其病位主要在肝,因湿热为患,肝经湿热循经上扰而引起[13]。李兴广教授[14]将此种痤疮分两型论治:病变部位颜色淡红,有色斑或有色素沉着,伴有面色萎黄,月经不调等,为肝郁脾虚所致,治疗时用逍遥散加减;病变部位颜色暗红,有结节,在口周以及下颌处多发,同时伴有痛经、经血颜色晦暗或有血块者,是瘀血阻滞所致,用桃红四物汤加味治疗。
由此可见,从中医视角观察痤疮形成的病因病机,从辨证分型方面,已不仅仅囿于传统的风热、肺热和血热的观点,而是出现了从肝、心、肾、脾论治的观点,出现了以湿热、血瘀、气滞、痰凝、热毒、阴虚、冲任失调等为痤疮病因病机的观点。这些观点进一步丰富了中医对痤疮病因病机的认知,也充实了中医对痤疮的辨证分型,对以中医思维临床治疗痤疮,有重要的指导意义,见图 1。
|
| 图 1 从中医视角观测痤疮的病因病机 |
研究痤疮的中医病因病机,意义在于运用中医思维治疗痤疮。从痤疮论治的经验来看,古代文献的记载,和现代医家的辨证施治,无不昭示了中医医治痤疮的独特优势,以及中医诊治痤疮的良好前景。虽然中医思维辨证论治痤疮疗效肯定,然其临床运用并不普遍,临床所用的方剂多为自拟方,有较大的随意性。对于中医医籍中治疗痤疮被证实有效的古方、经方、验方,缺乏系统的发掘、分析和整理。如果能将多散在众多的古医籍中的,被证实治疗痤疮有效的古方、经方、验方,按以法类方、以药类方的方法以系统化收集、整理,来指导现代的临床和新药开发,不仅能为开发治疗痤疮新中成药奠定理论基础,还有利于以中医思维治疗痤疮的中医药治疗规范化。
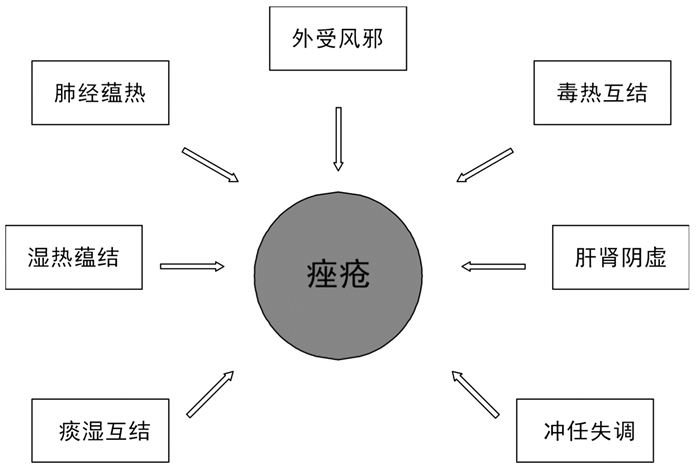
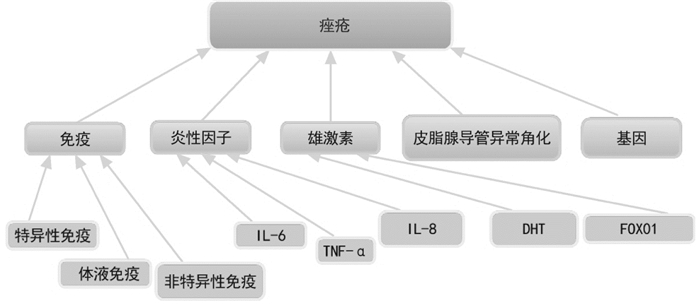
2 从西医视角观察痤疮病因病机痤疮发病与性别、年龄、地区以及种族有一定关系,发病程度千差万别。目前在痤疮研究的学术方面,多聚焦于对痤疮危险因素的探究。从西医角度看,痤疮的发病机制复杂(见图 2)。综合来看,机体免疫失衡、痤疮丙酸杆菌作用、炎性因子作用、雄激素作用、毛囊皮脂腺导管角化异常、遗传相关的主要机制已得到公认。此外,也有一些研究人员认为,痤疮的发病还与患者所处环境、生活习惯相关;另外,肤质、情绪、使用化妆品不当也可影响痤疮的发病。西医治疗痤疮的主要方法是,以外用抗生素联合激素软膏来治疗。
|
| 图 2 痤疮发生的病理过 |
有学者进行了研究,认为:毛囊皮脂腺单位高表达的白介素-1(IL-1)、TOLL样受体、可溶性IL-2受体SIL-2R,与痤疮发病相关。这也印证了痤疮属于毛囊皮脂腺炎症性疾病。高比例的皮肤归巢T细胞、巨噬细胞浸润、人类白细胞抗原高表达和毛细血管增生,出现在痤疮瘢痕愈合消退期的炎症皮损中。这一现象提示了,免疫失衡可能是痤疮由粉刺、脓疱向结节囊肿发展的重要机制[15]。
2.1.1 从痤疮丙酸杆菌与特异性免疫应答的视角观察痤疮病机痤疮丙酸杆菌(P.acnes)是一类致病微生物,广泛存在于空气、土壤、水体和动物体,尤其是人的皮肤上。P.acnes属革兰氏阳性厌氧短杆菌,也是青少年痤疮的重要病因。P.acnes和Toll受体结合,可以引起一系列的炎症反应,诱导包括IL-6在内的炎症因子的释放,进一步加重组织损伤。P.acnes触发痤疮炎症是通过TLRs的激活或释放多种酶来完成的,其释放的酶包括酯酶、透明质酸酶和蛋白酶等,结果造成组织损伤。P.acnes和Toll受体结合,可诱导炎症因子(如IL-6)的释放,产生一系列的炎症反应,促进组织损伤。皮脂腺形成的重要物质包括维生素A、内源性视黄醛和它们的自然代谢物。基于此,有学者研究发现[6],局部应用类维生素A不仅对炎性和非炎性病变有治疗作用,还可缓解已发生的炎症反应,同时预防黑头粉刺的发生。而作为场外杀菌剂的过氧化苯甲酞,则不会使细菌产生耐药性。在临床上,痤疮患者外用和口服抗生素治疗效果差别不大,局部结合使用类维生素A可以增强治疗的效果。临床证实,对于寻常型痤疮,以口服盐酸米诺环素胶囊,配合外用0.025%维A酸乳膏,另外加服中药汤剂来医治,能够收到良好的疗效[16]。
2.1.2 从痤疮丙酸杆菌与非特异性免疫的视角观察痤疮病机免疫组化法测定的结果显示,TLR2在皮质类固醇激素引起的痤疮样皮损中的表达,明显高于正常皮肤中TLR2的表达。同时,TLR2在皮质类固醇激素对Hacat细胞的表达,出现显著上调。TLR2在受痤疮丙酸杆菌刺激的Hacat细胞中的表达,也出现显著上调。这一点,在体外培养的角质形成细胞系Hacat细胞实验中,也得到了验证。在角质形成细胞中,TLR2的高表达,能够激活下游信号通路,诱导趋化因子和炎性细胞因子的生成。而炎性细胞的聚集,可加重痤疮炎性反应的发生[17]。作为Toll样受体(TLRs)的一种,TLR2能够识别多种病原微生物,包括细菌、真菌、分枝杆菌的产物等。TLR2也能够激活核因子-κB,促进促炎性因子、黏附分子、酶类以及抗微生物肽基因的转录[18]。研究证实,单核细胞是由痤疮丙酸杆菌通过TLR2依赖途径来激活的。痤疮病损中的TLR2,只在单核细胞中表达,在淋巴细胞中没有表达。由此可见,通过参与TLR2基因的变异,痤疮丙酸杆菌得以完成其促炎机制[19]。
2.1.3 从体液免疫的视角观察痤疮病机有学者运用测定痤疮患者免疫球蛋白和补体水平的方法,目的是从体液免疫的角度,来研究痤疮在瘢痕形成过程中的机制。运用免疫速率散射比浊法,来测定IgE、IgG、IgM和补体C3、C4水平。结果发现,其他组血清中的IgE、IgG、IgM和补体C3的水平,低于瘢痕组血清中IgE、IgG、IgM和补体C3的水平,此结果具有统计学意义(P<0.05)。而在瘢痕组血清中,C4的水平和其他各组间的差异,没有统计学意义。有学者通过对痤疮瘢痕组患者血清中的3种免疫球蛋白进行分析,来判定痤疮发病与这3种免疫球蛋白的相关性。结果发现,痤疮患者瘢痕的形成,与IgG和IgM显著相关(P<0.01),与IgE和IgG相关(P<0.05)。在痤疮患者瘢痕形成的机制中,体液免疫发挥了十分重要的作用。而上述具有相关性的实验结果表明,在痤疮瘢痕的进程中,IgE、IgG、IgM三者可能是互相协作的关系[20]。
2.2 从炎性因子的视角观察痤疮病机从现有研究成果来看,对于痤疮发病中炎症机制作用,尚未得到完全明确。从分子水平的视角,对痤疮的炎症机制进行研究,结果表明,痤疮发生的重要病理过程是炎症,控制炎症是医治痤疮的主要环节。
痤疮发生的基本过程,可以描述如下:最先在炎症部位产生促炎因子,促炎因子具有趋化作用,使炎性细胞积聚在炎性病灶,同时释放出炎性因子,导致炎性反应的发生[21]。IL-6是多种炎症性疾病的重要介质,具有很多生物学效应,包括机体细胞免疫、炎症反应和造血控制。与中性粒细胞和其它多种炎性细胞相同的是,IL-6具有趋化、激活的作用,并且在急性炎症期,IL-6的水平也相应升高[22]。运用放射性免疫方法,对痤疮患者的血清进行检测,结果发现,痤疮患者血清中的IL-6均值显著高于健康对照组。经药物治疗后,再次运用放射性免疫方法检测,结果发现,经过治疗后的痤疮患者的血清中IL-6的水平,恢复到了正常值。以上检测结果说明,作为炎症递质的IL-6,有可能是参与了痤疮发病的病理过程[23]。研究还表明,痤疮的严重程度与白介素8(IL-8)具有相关性。研究发现,IL-8在痤疮患者皮脂中的表达,显著高于正常对照组。有研究证据显示,某些高水平的促炎性细胞因子,包括IL-8在内,会产生在局部炎性病灶中。以上研究结果证实,痤疮的炎症反应与IL-8相关[24]。
还有学者进行了研究,发现痤疮的炎症反应和肿瘤坏死因子(TNF-α)具有一定的联系。研究发现,痤疮患者血清中TNF-α的水平要显著高于健康对照组。由此可以推断,在痤疮发病的病理过程中,TNF-α发挥了一定作用。同时,作为由单核巨噬细胞产生的重要炎性细胞因子,TNF-α可以通过激活炎性细胞,使一系列炎性介质得以产生,从而在痤疮的发病机制和调节炎症的级联反应中,发挥着非常重要的作用[25]。临床上,从痤疮的发展向炎症性反应转化的过程中,P.acnes联合人类皮肤本身存在的固有免疫、角质细胞角化和皮脂腺细胞分泌皮脂因素,最终导致了炎症反应、角质细胞角化过度和皮脂腺分泌旺盛这3个基本的痤疮病理表现[26]。在医治痤疮方面,有学者建议,平衡微生物菌群,使用不易耐药的抗菌药杀灭P.acnes,调整皮脂分泌过程以及改变皮脂成分[27]。郭焕焕等认为,正是因为炎症反应贯穿在痤疮发病的全过程中,在医治痤疮方面,抗炎治疗是关键[28]。
2.3 从雄激素的视角观察痤疮病机在痤疮的病因病机中,雄激素同样起了非常重要的的作用。作为一种雄性激素,双氢睾酮(DHT)由5α还原酶合成。在痤疮发病的病理过程中,DHT直接支配了皮脂的分泌和皮脂腺的发育。Cetionozman等[29]通过对观察女性痤疮患者雄激素和胰岛素敏感标记物,比较其与异维甲酸治疗前后患者是否伴多毛症或排卵功能的障碍。通过对这两类研究对象的评估,发现:严重的痤疮没有参与高雄激素症和胰岛素抵抗,但是,痤疮的发病本身,实际上是雄激素过多的潜在提示。Melnik[30]认为,痤疮的主要病因是基因组水平相对缺乏核转录因子Fox01。而Fox01在痤疮发病机制、临床治疗中起到了关键性的作用。孙欣荣[31]等认为,痤疮的治疗主要以药物治疗为主,根据痤疮的发生原因和严重程度选择合理的用药方案,提高用药安全性。
2.4 从皮脂腺导管异常角化的视角观察痤疮病机毛囊皮脂腺导管发生异常角化,以及脂质水平的转变和细胞因子作用,参与了痤疮发病的病理过程。痤疮的发病可由导管闭塞造成。同时,研究发现,痤疮的发病进程与糖皮质激素(GC)、腺体病理生理学上产生的影响有关[32]。而11β-羟基类固醇脱氢酶1(11β-HSD1)是还原酶,表达人皮脂腺腺体,调节痤疮病变部位。有研究表明,在11β-HSD1中可观察到人体皮肤角质细胞核纤维母细胞。11β-羟基类固醇脱氢酶1(11β-HSD1)影响了GC的可用性。
有学者对维生素A和内源性视黄醛之间互变过程中,P-4501A1(同工酶细胞色素)的多态性[33]进行了研究。以96例痤疮患者及408名正常对照组m1位点和m2位点为观察对象,对限制性片段长度多态性和特殊等位基因聚合酶链反应进行比较研究,由此推测总结出:由于视黄醛活性缺乏,导致了皮脂腺分化的异常,导致了毛囊皮脂腺导管的角化过度,而皮脂腺分化异常和毛囊皮脂腺导管角化过度,正是一部分痤疮患病人群发病的病因。
2.5 从基因的视角观察痤疮病因有学者从遗传基因的视角,对痤疮的病因病机进行了研究。对于CYP17基因的多态性与痤疮发生的相关性进行了探索[34]。研究发现,作为雄激素相关甾体合成基因的CYP17基因,有3种基因型在CYP17基因中存在,这3种基因型分别是:A1A1、A1A2和A2A2,分别对应着野生型(A1A1)和突变型(A1A2和A2A2)。痤疮患者组中A2A2基因型的表达,显著高于健康对照组。实验同样证实了这一结论,该实验是采用PCR及琼脂糖凝胶电泳技术来实施的。有学者把炎性痤疮患者的基因序列和正常人的基因序列,进行比较发现,痤疮病变处有18个基因下调,有211个基因上调。在上调的211个基因中,包含有细胞因子、抗菌肽、间质胶原酶等在内。其中,基质金属蛋白酶1,3和前炎症因子IL-8上调最显著。这一现象证实,在诱导招募炎症介质的过程中,IL-8(白介素8)发挥了重要作用。国内学者对痤疮的遗传模式进行了探究,结果发现,在痤疮的遗传中,一级亲属患病率最高,群体患病率最低,即:一级亲属患病率>二级亲属患病率>群体患病率;研究人员同时还运用多基因阈值模型,对先证者一级亲属遗传度和二级亲属遗传度进行了运算,得出了以下的运算结果,即两级遗传度的加权平均遗传度为(88%±0.092)%,这一数值符合多因素遗传。在男性重型痤疮患者中,CYP17-34C等位基因是男性重型痤疮患者的易感基因之一。以上研究结果证实,AR基因第一外显子CAG的重复片段多态性,与男性痤疮具有相关性[35]。而Akoglu G则认为,TNFα-308和IL-1β多态性与痤疮形成的易感性和痤疮严重程度无关[36]。
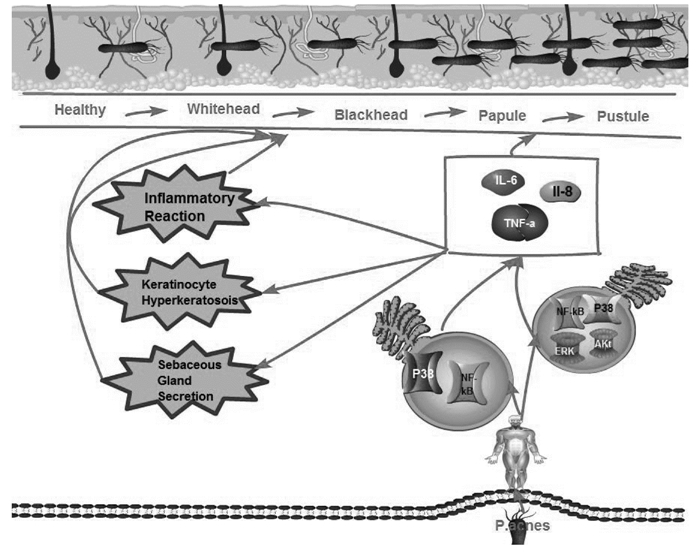
综上,从西医的视角来看,脂质、常驻菌、炎症、基因等多种因素的共同作用,导致痤疮的发生和发展(图 3)。其中,免疫和炎症因子的视角,是本文该部分关注的重点。在炎症引起的痤疮中,在痤疮炎症的发生发展的病理过程中,均有前炎性因子、天然免疫和特异性免疫应答因素的参与,一定程度上机体的免疫失衡也同时存在。但是,目前来看,从免疫视角对痤疮的病因病机进行的研究,还有局限性。这些研究或局限于IL-1、Toll样受体和SIL-2R(可溶性白细胞介素2受体),或局限于某一抗原,或局限于某一免疫球蛋白,或局限于某一细胞因子,这些研究,不能全面对痤疮的免疫应答状态进行研究。事实上,研究发现,无论是促炎症因子和脂质,还是白三烯B4和PPARα(过氧化物酶体增生物激活受体-α)等,这些因素均可能与炎症引起的痤疮具有相关性。事实上,不仅获得性免疫系统参与了痤疮的炎症机制,在痤疮炎症的发生过程中,也有先天免疫系统的参与。也正是因为炎症在痤疮的发生发展中起着重要的作用,可以说炎症是痤疮发生发展的重要病理过程,所以,在临床上治疗痤疮,控制炎症是主要的环节。揭示痤疮炎症发生机制的意义在于,为临床医治痤疮,提供新的治疗靶点。尽管近年来,从免疫机制和炎症的视角对痤疮进行研究,取得了一些新的成果,但是,在病程处于不同程度的痤疮患者中,比如,在轻度痤疮、中度痤疮及重度痤疮患者中,机体所处于的免疫状态是否有区别?如果有,是以何种免疫状态为主?处于主导地位的是体液免疫还是细胞免疫?在痤疮的不同病症表现的患者中,比如粉刺、炎性丘疹、结节、脓疱及囊肿各个时期的患者中,机体的局部免疫应答是怎样的?机体的免疫应答如何演变?对于以上问题,尚无明确的回答,在下一步的研究中需要重点关注。
|
| 图 3 从西医视角观测痤疮的病因病机 |
在痤疮免疫机制和炎症中,已被广泛认可的是,痤疮丙酸杆菌是痤疮的致病因素之一,学者们也从不同的视角,比如痤疮丙酸杆菌与皮脂分泌、痤疮丙酸杆菌与过度角化、痤疮丙酸杆菌与炎症和组织损伤,分别探讨了它们之间的关系。作为一种革兰氏阳性厌氧短杆菌,P.acnes多寄居在皮肤的毛囊及皮脂腺中。皮脂中的甘油三酯作为营养,滋养着P.acnes的生长。P.acnes吸取其甘油三酯中的甘油部分作为营养来生长。同时,去酯化的脂肪酸在皮脂中残留,且去酯化的脂肪酸的含量与细菌的数量成正比关系。这些游离脂肪酸能够导致粉刺,产生炎症刺激,刺激皮脂腺过多地分泌,进而导致皮脂排泄不畅;同时促进了痤疮丙酸杆菌,以及金黄色葡萄球菌、表皮葡萄球菌等其它革兰氏阳性菌的繁殖,促使患者皮肤产生炎症性丘疹、脓疱。研究发现,痤疮的发生发展过程,与P.acnes的繁殖和炎症反应,存在着重要的关系。无论在痤疮早期还是痤疮晚期,均存在痤疮丙酸杆菌的参与。
中医与西医,是人类科学技术在两个角度上的发展,都是人类智慧的结晶。对于痤疮病因病机的关注,无论是从中医的视角,还是从西医的视角,两者均围绕着一个共同的目标:治疗痤疮。从关注的重点看,中医视角研究病因病机,首先着眼于整体,着眼于局部邪与正相争引起肌体的整体变化。在此基础上,四诊合参,辨证施治。同样,西医强调,以客观为基础,运用多种分析手段进行分析研究,并不是只重局部不重整体。事实上,近年来,对整体调控机制的研究,西医也越来越关注。西医对整体调控机制进行的研究,也越来越深入。在痤疮病因病机的研究和治疗上,应该把中医和西医融汇贯通,各取所长。
综上,痤疮的病因病机复杂多样,彼此之间相互联系,互相影响,形成了错综复杂的痤疮发病机制的网络。中医采用辨证论治,疗效确切,但痤疮临床分型的规范性不足。临床治疗痤疮,中医也从不同部位入手进行治疗。有的运用脏腑辨证,有的从肝肾论治,有的从肺、脾、胃论治,有的分虚实而治,有的从实火、虚火辨证论治。还有的以痤疮的皮损部位和痤疮的皮损的形态为依据,进行归经治疗。西医认知痤疮的发病机制,是从免疫遗传学、生活环境、情绪心理、代谢机制、病原微生物等的视角来进行的。在临床上,西医治疗痤疮内服类维生素A,联合外用抗生素和激素软膏,停药易复发,疗效不理想。中医疗效确切,但研究规范性不足,难达共识。西医对痤疮的理论研究上,也关注痤疮的整体调控机制的研究并日趋深入,但临床医治痤疮的疗效有待增强。对痤疮的医治应该中西医互相取长补短,以整体调控机制的视角,中医西医结合起来辨证论治,方能提高治疗痤疮的临床疗效。
| [1] |
Zulu TP, Mosam A, Balakrishna Y, et al. Acne in South African black adults:A retrospective study in the private sector[J]. S Afr Med J, 2017, 107(12): 1106-1109. DOI:10.7196/SAMJ.2017.v107i12.12419 |
| [2] |
Kyeong-HK, Sang CL, Young BP, et al. Cardiff acne disability index:cross-cultural translation in Korean and its relationship with clinical acne severity, pathological patterns, and general quality of life[J]. Tradit Chin Med, 2017, 37(5): 702-709. DOI:10.1016/S0254-6272(17)30326-6 |
| [3] |
Bodo C, Acne V. The metabolic syndrome of the pilosebaceous follicle[J]. Clinics in Dermatology, 2018, 36(1): 29-40. |
| [4] |
陈红风. 中医外科学[M]. 上海: 上海科学技术出版社, 2007: 229.
|
| [5] |
詹炜祎, 赵满忱, 陈柯村, 等. 基于文献研究的痤疮中医临床诊治规律探析[J]. 中华中医药杂志, 2014, 29(4): 1215-1217. |
| [6] |
罗璎, 胡冬裴. 中西医治疗痤疮研究进展[J]. 河南中医, 2014, 34(1): 181-183. |
| [7] |
彭和根. 仙方活命饮加减配合面膜火针治疗中毒痤疮27例[J]. 当代医学, 2010, 16(18): 157-158. DOI:10.3969/j.issn.1009-4393.2010.18.111 |
| [8] |
孙洁, 余土根. 中医古方辨治痤疮临床研究进展[J]. 浙江中西医结合杂志, 2008, 18(8): 527. DOI:10.3969/j.issn.1005-4561.2008.08.053 |
| [9] |
刘恩钊. 益气升阳散火法治疗不典型痤疮例析[J]. 实用中医内科杂志, 2006, 20(6): 646-647. DOI:10.3969/j.issn.1671-7813.2006.06.073 |
| [10] |
曲剑华, 刘清. 陈彤云治疗痤疮经验[M]. 北京: 人民军医出版社, 2010: 14-17.
|
| [11] |
金培志, 汪玉梅. 禤国维教授补肾法治疗难治性皮肤病经验[J]. 河南中医, 2005, 25(2): 18. DOI:10.3969/j.issn.1003-5028.2005.02.008 |
| [12] |
陈信生. 范瑞强教授论治痤疮经验[J]. 新中医, 2001, 33(9): 71-72. DOI:10.3969/j.issn.0256-7415.2001.09.052 |
| [13] |
黎伟珍, 莫令君, 张弘. 从肝论治女性迟发性痤疮的中医研究进展[J]. 现代中医药, 2012, 32(6): 72-74. |
| [14] |
郑春玉, 李兴广. 李兴广治疗痤疮临床经验[J]. 中国中医基础医学杂志, 2011, 17(3): 341-342. |
| [15] |
李佳妍. 痤疮发病机制中免疫应答的研究进展[J]. 医学综述, 2008, 4(8): 1124-1126. DOI:10.3969/j.issn.1006-2084.2008.08.002 |
| [16] |
陆威, 汤怡, 罗宏宾, 陶小华. 中西医结合治疗寻常型痤疮临床观察[J]. 新中医, 2017, 49(12): 104-106. |
| [17] |
Fukata M, Vamadevan AS, Abreu MT. Toll-like receptors(TLRs) and Nod-like receptors(NLRs) in inflammatory disorders[J]. Semin Immunol, 2009, 21(4): 242-253. DOI:10.1016/j.smim.2009.06.005 |
| [18] |
Kaisho T, Akira S. Toll-like receptor function and signaling[J]. J Allergy Clin Immunol, 2006, 117: 979-987. DOI:10.1016/j.jaci.2006.02.023 |
| [19] |
Kim J, Ochoa MT, Krutzik SR, et al. Activation of toll-like receptor 2 in acne triggers inflammatory cytokine Responses[J]. J Immunol, 2002, 169(3): 1535-1541. DOI:10.4049/jimmunol.169.3.1535 |
| [20] |
王慧, 吴艳敏, 王琪, 等. 体液免疫因素在痤疮瘢痕形成过程中的作用[J]. 中国中西医结合皮肤性病学杂志, 2014, 13(4): 205-209. DOI:10.3969/j.issn.1672-0709.2014.04.001 |
| [21] |
Basal E, Jaim Kaushal GP. Antibody response to crude cell lystate of propionibacterium acnes and induction of pro-inflammatory cytokines in patients with acne and normal healthy subjects[J]. J Mierobiol, 2004, 42(2): 117-125. |
| [22] |
黄勇, 黄亚林, 苏韫, 等. 野菊花提取物对慢性支气管炎大鼠血清和支气管肺泡灌洗液中TNF-α、IL-6含量及肺组织病理形态学的影响[J]. 中国老年学杂志, 2010, 30(9): 2614-2616. |
| [23] |
王慧. 痤疮颗粒对痤疮患者体液免疫中细胞因子的影响[J]. 中医药学报, 2010, 38(2): 119-120. DOI:10.3969/j.issn.1002-2392.2010.02.047 |
| [24] |
Alestas T, Ganceviciene R, Fimmel S, et al. Enzymes involved in the biosynthesis of leukotriene B4 and prostagland in E2 are active in sebaceous glands[J]. J Mol Med, 2006, 84(1): 75-87. |
| [25] |
Isard O, Knol AC, Castex-Rizzi N, et al. Cutaneous induction of corticotrop in releasing hormone by Propionbacterium acnes extracts[J]. Dermatoendocrinol, 2009, 1(2): 96-99. DOI:10.4161/derm.1.2.8102 |
| [26] |
Picardo M. Acne and Rosacea[J]. Dermatol Ther(Heidelb), 2017, 7: 43-52. DOI:10.1007/s13555-016-0168-8 |
| [27] |
王艺, 秦晓蕾. 痤疮丙酸杆菌致病机制的研究进展[J]. 中国美容医学, 2017, 26(11): 139-141. |
| [28] |
郭焕焕, 张文学. 痤疮发病机制及对青少年的影响[J]. 生物学教学, 2017, 42(2): 4-5. |
| [29] |
Cetinozman F, Yazgan AD, Erin G, et al. Insulin sensitivity, androgens and isotretino in therapy In women with severe acne[J]. Dermatolog Treat, 2013, 25(2): 119-122. |
| [30] |
Melnik BC. Fox01——the key for the pathogenesis and therapy of acne[J]. Dtsch Dermatol Ces, 2010, 8(2): 105-114. |
| [31] |
孙欣荣, 刘志宏, 黄爱文, 等. 痤疮发病机制及其药物治疗的研究进展[J]. 中国药房, 2017, 28(20): 2868-2871. DOI:10.6039/j.issn.1001-0408.2017.20.38 |
| [32] |
Lee SE, Kim JM, Jeong MK, et al. 1α-hydroxysteroid dehydrogenase type 1 is expressed in human sebaceous glands and regulates glucocorticoid——induced lipid synthesis and toll——like receptor 2 expression in SZ95 sebocytes[J]. Br J Dermatol, 2013, 168(1): 47-55. |
| [33] |
Paraskevadis A, Drakoulis N, Roots I, et al. Polymorphisms in the human cytochrome P-450 lAl gene (CYP1A1)as a factor for developingacne[J]. Dermatology, 1998, 196(4): 171-175. |
| [34] |
于军, 杨婷, 田黎明, 等. 雄激素相关基因CYP17多态性与囊肿型痤疮的相关性研究[J]. 北京医学, 2011, 33(1): 45-48. |
| [35] |
孙莉, 李娟, 颜敏, 等. 痤疮的发病机制研究进展[J]. 山东医药, 2013, 32(53): 97-100. |
| [36] |
Akoglu G, Tan C, Ayvaz DC, et al. Tumor necrosis factor α-308 G/A and interleukin 1β-511 C/T gene polymorphisms in patients with scarring acne[J]. J Cosmet Dermatol, 2018. DOI:10.1111/jocd.12558 |
 2019, Vol. 38
2019, Vol. 38