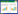文章信息
- 谢佳蓉, 马旭彤, 闫宏丽, 梁春霞, 皮佳鑫, 刘志东
- XIE Jiarong, MA Xutong, YAN Hongli, LIANG Chunxia, PI Jiaxin, LIU Zhidong
- 疏血通注射液与2种常用溶媒配伍的稳定性研究
- Stability study of Shuxuetong injection in two common solvents
- 天津中医药大学学报, 2019, 38(4): 336-340
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(4): 336-340
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.04.06
-
文章历史
收稿日期: 2019-03-26
2. 天津中医药大学中医药研究院, 天津 301600;
3. 天津中医药大学, 现代中药发现与制剂技术教育部工程中心, 天津 301600
2. The Institute of Traditional Chinese Medicine, Tianjin University of Chinese Traditional Medicine, Tianjin 301600, China;
3. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301600, China
疏血通注射液是由水蛭、地龙提取并精制而成的复方中药注射剂,具有活血化瘀、通经活络的功能,用于瘀血阻络所致的中风中经络急性期,症见半身不遂、口舌歪斜、言语蹇涩,急性脑梗死见上述症状者[1]。疏血通注射液作为一种中药注射液,成分较复杂,溶媒的选择对临床应用的影响较大[2]。此外,中药注射液配伍后的各项指标超标是产生临床不良反应的潜在风险之一,例如配伍后不溶性微粒不合格会导致发热、畏寒、寒颤、胸闷、气紧以及皮肤过敏等临床症状[3]。为保证疏血通注射液的临床使用安全,本文对疏血通注射液与临床常用配伍:100、250、500 mL规格的0.9%氯化钠注射液和5%葡萄糖注射液进行配伍后溶液的稳定性考察。考虑到氯化钠注射液的盐析作用[4],选用多厂家不同规格的氯化钠注射液进行考察。考察参数包括:溶液外观、pH值、渗透压摩尔浓度、不溶性微粒、粒径、蛋白质及次黄嘌呤含量。
1 仪器与试剂Sartorius酸度仪PB10,YASN渗透压测定仪Ospmopro3250,HACH浊度仪2100Q,天河医疗不溶性微粒分析仪GWF-5JA,Malvern激光粒度分析仪Nano Zetasizer,岛津高效液相色谱仪LC-20AT,水为纯化水,甲醇色谱纯,磷酸氢二钠为分析纯。
疏血通注射液(牡丹江友搏药业有限责任公司,规格:2 mL,批号:161023 13);0.9%氯化钠注射液(河北天成药业有限公司,规格:100 mL,批号:F18041304,配伍样品编号:NS100-1);0.9%氯化钠注射液(河北天成药业有限公司,规格:100 mL,批号:F18032505,配伍样品编号:NS100-2);0.9%氯化钠注射液(回音必集团东亚制药,规格:100 mL,批号:20171031 41,配伍样品编号:NS100-3);0.9%氯化钠注射液(河北天成药业有限公司,规格:250 mL,批号:F18032002,配伍样品编号:NS250-1);0.9%氯化钠注射液(回音必集团东亚制药,规格:250 mL,批号:20180110 43,配伍样品编号:NS250-2);0.9%氯化钠注射液(河北天成药业有限公司,规格:500 mL,批号:A18040109,配伍样品编号:NS500-1);0.9%氯化钠注射液(河北天成药业有限公司,规格:500 mL,批号:A20183107,配伍样品编号:NS500-2);0.9%氯化钠注射液(回音必集团东亚制药,规格:500 mL,批号:20180306 41,配伍样品编号:NS500-3);5%葡萄糖注射液(江西科伦药业有限公司,规格:100mL,批号:A18041802,配伍样品编号:GS100);5%葡萄糖注射液(江西科伦药业有限公司,规格:250 mL,批号:C18043003-1,配伍样品编号:GS250);5%葡萄糖注射液(江西科伦药业有限公司,规格:500 mL,批号:C18020904,配伍样品编号:GS500)。
2 方法与结果 2.1 配伍方法疏血通注射液说明书中“用法用量”描述为“静脉滴注,每日6 mL或遵医嘱,加于5%葡萄糖注射液(或0.9%氯化钠注射液)250~500 mL中,缓慢滴入”。依据此临床用法用量,将3支(2 mL/支)疏血通注射液用注射器吸取内容物后,分别注入以上11种溶媒(0.9%氯化钠注射液100、250、500 mL;5%葡萄糖注射液100、250、500 mL)中摇匀待用。设置检测节点为配伍后1、2、4、6、8 h,并以配伍后0 h作为对照组。
2.2 疏血通配伍溶媒后溶液颜色及外观检查参照《中国药典(2015版)》第四部0901溶液颜色检查法[5],配制标准色号。按照表 1中比例使用移液器和量筒配制0.5、1、2色号各10 mL,转移至25 mL奈式比色管中。用量筒量取10 mL不同溶媒不同规格配伍后的注射液于25 mL奈式比色管中,分别与现配药典标准色号0.5、1、2号进行比色。
配伍后溶液颜色均为淡黄色,100 mL规格配伍后比色号2浅,250 mL规格配伍后比色号1浅,500 mL规格配伍后比色号0.5浅。0~8 h期间颜色稳定无变化。且以上配伍样品8 h内均澄清。
2.3 疏血通配伍溶媒后pH稳定性考察参照《中国药典(2015版)》第四部0631pH测定法[5],分别测定配伍0、1、2、4、6、8 h后样品溶液的pH,以考察配伍后溶液pH的稳定性。酸度仪使用前用pH4.00、pH6.86、pH9.18标准缓存液进行校准。
配伍溶液样品的pH测量结果见表 2。从结果可以看出,疏血通注射液与0.9%氯化钠注射液、5%葡萄糖注射液配伍后pH均分布在5~6之间,ΔpH≤0.7,8 h内无显著变化,酸度稳定,符合人体注射条件,也符合疏血通注射液国家标准中的规定。
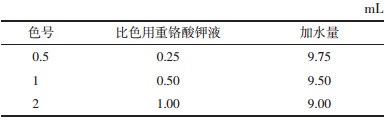
参照《中国药典(2015版)》第四部0632测定法[5],分别测定配伍0、1、2、4、6、8 h后样品溶液的渗透压,以考察配伍后溶液渗透压的稳定性。渗透压测定仪使用前用290 mOsmol/kg标准氯化钠溶液校正。
配伍溶液样品的渗透压测定结果见表 3。从结果可以看出,疏血通注射液与0.9%氯化钠注射液、5%葡萄糖注射液配伍后渗透压均分布在人体血液的渗透压摩尔浓度范围(285~310 mOsmol/kg)内,0~8 h内RSD≤2%,渗透压无显著变化。
参照《中国药典(2015版)》第四部0903不溶性微粒检查法第一法(光阻法)[5],分别测定配伍0、1、2、4、6、8 h后样品溶液的不溶性微粒。结果见图 1及图 2。
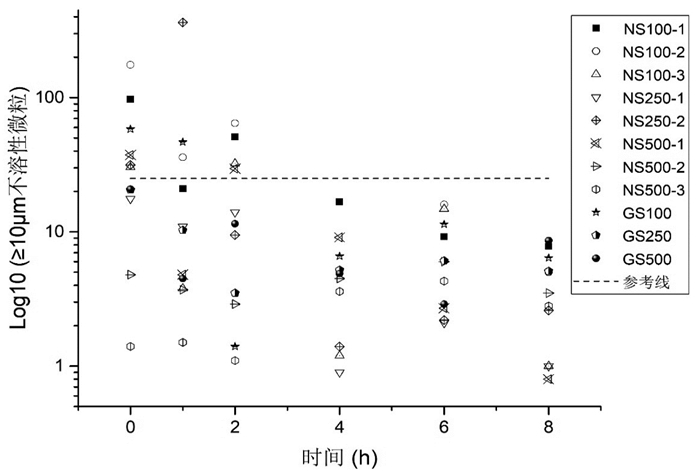
|
| 图 1 疏血通与2种溶媒配伍后不溶性微粒(≥10 μm)分布图(参考线为25粒/mL) |
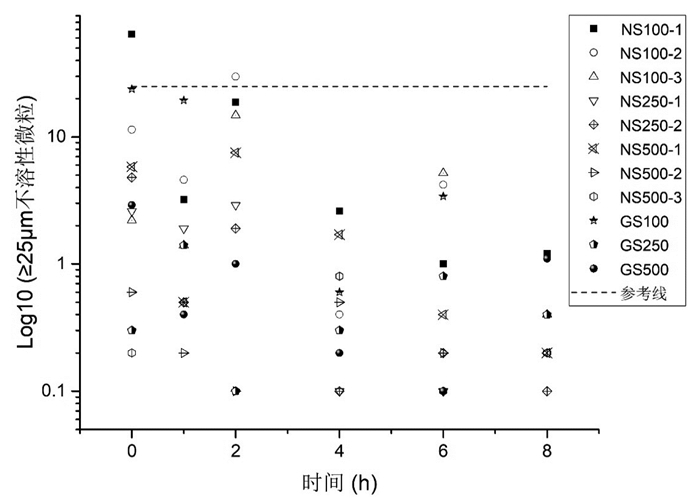
|
| 图 2 疏血通与2种溶媒配伍后不溶性微粒(≥25 μm)散点分布图(参考线为3粒/mL) |
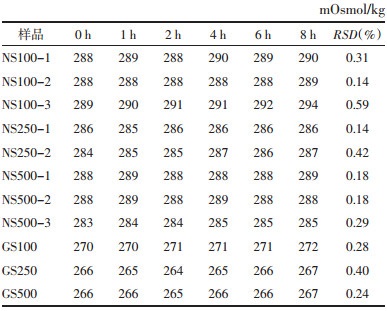
以上结果表示,疏血通注射液与0.9%氯化钠注射液100 mL(NS100-1、NS100-2)、250 mL(NS250-2)配伍后2 h不溶性微粒稳定,符合中国药典标准;与0.9%氯化钠注射液500 mL(NS500-2)配伍后1 h或配伍后即刻不溶性微粒稳定,符合中国药典标准;其中,配伍规格越大,不溶性微粒越稳定。疏血通注射液与5%葡萄糖注射液100 mL(GS100)配伍后2 h不溶性微粒稳定,符合中国药典标准;与5%葡萄糖注射液250、500 mL配伍后即刻稳定,符合中国药典标准。综合来看,在临床使用中,应尽量选取大规格溶媒进行配伍;若选择0.9%氯化钠溶液,应摇匀静置后进行使用(中国药典规定:标示装量100 mL或100 mL以上的静脉注射液,每1 mL中含10及10 μm以上的微粒数不得过25粒,含25及25 μm以上的微粒数不得过3粒)。
2.6 疏血通配伍溶媒后粒径考察参照《中国药典(2015版)》第四部0102注射剂要求[5],将按照上述方法配伍后的溶液用移液管吸取1 mL至样品池,用激光粒径测定仪测量配伍0、1、2、4、6、8 h后样品溶液的粒径。配伍溶液样品的粒径测定结果见图 3及图 4。
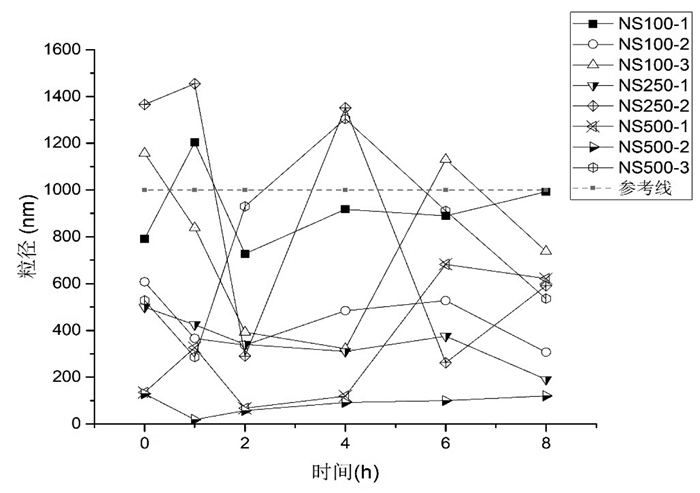
|
| 图 3 疏血通与0.9%氯化钠注射液配伍粒径折线图 |
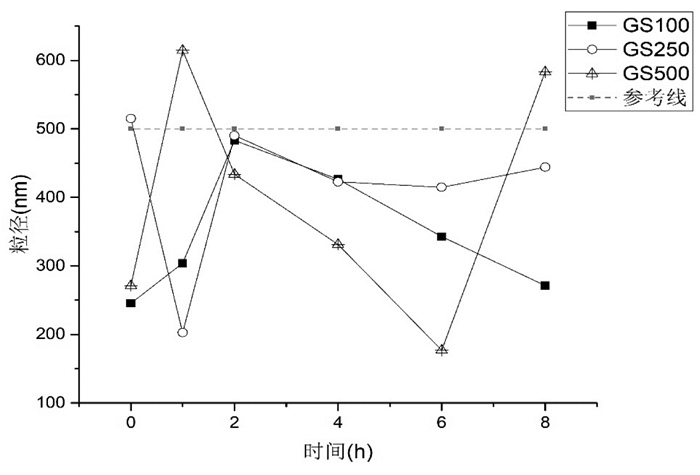
|
| 图 4 疏血通与5%葡萄糖注射液配伍粒径折线图 |
结果可见,由于氯化钠注射液的盐析作用,0.9%氯化钠注射液作为溶媒的粒径普遍大于5%葡萄糖注射液。疏血通与0.9%氯化钠注射液配伍后粒径大部分在1 μm以内,其中NS100-1(1 h);NS250-2(0 h、1 h、4 h);NS500-3(4 h)粒径大于1 μm,小于1.5 μm,人体血管直径大约在4~7 μm[6],人体可耐受;疏血通与5%葡萄糖注射液配伍后粒径大部分在0.5 μm以内,粒径均合理。
2.7 疏血通配伍溶媒后有关物质检查(蛋白质)参照《中国药典(2015版)》第四部2400注射剂有关物质检查法[5],取疏血通注射液配伍以上11种溶媒后的溶液,精密吸取1 mL,加入新配制的30%磺基水杨酸溶液1 mL,混匀,静置5 min,以上配伍样品0~8 h内均未出现沉淀。结果表明,配伍后的溶液中蛋白质符合限度规定。
2.8 疏血通配伍溶媒后次黄嘌呤含量测定照高效液相色谱法测定。色谱条件:色谱柱为十八烷基硅烷键合硅胶填充色谱柱;柱温为室温;检测波长为254 nm;流动相为0.1%磷酸氢二钠水溶液,流速为1 mL/min;进样量:6 μL。
对照品溶液的制备:精密称取次黄嘌呤对照品约10 mg,置100 mL容量瓶中,加水溶解并稀释至刻度,摇匀,即得(每1 mL含次黄嘌呤0.1 mg)。
供试品溶液的制备:将疏血通注射液3支(2 mL/支)用注射器吸取内容物后分别注入以上11种溶媒中,摇匀,即得。
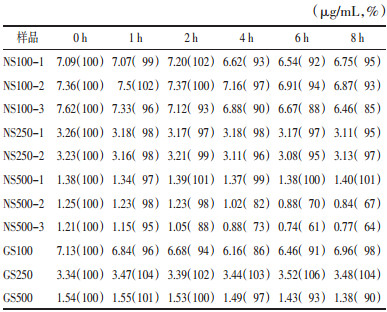
如表 4及图 5所示,疏血通注射液与0.9%氯化钠注射液配伍后次黄嘌呤含量2 h内稳定(含量百分比>90%),2 h后随时间呈缓慢降解趋势;疏血通注射液与5%葡萄糖注射液配伍后8 h内基本稳定(含量百分比>90%)。
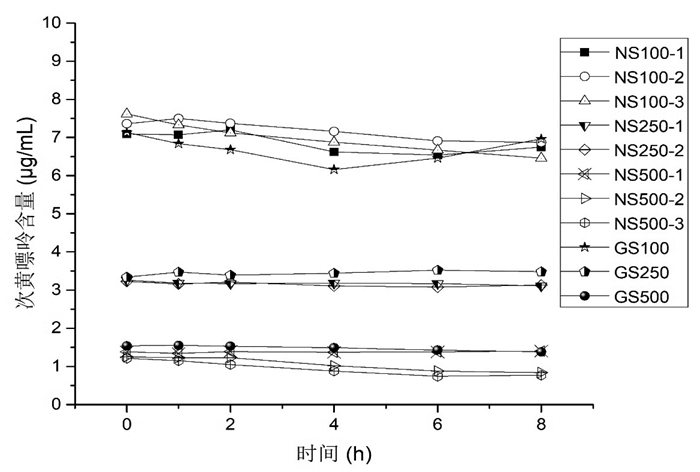
|
| 图 5 疏血通与溶媒配伍后8 h内含量变化折线图 |
为了更大限度地涵盖各种临床用药情况,除采用说明书中配伍规格外,还增添了100 mL的配伍规格进行稳定性考察。实验表明,疏血通注射液与0.9%氯化钠注射液、5%葡萄糖注射液配伍后8 h内溶液颜色和外观、pH值、渗透压摩尔浓度均无显著性变化。溶液澄清,未检出蛋白质,溶液基本稳定,适合疏血通注射液临床配伍使用。
在不溶性微粒检查中,疏血通注射液与5%葡萄糖注射液配伍后不溶性微粒稳定,符合《中国药典》要求;疏血通注射液与0.9%氯化钠注射液配伍后不溶性微粒2 h内呈不稳定状态,其中,配伍规格越大,不稳定的时间相应缩短。中药注射剂中成分复杂,有一些物质例如鞣质、皂苷等可能在配伍过程中由于氯化钠注射液的盐析作用而析出[7],导致不溶性微粒增多。报道中也提及疏血通注射液与0.9%氯化钠注射液配伍后溶液变浑浊的情况,也有报道说明疏血通注射液中分子量大于5 800的物质少于1%,但其不良反应的发生可能与此残留的少量高分子蛋白等刺激机体有关[8]。考虑到临床用药安全,笔者建议在临床使用中,尽量选用5%葡萄糖注射液作为溶媒,若选用0.9%氯化钠注射液,应配伍大规格,并细心观察配伍后溶液的澄清情况再进行使用。
在次黄嘌呤含量测定中,疏血通注射液与0.9%氯化钠注射液配伍后次黄嘌呤含量2 h内稳定,2 h后随时间呈缓慢降解趋势;疏血通注射液与5%葡萄糖注射液配伍后次黄嘌呤含量8 h整体稳定。综合其他实验研究结果[9-11],0.9%氯化钠注射液、5%葡萄糖注射液可用于疏血通注射液临床配伍。但在临床使用中,为保证药效,应即配即用。
| [1] |
郭伦, 崔瑛, 杨亚蕾, 等. 疏血通注射液的临床应用研究进展[J]. 中国现代药物应用, 2015, 9(1): 240-241. |
| [2] |
石浩强, 许倍铭, 葛覃. 从溶媒的选择谈安全使用中药注射剂[J]. 中国药房, 2013, 23(43): 4125-4126. |
| [3] |
韦曦, 吕超智, 杨荔, 等. 中药注射剂与输液配伍的不溶性微粒变化[J]. 中国中药杂志, 2007(14): 1477-1480. DOI:10.3321/j.issn:1001-5302.2007.14.028 |
| [4] |
李辉, 徐雨佳, 陈碧, 等. 某院中药注射剂临床合理使用干预的评价[J]. 中南药学, 2011, 9(4): 310-313. DOI:10.3969/j.issn.1672-2981.2011.04.020 |
| [5] |
中国药典[S].2015年版.第四部.4, 77-79, 111-114, 225.
|
| [6] |
陈园, 裴光明. 醒脑静注射液配伍不同稀释液后不溶性微粒的对比观察[J]. 湖北中医杂志, 2016, 38(3): 72-74. |
| [7] |
程正平, 万长秀, 吕霞, 等. 10种常用中药注射剂输液配伍后的稳定性研究[J]. 湖北中医药大学学报, 2013, 15(3): 26-29. DOI:10.3969/j.issn.1008-987x.2013.03.09 |
| [8] |
孔飞飞, 谭兴起, 郭良君, 等. 疏血通注射液的不良反应分析[J]. 中国新药杂志, 2011, 20(11): 1046-1050. |
| [9] |
余驰, 佘瑶瑶, 李莎, 等. 疏血通注射液与5种溶媒配伍的稳定性研究[J]. 中国药师, 2018, 21(7): 1318-1321. DOI:10.3969/j.issn.1008-049X.2018.07.054 |
| [10] |
严叶霞. 疏血通注射液与4种溶媒配伍稳定性考察[J]. 中国药师, 2013, 16(7): 1084-1085. DOI:10.3969/j.issn.1008-049X.2013.07.063 |
| [11] |
陶箭飞, 尉迟敏, 朱巍淑, 等. 疏血通注射液与4种常用输液的配伍稳定性考察[J]. 上海医药, 2012, 33(21): 21-22. |
 2019, Vol. 38
2019, Vol. 38