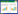文章信息
- 艾望, 周珍, 王秀萍, 张曼玲, 杨海涛, 张莹雯
- AI Wang, ZHOU Zhen, WANG Xiuping, ZHANG Manling, YANG Haitao, ZHANG Yingwen
- 抑癌扶正平衡Ⅱ号方对乳腺癌小鼠移植瘤生长转移的实验研究
- Experimental research on growth and metastasis of transplanted tumor in mice with breast cancer treated with Yi'ai Fuzheng No. Ⅱ Recipe
- 天津中医药大学学报, 2019, 38(4): 378-382
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(4): 378-382
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.04.16
-
文章历史
收稿日期: 2019-02-18
2. 湖北中医药大学, 武汉 430065
2. Hubei University of Traditional Chinese Medicine, Wuhan 430065, China
乳腺癌是全球女性最常见的恶性肿瘤之一,每年有超过100万新发病例[1-2]。中国女性乳腺癌发病率为42.55/10万,平均增长率高于欧美国家1~2个百分点,是45岁以下女性死亡的主要原因[3-4]。目前乳腺癌的治疗方法主要包括手术、化疗、放疗、靶向治疗、内分泌治疗、生物治疗等,单一治疗手段存在诸多不足,多种方法联用的综合治疗是临床治疗乳腺癌的主要模式。中医药为治疗乳腺癌术后并发症、解决化疗耐药、减轻放化疗及内分泌治疗的副不良反应、增加乳腺癌生物治疗的有效性等方面提供了许多新的思路,同时中医药自身多途径、多靶点的抗癌作用亦不容忽视[5]。
湖北中医名师、湖北省中西医结合学会肿瘤专业委员会主任委员张莹雯教授认为肿瘤疾病通常全身为虚,局部为实,积极调治脏腑平衡虚实,为治癌的根本,在抑杀癌细胞的同时,注重扶助正气,保护机体正常功能[6]。针对乳腺癌“虚”“毒”“痰”“瘀”的病理特点,张教授在治疗上倡导以“抑癌解毒和扶正补虚”为基本原则,并依据三十余年临床经验总结出“抑癌扶正平衡Ⅱ号方”,已作为协定处方应用于中晚期乳腺癌患者,取得了较好的临床疗效。
硫酸乙酰肝素蛋白聚糖(HSPG)是由哺乳动物细胞分泌的一种重要的蛋白聚糖家族,其化学结构由一个核心蛋白(core protein)和一个或多个硫酸化的葡糖胺聚糖链(GAG)-硫酸乙酰肝素链(HS)共价结合而成[7]。HSPG参与构成肿瘤细胞外基质(ECM)和基底膜(BM),在肿瘤的增殖转移中发挥着重要作用[8]。本研究拟通过体内实验,观察抑癌扶正平衡Ⅱ号方对乳腺癌小鼠移植瘤、转移瘤的影响,明确其剂量与抑瘤效果的关系,并探索其抗肿瘤作用与HSPG表达的相关性。
1 材料与方法 1.1 实验材料 1.1.1 受试药物抑癌扶正平衡Ⅱ号方由茯苓、黄芪、伸筋草、丝瓜络、昆布、浙贝母、白花蛇舌草、开口箭、三棱、水蛭、郁金、夏枯草、莪术、红藤、蒲公英、皂荚刺等16味中药构成,购于武汉大学中南医院中药房。
1.1.2 实验动物及瘤株BALB/C小鼠60只,雌性,6~8周龄,(20±2) g,SPF级,购于北京维通利华实验动物技术有限公司,许可证号:SCXK2016-0006。4T1高转移小鼠乳腺癌细胞株,由武汉大学肿瘤病理实验中心赠送。
1.1.3 主要实验试剂及仪器胎牛血清(Gibco公司)、DMEM(Hyclone公司)、0.25%胰蛋白酶(bioswamp公司)、酶联免疫分析(ELISA)试剂盒(武汉基因美生物科技有限公司)、超净工作台(苏州金净净化设备公司)、倒置显微镜(Nikon公司)、酶标仪(LabsystemsMultiskan MS公司)、洗板机(ThermoLabsystems公司)。
1.2 实验方法 1.2.1 造模及分组随机选取10只小鼠不作处理作为空白组。于含10%胎牛血清的DMEM高糖培养液中体外培养4T1小鼠乳腺癌细胞,取对数生长期细胞制备1×106/mL细胞悬液,每只小鼠乳垫下注射50 μL(5×104个细胞)。注射7 d后成瘤率100%,选择接种均一的小鼠纳入实验,随机分为5组:模型组、低分子肝素组、中药(高、中、低剂量)组,每组各10只。
1.2.2 给药方法造模成功后次日开始给药,中药高、中、低剂量组分别按浓度为1.5、3、6 g/mL灌胃,空白组及模型组给予生理盐水灌胃,各组灌胃剂量均为0.1 mL/10 g,每日1次。低分子肝素组给予低分子肝素皮下注射(1 500 U/Kg),每日1次。连续给药14 d后处死取材。
1.3 观察指标 1.3.1 瘤质量及瘤质量抑制率给药完毕后,断颈处死小鼠,完整剥离接种处瘤块,称瘤质量,瘤质量抑制率(%)=(模型组平均瘤质量-实验组平均瘤质量)/模型组平均瘤质量×100%。
1.3.2 肺转移结节数及肺转移抑制率取出肺脏,将肺组织固定于4%的多聚甲醛,48 h后在显微镜下观察肺组织表面灰白色结节数目,肺转移抑制率(%)=(模型组平均肺表面转移结节数-治疗组平均肺表面转移结节数)/模型组平均肺转移结节数×100%。
1.3.3 检测移植瘤、转移瘤、血清中HSPG的表达眼球取血后自然凝固10~20 min,离心留存血清,同时将移植瘤、转移瘤组织切块并充分匀浆后离心吸取上清,低温冷冻保存标本。临用时复温,按ELISA试剂盒说明书操作,以标准物的浓度为横坐标,OD值为纵坐标,绘制标准曲线。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL。加入酶标试剂50 μL,用封板膜封板后置37 ℃温育30 min。小心揭掉封板膜,洗涤液重复洗涤5次,拍干。每孔先加入50 μL显色剂A,再加入50 μL显色剂B,轻轻震荡混匀,37 ℃避光显色10 min。加入终止显色液终止反应。到酶标仪进行读板,读取450 nm波长处的OD值。
1.4 统计学方法采用SPSS 20.0统计分析,计量资料以均数±标准差(x±s)表示,多组间比较用单因素方差分析,组间两两比较采用LSD法,P < 0.05为差异有统计学意义。
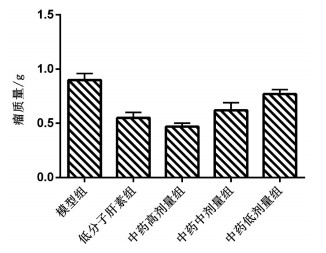
2 实验结果 2.1 各组小鼠移植瘤质量及瘤质量抑制率空白组小鼠均未见瘤块;各给药组小鼠瘤质量均明显低于模型组(P < 0.05);中药各组瘤质量随中药剂量增高而下降,中药高剂量组瘤质量低于低分子肝素组(P < 0.05),见图 1。低分子肝素组的瘤质量抑制率为38.89%,中药高、中、低剂量组瘤质量抑制率分别为47.78%,31.11%和14.44%。
|
| 图 1 各组小鼠移植瘤质量的比较 |
空白组小鼠肺部均未见结节;中药低剂量组肺转移结节数与模型组无明显差异(P>0.05),其余给药组肺转移结节数均明显低于模型组(P < 0.05);中药各组肺转移结节数随中药剂量增高而下降(P < 0.05);中药高剂量组肺转移抑制率高于低分子肝素组。见表 2。
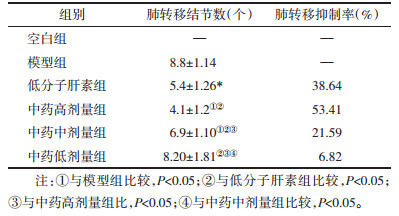
各给药组移植瘤中HSPG表达水平均高于模型组(P < 0.05);中药各组移植瘤中HSPG表达水平随中药剂量增高而上升,组间比较差异均有统计学意义(P < 0.05);中药高剂量组移植瘤中HSPG表达水平高于低分子肝素组(P < 0.05)。
中药低剂量组转移瘤中HSPG表达水平与模型组无明显差异(P>0.05),其余给药组转移瘤中HSPG表达水平均明显低于模型组(P < 0.05);中药各组转移瘤中HSPG表达水平随中药剂量增高而上升,组间比较差异均有意义(P < 0.05);中药高剂量组转移瘤中HSPG表达水平高于低分子肝素组(P < 0.05)。
与空白组相比,余各组血清中HSPG表达均明显下降(P < 0.05);中药低剂量组血清中HSPG表达水平与模型组无明显差异(P>0.05),其余给药组血清中HSPG表达水平均明显低于模型组(P < 0.05);中药各组血清中HSPG表达水平随中药剂量增高而上升,组间比较差异均有意义(P < 0.05);中药高剂量组血清中HSPG表达水平高于低分子肝素组(P < 0.05)。见表 3。
乳腺癌在中医古籍中有“乳岩”“石痈”“石奶”“乳疳”等记载,抑癌扶正平衡Ⅱ号方中黄芪益气托毒、扶正固本,开口箭清热解毒、抑癌散结,二者扶正祛邪,共为君药。夏枯草、蒲公英、红藤、白花蛇舌草清热解毒、散结消肿以治热;浙贝母、昆布、丝瓜络清热化痰、软坚散结以治痰;三棱、莪术、水蛭、郁金破血行气、散瘀消结以治瘀,诸药合用,抑癌消瘤,共为臣药。茯苓健脾和胃、利水渗湿,伸筋草祛风活络、下气消积,共为佐药。皂荚刺祛风通络、消肿排脓以引药直达病所,为使药。全方共奏益气扶正,解毒散结之效[9-11]。
HSPG在小脑、骨髓、心肌、乳腺、前列腺等器官和脂肪组织以及软组织中均有较高表达,可以通过结合生长因子、趋化因子、成形素、基质蛋白、细胞粘附分子和蛋白酶等蛋白配体发挥调节细胞增殖、迁移和黏附的功能[12]。一方面,Hpa降解作为基底膜主要成分的HS分子时,ECM和BM的完整性被破坏,为肿瘤细胞穿越屏障,实现浸润、扩散及转移打开通道,也为血管内皮细胞迁移,血管生成提供了条件。另一方面,细胞外基质生长因子如FGF、VEGF、PDGF等大量释放,刺激肿瘤细胞增殖和迁移;并且由于Hpa过度切割改变了HS的微细结构,促进HS与生长因子结合,进一步激活细胞表面酪氨酸激酶受体,级联放大生长因子效应而促进肿瘤的增殖和肿瘤新生血管的形成[13-14]。
本研究发现,与模型组比较,中药各剂量组的瘤质量及肺转移结节数降低,其中高剂量中药组抑制瘤体增殖和肺转移的疗效均优于西药低分子肝素组,表明抑癌扶正平衡Ⅱ号方可抑制乳腺癌小鼠移植瘤的增殖和肺转移,且随着中药剂量增高作用增强。与模型组比较,中药各剂量组移植瘤、转移瘤、血清中HSPG的表达增高,其中高剂量中药组移植瘤、转移瘤、血清中HSPG的表达高于西药低分子肝素组,表明抑癌扶正平衡Ⅱ号方的抑瘤作用与HSPG的表达增高有关。
近年来,低分子肝素的抗肿瘤增殖转移作用成为研究热点,主要机制可能包括为:1)影响免疫系统,激活NK细胞。2)抑制肿瘤细胞在纤维连结蛋白和层粘连蛋白基质上的黏附和迁移。3)抑制肿瘤细胞与毛细血管壁的黏附。4)抑制肿瘤组织血管生成。5)抑制肿瘤细胞的耐药性。6)能修饰癌基因表达,诱导程序性细胞凋亡或分化[15-16]。Alam等[17]对乳腺癌小鼠模型研究发现,低分子肝素可通过抑制TGF-b1和CXCL12的生成从而抑制乳腺肿瘤细胞的转移。已有研究发现,低分子肝素抑制乳腺癌增殖转移的机制可能是通过与Hpa竞争HS受体,减少了HS的降解,增加HSPG的水平,从而保证了ECM的完整性[18-19]。本研究中高剂量中药组移植瘤、转移瘤、血清中HSPG的表达均高于低分子肝素组,提示抑癌扶正平衡Ⅱ号方可能作为一种外源性HSPG结构类似物,通过竞争性与Hpa反应,减少Hpa对HS链的降解,进而抑制了乳腺癌的增殖转移,这可能与方中含有多糖蛋白成分的黄芪、茯苓、昆布、开口箭等中药的作用相关,但其具体作用机制还需进一步深入探索。
| [1] |
王舒蓓, 陈佳艺, 许赪. 放疗与药物联合治疗乳腺癌的研究进展[J]. 中国癌症防治杂志, 2018, 10(3): 167-171. DOI:10.3969/j.issn.1674-5671.2018.03.01 |
| [2] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [3] |
李京, 林一帆, 徐莹, 等. 中医药治疗乳腺癌的临床研究进展[J]. 辽宁中医杂志, 2017, 44(9): 1994-1997. |
| [4] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [5] |
周思颖, 张思杰, 徐寒子, 等. 中医药治疗乳腺癌进展[J]. 中国中医基础医学杂志, 2017, 23(10): 1489-1492. |
| [6] |
彭艳芳, 张莹雯, 叶太生, 等. 张莹雯教授诊治肿瘤的学术思想初探[J]. 世界中医药, 2017(11): 2720-2723. DOI:10.3969/j.issn.1673-7202.2017.11.039 |
| [7] |
方琳, 谢强, 程秀, 等. 硫酸乙酰肝素蛋白聚糖对C_3H小鼠乳腺癌移植瘤癌基因表达的影响[J]. 实用医学杂志, 2012, 28(21): 3531-3533. DOI:10.3969/j.issn.1006-5725.2012.21.012 |
| [8] |
张怡, 张甘霖, 孙旭, 等. 硫酸乙酰肝素、肝素酶及其与肿瘤转移的关系[J]. 现代生物医学进展, 2018, 18(1): 190-194. |
| [9] |
王春晖, 裴晓华, 孙艳丽. 乳腺癌的古今中医认识及治疗研究概况[J]. 世界中西医结合杂志, 2016(9): 1323-1325. |
| [10] |
侯公楷. 中医药防治乳腺癌进展[J]. 辽宁中医药大学学报, 2016, 18(05): 249-253. |
| [11] |
郭艳静, 刘丽芳. 中医中药治疗乳腺癌临床研究进展[J]. 中华中医药学刊, 2012(8): 1774-1777. |
| [12] |
纪青, 常青. 硫酸乙酰肝素蛋白聚糖在胶质母细胞瘤肿瘤微环境中的作用研究进展[J]. 转化医学电子杂志, 2017, 4(7): 1-6. DOI:10.3969/j.issn.2095-6894.2017.07.001 |
| [13] |
Cole CL, Rushton G, Jayson GC, et al. Ovarian cancer cell heparan sulfate 6-O-sulfotransferases regulate an angiogenic program induced by heparin-binding epidermal growth factor (EGF)-like growth factor/EGF receptor signaling[J]. Journal of Biological Chemistry, 2014, 289(15): 10488-10501. DOI:10.1074/jbc.M113.534263 |
| [14] |
Gomes AM, Stelling MP, Pavao MS. Heparan sulfate and heparanase as modulators of breast cancer progression[J]. Biomed Research International, 2013, 2013: 852093. |
| [15] |
刘晋仙, 李玮涛, 张在忠, 等. 低分子肝素药理学机制及适应证研究进展[J]. 药学研究, 2015, 34(7): 420-421. |
| [16] |
王宇, 黄礼年. 低分子肝素在恶性肿瘤患者中的应用进展[J]. 癌症进展, 2018, 16(2): 150-154. |
| [17] |
Alam F, Al-Hilal TA, Park J, et al. Multi-stage inhibition in breast cancer metastasis by orally active triple conjugate, LHTD4(low molecular weight heparin-taurocholate-tetrameric deoxycholate)[J]. Biomaterials, 2016, 86: 56-67. DOI:10.1016/j.biomaterials.2016.01.058 |
| [18] |
胡丹凤, 黄礼年. 低分子肝素在抗恶性肿瘤中的应用进展[J]. 中华全科医学, 2010(3): 353-354. |
| [19] |
王鹏, 庞新. 低分子肝素对人乳腺癌细胞增殖抑制作用及其机制研究[J]. 中国医药导刊, 2013(S1): 175-176. |
 2019, Vol. 38
2019, Vol. 38