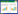文章信息
- 李裴裴, 彭金霞
- LI Peipei, PENG Jinxia
- 红花黄色素对缺血性脑室周围白质软化新生鼠脑保护作用及机制研究
- Protective effect of safflower yellow pigment on periventricular leukomalacia of ischemic rats and its mechanism
- 天津中医药大学学报, 2019, 38(4): 383-387
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(4): 383-387
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.04.17
-
文章历史
收稿日期: 2019-03-05
2. 湖北医药学院附属人民医院烧伤整形科, 十堰 442000
2. Department of Burn and plastic surgery, people's Hospital affiliated to Hubei Medical College, Shiyan 442000, China
脑室周围白质软化(PVL)属于早产儿脑损伤中较常见的一种类型,也是早产儿发生死亡或发育出现障碍的主要原因[1]。研究证实[2],少突胶质细胞(OL)及其前体在早产儿PVL发病中起着非常关键的作用。早产儿脑白质对因缺血缺氧导致的损伤非常敏感,是早产儿发生PVL的重要原因,而氧化应激、相关凋亡蛋白表达水平变化在损伤及PVL形成中起着诱导的作用。迄今,PVL的治疗仍无有效的方法,红花黄色素是红花花瓣中提取的一种天然黄色素,有研究表明[3],其对抗血栓、降血脂、抗动脉粥样硬化、扩张冠状动脉方面效果显著;也有研究显示,其在大鼠脑缺血性疾病的治疗中有一定的保护作用。但其在新生鼠脑损伤的影响研究较少,特别是对新生鼠脑室周围白质软化的作用及机制研究更少,因此,本研究以新生7日鼠为实验对象,探讨其对PVL新生鼠的脑保护作用及其机制。
1 材料和方法 1.1 动物及分组新生7日龄SD大鼠60只,清洁级,性别无要求,体质量12~17 g,由上海西普尔动物有限公司提供,许可证:SCXK(沪2013-0002),新生鼠均在室温下母鼠喂养,湿度为60%~70%。将新生鼠根据数字表法进行分组:假手术组、模型组、阳性对照组、红花组各15只。
1.2 仪器及试药倒置相差显微镜(日本Olympus公司,型号:CX41-12C02);全波长酶标仪、垂直电泳仪由Bio-Rad公司提供;石蜡切片机、包埋机(德国Leica公司提供)。恒温冰冻切片机由德国Lecia公司提供。O4单抗体、髓鞘碱性蛋白(MBP)单抗体、缝隙连接蛋白(Cx47)、巢蛋白(Nestin)试剂盒由北京博奥森生物公司提供;山羊抗兔IgG由上海基金科技公司提供;SABC免疫组化试剂盒由北京中杉公司提供;谷胱甘肽过氧化酶(GPx)、超氧化物歧化酶(SOD)、丙二醛(MDA)及过氧化物酶(CAT)由南京建成生物公司提供。
1.3 PVL(缺血型)模型制备及用药新生大鼠称质量后用乙醚进行麻醉,取仰卧位固定,颈部皮肤消毒(75%乙醇),切口沿正中线皮肤,结扎(6.0号线)双侧颈总动脉,皮肤缝合后涂抹火棉胶后,放在母鼠身边恢复至麻醉苏醒2 h,再放置于湿度70%左右、温度37 ℃的恒温常压缺氧箱中,并注入混合气体(92%N2和8%O2,流量1~2.5 L/min)缺氧30 min,然后将动物放回母鼠的身边。假手术组游离两侧颈总动脉后不结扎直接进行缝合,不给予缺氧、用药处理;其他组均建造新生鼠PVL模型,阳性对照组造模成功后立即给予重组促红细胞生成素(rEPO)5 000 U/kg,红花组造模成功后立即给予红花黄色素3 mg/kg,模型组不给予用药处理。48 h后处死新生鼠,完整取出脑组织由4%多聚甲醛固定待用。
1.4 病理检测脑组织标本将视交叉与乳头体的中部作为切面进行脑冠状切片,其厚度3~4 mm,用石蜡包埋切片后,苏木精-伊红(HE)染色,在光镜下进行脑室周围白质病理评估。根据Chen N[4]的评分标准,对白质损伤进行评价:正常为0度;神经纤维表现轻度异常(排列不整齐),白质表现轻度疏松,为Ⅰ度;神经纤维表现重度异常,形成凝固性坏死及囊腔,排列不整齐,白质表现严重疏松,为Ⅱ度。
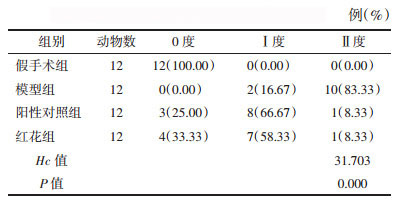
1.5 免疫组化法常规制作免疫组化法分析标本,将O4、MBP、Cx47、Nestin单抗工作液浓度均为1:100,将磷酸盐缓冲液(PBS)作为阴性对照。倒置显微镜(Olympus)下进行观察,Image-Pro Plus 5.0软件对图像进行分析。同一部位(脑室周围)随机抽取5个视野(200倍镜下观察),计算IOD值。
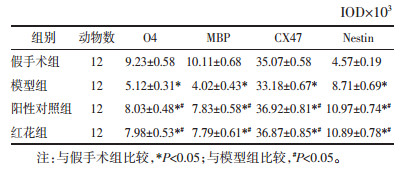
1.6 脑组织抗氧化、氧化物质检测大鼠处死后迅速将脑组织取出,以视交叉与乳头体的中部作为切片进行冠状切片,将其称质量后以1:10的体积比例加入匀浆液,匀浆后,根据标准试剂盒中的说明书进行操作,用分光光度法对SOD、CAT、GSH-Px、MDA及GSH的含量进行检测。
1.7 细胞相关凋亡蛋白检测使用免疫印迹法对细胞凋亡相关蛋白Bax、Bcl-2、Caspase-9及Caspase3活化片段进行检测。提取组织蛋白质后,用二喹啉甲酸(BCA)对总蛋白量进行测定,根据标准曲线法对蛋白浓度进行计算,经蛋白质聚丙烯酰胺凝胶电泳,凝胶湿法转膜,分别用兔抗鼠Bax、Bcl-2、Caspase-9及Caspase3多抗(1:1 000)孵育并过夜,然后与山羊抗兔IgG(浓度为1:5 000)反应,用增加化学发光进行显色,在X线片下曝光显影。图像处理仪作灰度扫描分析。以β-Tublin为内参。
1.7 统计学分析采用SPSS 20.0软件进行分析。计量资料表示用均数±标准差(x±s),多组间比较用单因素方差分析,两两比较用q检验;等级资料用秩和检验,两两比较用秩和检验的Nemenyi法,以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠脑白质损伤病理情况各组大鼠造模过程中及造模48 h内均无死亡,在用药48 h后进行脑病理检测,结果显示,假手术组大鼠未发现病理改变(神经纤维走向整齐,排列致密),模型组大鼠脑室周围白质及脑皮质下病理均明显改变,组织疏松坏死,结构模糊,神经纤维呈网状或条索状,走向紊乱,部分可见有囊性空洞;阳性对照组及红花组大鼠脑损伤情况与模型组比较,神经纤维排列紊乱情况及白质疏松情况均有明显好转,可见部分白质结构趋于正常。见图 1。阳性对照组、红花组脑白质整体损伤程度明显轻于模型组(P < 0.05)。见表 1。
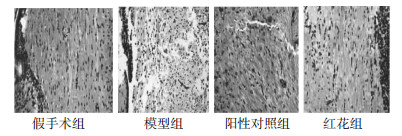
|
| 图 1 各组大鼠脑白质损伤病理情况(HE×200) |
模型组大鼠O4(标记OL前体细胞)、MBP(标记成熟OL细胞)、CX47阳性细胞数明显低于假手术组,Nestin阳性细胞数明显高于假手术组(均达到P < 0.05);与模型组比较,阳性对照组、红花组O4、MBP、CX47及Nestin阳性细胞数均明显升高,差异有统计学意义(P < 0.05);红花组各项指标与阳性对照组比较,差异无统计学意义(P>0.05),见表 2、图 2。
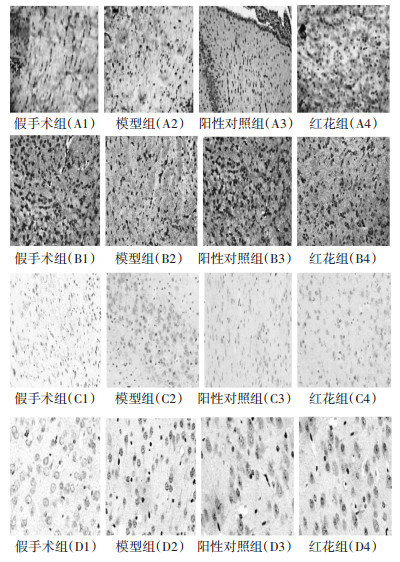
|
| A1~A4为O4阳性标记物图片,深棕色示为O4阳性OL的前体;B1~ B4为MBP阳性标记物图片,深棕色示为MBP阳性成熟的OL;C1~ C4为白质CX47阳性表达,细胞浆阳性细胞呈现棕黄色;D1~D4为白质nestin阳性表达,细胞胞浆及突起阳性细胞呈黄色 图 2 各组大鼠免疫组化图片(×200) |
模型组大鼠GPx、SOD、CAT及GSH水平明显低于假手术组,MDA水平明显高于假手术组(均达到P < 0.05);与模型组比较,阳性对照组、红花组GPx、SOD、CAT及GSH水平均明显升高,MDA水平明显降低(均达到P < 0.05);红花组各项指标与阳性对照组比较,差异无统计学意义(P>0.05),见表 3。
与假手术组比较,模型组Bax表达明显升高,Bcl-2表达明显降低,Caspase-9及Caspase-3激活均明显增加(P < 0.05)。与模型组比较,阳性对照组及红花组Bax表达明显降低,Bcl2表达明显升高,Cleaved Caspase-9及Cleaved Caspase-3激活均明显降低(P < 0.05)。见图 3、图 4。
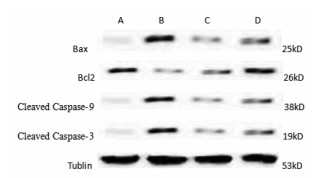
|
| A为假手术组,B为模型组,C为阳性对照组,D为红花组 图 3 各组相关凋亡因子表达情况 |
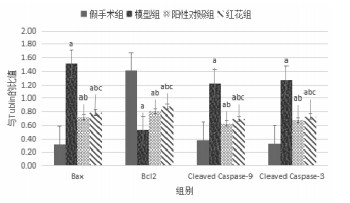
|
| 与假手术组比较,aP < 0.05;与模型组比较,bP < 0.05;与阳性对照组比较,cP>0.05 图 4 各组相关凋亡因子表达情况 |
研究证实[5-6],PVL是早产儿发生认识障碍或脑瘫的主要原因之一。对PVL的治疗目前仍无特有效的方法。红花为临床上常用的活血化瘀性药物,其中主要成分包括黄酮醇类及查尔酮类,红花黄色素则为查尔酮类的有效部位群,是红花中有效成分(具有水溶性)的混合物,具有较强的抗氧化活性。研究证实,其抗氧化性与其分子中有多个酚羟基有关。多年来,其在抗动脉粥样硬化、抗血栓、降血脂的治疗中广泛应用。廖金明[7]的研究显示,其能够清除体内自由基,阻滞脂质发生过氧化反应,从而发挥活血化瘀作用。欧芹[8]对衰老模型小鼠的脑细胞凋亡因子进行研究,结果发现,红花黄色素使脑细胞凋亡率明显降低。但这些研究均局限于对成人的研究,其对新生儿脑缺血缺氧损伤的保护作用研究临床上还很少,对其作用机制尚不清楚,由此,设计本研究对临床新生儿脑缺血性疾病的治疗意义重大。
OL前体是引起脑白质损伤的重要靶细胞,常用O4标记OL前体,用MBP标记成熟的OL细胞;CX47则为缝隙连接蛋白的一种,特定性地表达于少突胶质细胞,并与髓鞘基因有平行调节作用,当CX47敲除后髓鞘化则无法正常进行;Nestin为中间丝蛋白的一种,正常情况下,成熟脑组织中的Nestin表达较少,当脑组织缺血缺氧时,其能够促进中枢神经细胞再生及神经细胞原位增殖;同样,正常脑白质区,nestin表达水平也很低,但出现损伤后则其表达有明显升高,以促进神经干细胞再生[9]。本研究用石蜡病理切片、MBP、O4、CX47及Nestin表达对脑白质损伤情况进行评估,结果显示,7日新生鼠在双侧颈总动脉结扎、缺氧处理后均能导致脑白质广泛损伤,表现神经纤维紊乱排列、白质出现疏松,大量MBP、O4阳性OLs丢失,CX47表达降低,Nestin表达升高,由此证实缺血缺氧导致大鼠脑白质发生损伤,证实造模是成功的。但与模型组比较,阳性对照组、红花组MBP、O4阳性细胞数均有明显升高,CX47、Nestin阳性表达有明显升高,由此说明,rEPO(在新生儿缺血缺氧脑病中应用广泛,具有明显的神经保护作用,能够改善患儿近期及远期的神经系统症状及认知功能[9])及红花黄色素均能改善脑白质损伤状况,对脑白质损伤有一定的保护作用。但本研究只探讨了红花黄色素对缺血缺氧新生鼠脑白质损伤的短期保护作用,其对新生鼠缺血缺氧脑损伤是否有长期的效果及能否改善新生鼠缺血缺氧导致的行为缺陷,有待下一步进行研究。
研究证实[10],缺血缺氧导致的白质损伤与体内的氧化应激关系密切。本研究结果显示,新生鼠缺血缺氧后脑组织中的GPx、CAT、GSH水平明显降低,而MDA水平明显升高,提示脑缺血缺氧导致一系列活性氧簇(ROS)产生过多,从而引起氧化应激反应。而使用红花黄色素及rEPO的红花组及阳性对照组均能降低MDA水平,升高GPx、CAT、GSH水平,由此提示,红花黄色素能够减少脑缺血缺氧后发生氧化应激损伤,对缺血缺氧脑白质有保护作用。此结果与廖金明[11]的研究一致。本研究还对细胞凋亡相关蛋白Bax、Bcl-2、Caspase-9及Caspase3活化片段进行研究,结果显示,红花黄色素能够抑制Caspase-9及Caspase3活化,并抑制Bax蛋白表达,同时提高Bcl-2表达,由此提示,红花黄色素对缺血缺氧导致的脑白质损伤的保护作用可能与调节细胞凋亡相关因子的表达有关。
综上所述,红花黄色素对新生鼠缺血性脑室周围白质软化有保护作用,其作用机制不仅与调节抗氧化系统有关,还与调节细胞凋亡相关因子有关。
| [1] |
李清香, 曹云涛.Apelin-36对新生鼠脑室周围白质软化模型脑白质MBP和NG2表达影响[D].遵义: 遵义医学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10661-1016760813.htm
|
| [2] |
刘明华, 韦红. 早产儿脑室周围白质软化发病机制的研究进展[J]. 儿科药学杂志, 2011, 17(1): 57-59. |
| [3] |
邱莉.红花黄色素对新生大鼠缺氧缺血性脑病的保护作用[D].福州: 福建医科大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10392-2009150272.htm
|
| [4] |
Chen N, Wang J, Jiang Y, et al. Different mutations of Gap junction connexin 47 lead to discrepant activation of unfolded protein response pathway in pelizaeus-merzbacher-like disease[J]. Neuropediatrics, 2017, 48(6): 426-431. DOI:10.1055/s-0037-1603978 |
| [5] |
全梅, 熊曼, 胡勇, 等. 缺氧缺血未成熟新生鼠脑少突胶质细胞髓鞘化障碍致脑白质损伤的作用[J]. 中华实用儿科临床杂志, 2012, 27(22): 1740-1744. DOI:10.3969/j.issn.1003-515X.2012.22.014 |
| [6] |
蔡岳鞠, 宋燕燕, 刘青, 等. 促红细胞生成素对3日龄脑白质损伤新生大鼠髓鞘碱性蛋白和神经行为学的影响[J]. 中国新生儿科杂志, 2013, 28(4): 264-265. DOI:10.3969/j.issn.1673-6710.2013.04.013 |
| [7] |
廖金明, 余梦黎, 秦莎莎, 等. 羟基红花黄色素A、芍药苷单用及联合对脑缺血再灌注损伤大鼠脑组织NF-κB及炎性因子的影响[J]. 中药药理与临床, 2018, 34(3): 51-52. |
| [8] |
欧芹, 魏晓东, 张鹏霞, 等. 红花黄色素对衰老模型小鼠脑细胞凋亡的影响[J]. 中国康复医学杂志, 2006, 21(6): 504-505. DOI:10.3969/j.issn.1001-1242.2006.06.004 |
| [9] |
李宇阳, 李玖军. 促红细胞生成素对早产儿脑损伤神经行为的影响[J]. 中国小儿急救医学, 2011, 18(1): 47-49. |
| [10] |
何菊芳, 李婷婷, 孙晓运, 等. 氧化应激及炎性反应与缺血性脑卒中的关系[J]. 武警医学, 2016, 27(12): 1234-1236. DOI:10.3969/j.issn.1004-3594.2016.12.014 |
| [11] |
廖金明, 余梦黎, 秦莎莎, 等. 羟基红花黄色素A、芍药苷单用及联合对脑缺血再灌注损伤大鼠脑组织NF-kB及炎性因子的影响[J]. 中药药理与临床, 2018, 34(3): 51-52. |
 2019, Vol. 38
2019, Vol. 38