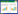文章信息
- 韩婷婷, 任晓亮, 任德飞, 王萌
- HAN Tingting, REN Xiaoliang, REN Defei, WANG Meng
- 荷叶中荷叶碱的浸提动力学模型研究
- Study on extraction kinetics model of lotus leaf alkali from lotus leaf
- 天津中医药大学学报, 2019, 38(4): 400-405
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(4): 400-405
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.04.20
-
文章历史
收稿日期: 2019-03-10
2. 天津中医药大学中医药研究院, 天津 301617
2. Institute of Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
荷叶(Nelumbins Folium)系睡莲科莲属植物莲Nelumbo nucifera Gaertn的干燥叶[1],味苦涩,性平,有清热解暑,升发清阳,凉血止血的功效,用于暑热烦渴,暑湿泄泻、脾虚泄泻,热血吐衄,便血崩漏等[2]。中国自古以来就把荷叶奉为瘦身的良品。其被卫生部批准为“可用于保健食品的药品”[3]。目前为止,从荷叶中已经鉴定出十五种生物碱,为荷叶碱、亚美罂粟碱、原荷叶碱、N-去甲基荷叶碱、番荔枝碱等,其中荷叶碱为中药荷叶中的主要药效活性成分[4-9]。荷叶碱(nuciferine)是一种阿朴啡型生物碱,现代药理实验证明荷叶碱具有明显的降脂、平衡胆固醇导物、较强的抑制细菌和霉菌等以及在体外显著的抗脊髓灰质炎病毒等活性[9-12]。目前有大量文献记载了如何高效提取荷叶碱的方法,然而却很少有从理论的角度出发研究其提取规律或者提取条件与提取量的关系变化。因此,本实验选取温度、溶剂种类及溶剂量作为考察内容,基于Fick第一定律建立动力学模型,对荷叶浸提动力学过程进行拟合,以期从理论上研究各因素与有效成分浓度之间的关系,并提高有效成分提取率。
1 材料超高效相色谱仪(Waters ACQUITY UPLCTM,美国Waters公司);高效液相色谱仪(Shimadzu LC-20AT,日本Shimadzu公司);实验室超纯水仪(Milli-Q Academic,美国Millipore公司);台式高速离心机(TG16-WS,长沙湘仪离心机仪器有限公司);电动搅拌器(S312-90,山海申生科技有限公司);pH计(PB-10,德国Sartorius公司);十万分之一天平(BT125D,德国Sartorius公司);电子天平(JA31002,上海精天电子仪器有限公司);超声波清洗器(KH3200B,昆山禾创超声仪器有限公司);数显恒温水浴锅(HH-s8,金坛盛蓝仪器制造有限公司);药典筛(2,4,5,6,7号筛,浙江上虞市五星冲压筛具厂)。
荷叶碱(中国药品生物制品检定所,批号111566-2000703,含量99.7%);荷叶(山东,鉴定专家:天津中医药大学,李天祥教授);乙腈(美国sigma公司,色谱纯);乙醇(天津市康科德科技有限公司,分析纯);甲酸(天津化学试剂批发公司,色谱纯);冰乙酸(天津市康科德技术有限公司,色谱纯);三乙胺(天津市元立化工有限公司,色谱纯);蒸馏水,屈臣氏集团有限公司。
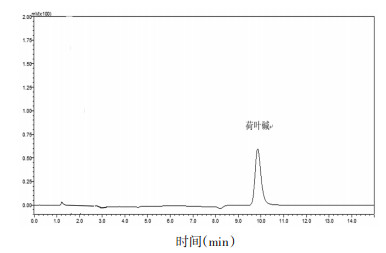
2 方法与结果 2.1 色谱条件及方法学考察 2.1.1 色谱条件色谱柱:Waters SymmetryTM C18(150×3.9 mm,5 μm);流动相:乙腈-水-三乙胺-冰醋酸=27:70.6:1.6:0.78;流速:1 mL/min;检测波长:270 nm;进样量10 μL。对照品色谱图见图 1。
|
| 图 1 荷叶碱对照品的HPLC图 |
精密称量荷叶碱对照品4.04 mg,置于5 mL棕色容量瓶内,加甲醇稀释至刻度,得到808 μg/mL的荷叶碱标准品溶液;精密量取储备液适量逐级稀释4~1 026倍,得到0.787~202 μg/mL的对照品溶液,由低到高浓度分别进样10 μL,记录峰面积。
以荷叶碱质量浓度X(μg/mL)为横坐标,峰面积Y为纵坐标进行线性回归,得线性回归方程:Y=3.798 8×104X-2.1470×104(r=0.999 9),荷叶碱质量浓度在0.787~202 μg/mL呈良好的线性关系。
2.1.3 精密度实验精密吸取对照品溶液(12.65 μg/mL),连续进样6次,以峰面积计,相对标准偏差(RSD)为1.4%,表明仪器精密度良好。
2.1.4 重复性实验称取10 g荷叶样品置500 mL具圆底烧瓶,加入150 mL 95%乙醇,置恒温水浴锅中65 ℃浸提2 h,取样适量离心(12 000 r/min,5min),上清经0.22 μm微孔滤膜过滤,滤液稀释进样分析,平行制备6份,计算重复性为1.5%。
2.1.5 稳定性实验取荷叶样品,配制好溶液,室温放置,分别于0、2、4、8、12、24 h测定,RSD为2.1%,样品溶液在24 h内稳定。
2.1.6 加样回收率测定收集提取10 min时的样品液,精密加入16.16 μg/mL标准溶液,加样回收率为98.73%,RSD为3.8%。
2.2 浸提动力学考察 2.2.1 干药材吸收溶剂率的测定取10 g干燥荷叶粗粉置三颈瓶中,向其中加入95%乙醇适量,浸提2 h,测定浸提后药液体积,得荷叶吸收溶剂率3 mL/g。
2.2.2 不同温度下浸提动力学研究荷叶(取药典5,6号筛之间的样品)10 g置三颈瓶中,加入95%乙醇(溶剂量150 mL)冷凝回流,水浴加热,于45、55、65、75 ℃提取,搅拌速度60 r/min,加入乙醇时计时于5、10、20、30、40、60、80、100、120 min取样1 mL(并补充溶剂),离心(15 000 r/min,2 min)取上清,过滤稀释进样。
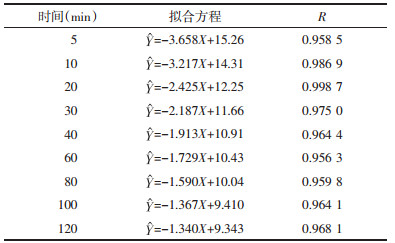
2.2.3 不同溶剂体积下浸提动力学研究荷叶(取药典5,6号筛之间的样品)10 g置三颈瓶中,加入95%乙醇冷凝回流,水浴加热,加入溶剂体积分别为110、130、180、230 mL,65 ℃提取,加入乙醇时计时分别于5、10、20、30、40、60、80、120 min取样1 mL,离心(15 000 r/min,2 min)取上清,过滤稀释进样。
2.2.4 不同溶剂下浸提动力学研究荷叶(取药典5,6号筛之间的样品)10 g置三颈瓶中,加入30、50、70、95%乙醇(溶剂量150 mL)冷凝回流,水浴加热,于65 ℃提取,加入乙醇时计时于5、10、20、30、40、60、80、120 min取样1 mL (并补充溶剂),离心(15000 r/min,2 min)取上清,过滤稀释进样。
2.2.5 样品浓度的测定精密吸取不同浸提时间下的药液离心(15 000 r/min,2 min),立即过0.22 μm滤膜,适量稀释进样分析。
2.3 数学模型的建立[13-19]中药提取过程大致分为5个步骤:1)溶剂向荷叶药材表面的扩散。2)溶剂向荷叶药材内部的润湿(内扩散)。3)药材内部溶质的溶解。4)溶质从药材内部向药材表面扩散(内扩散)。5)药材表面向溶液主体的扩散(外扩散)。其中步骤1)、2)为溶剂渗透,3)为溶质溶解,4)、5)为溶质扩散。其中溶质扩散为天然药物提取的限制步骤,步骤4的扩散为溶质扩散的主要控制步骤,浸提速率完全由步骤4决定。
基于Fick第一定律建模,基本假设:1)不考虑溶剂损失;2)荷叶颗粒是球形的,为单一成分恒温提取。
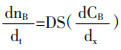
|
(1-1) |
S为固液界面积;dnB/dt为通过扩散面物质量的时间变化率;D为扩散系数。封闭体系中,浓度梯度随时间变化以公式(1-2)表示。
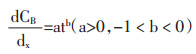
|
(1-2) |
将(1-1)带入(1-2):
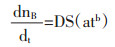
|
(1-3) |
对于稀溶液,浓度对扩散系数影响较小,对浓溶液扩散系数为浓度的函数。扩散系数与溶质浓度的幂呈正比:
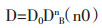
|
(1-4) |
D0溶质的固有扩散系数。将(1-4)带入(1-3),假设药液中溶质B的初始溶度为0,t时刻nB=VCB,V为药液体积。
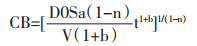
|
(1-5) |
药材粉碎后颗粒数为k1,颗粒粒度e,药材总干质量G,密度为d,
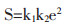
|
(1-6) |
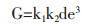
|
(1-7) |
K为与药物颗粒形状有关的形状参数,设K=k1/k2,得:
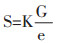
|
(1-8) |
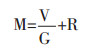
|
(1-9) |
R:药材吸收溶剂率,即药材充分吸湿所需溶剂体积与干药比值。将(1-8)、(1-9)带入(1-5),
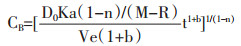
|
(1-10) |
设U=1+b,
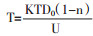
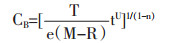
|
(1-11) |
溶剂体积改变:公式(1-11)取对数得:
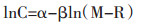
|
(1-12) |
设:α=1/(1-n)ln[TtU/e]
β=1/(1-n)
公式(1-12)为中药浸提动力学模型,表示浸出成分与溶剂量之间的关系。V:药液体积;e:药材颗粒粒度;M:干药材加入溶剂体积与干药材质量之比;D:扩散系数;R:药材充分吸湿所需溶剂与干药材质量之比。α、β为常数,lnC与ln(M-R)呈线性关系。
(1) 浸提温度改变
扩散系数与温度的关系:扩散系数与温度的关系:A为指前因子,E为扩散活化能,对于特定的系统,均为常数。令m=KAa(1-n)/e(m-R),得:
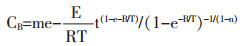
|
(1-13) |
两边取对数:
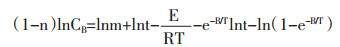
|
(1-14) |
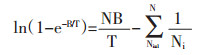
|
(1-15) |
N为公式(1-15)展开项数。浸提温度较高时,e-B/T近似为1-B/T,将(1-15)带入(1-14)得:
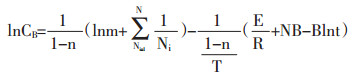
|
(1-16) |
设:
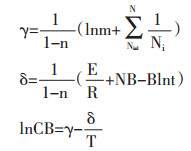
|
(1-17) |
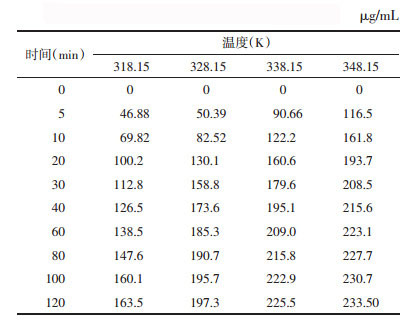
当浸提溶剂量、药材粒径固定时,γ、δ为常数,lnCB与1/T呈线性关系。公式(1-17)为中药浸提动力学模型,表示浸出成分与温度之间的关系。
(2) 浸提溶剂改变
采用一级一项动力学模型荷叶中荷叶碱动力学模型进行拟合,推到公式得:
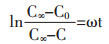
|
(1-18) |
C∞浸提平衡时溶液中功能成分的质量浓度度;C0浸提初始时溶液中功能成分质量浓;C随时间t变化的溶液中功能成分质量浓度,设荷叶浸提初始时溶液中荷叶碱成分质量浓度为0。公式(1-18)为中药浸提动力学模型,表示浸出成分随时间变化规律。基本假设:荷叶碱扩散沿荷叶颗粒球体径向进行,不同溶剂浸提过程中扩散系数为常数。
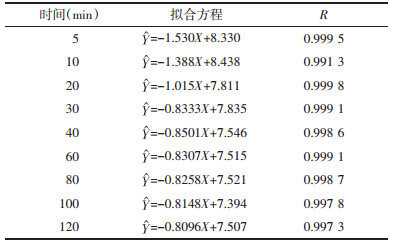
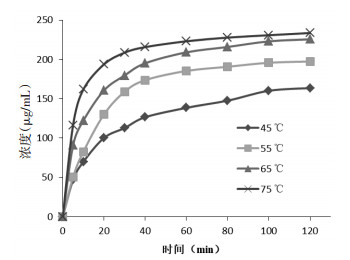
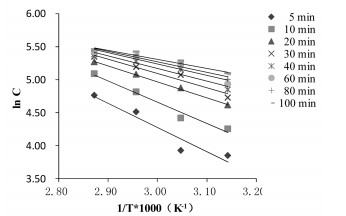
2.4 实验结果 2.4.1 不同温度对荷叶中荷叶碱浸提动力学考察不同温度(45,55,65,75 ℃)下荷叶中荷叶碱浸提结果如表 1所示,实验范围内,随温度升高,荷叶碱提取量增大。不同温度下荷叶碱浸提曲线如图 2所示。动力学拟合方程以lnC-1/T×103作图,结果如表 2,图 3所示,拟合曲线(R>0.95),线性关系良好,可用于描述不同温度下荷叶中荷叶碱浸提动力学过程。
|
| 图 2 不同温度下荷叶碱浸提曲线 |
|
| 图 3 不同温度浸提动力学考察(lnC-1/T×103) |
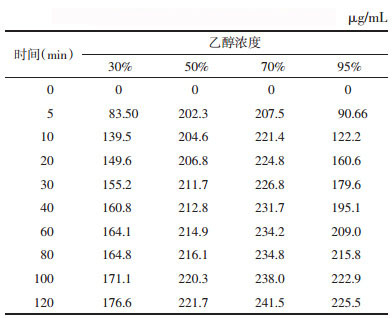
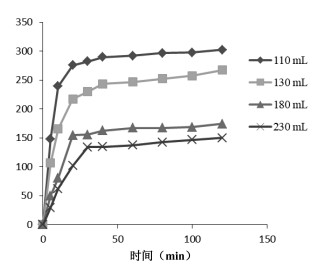
不同提取溶剂体积下,荷叶中荷叶碱浸提动力学考察结果如表 3所示。溶剂量为110、130、180、230 mL,荷叶药材吸收溶剂率为3,荷叶有效浸提溶剂倍量分别为8、10、15、20倍。
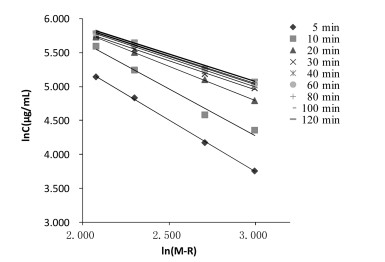
实验范围内,随浸提体积增大,荷叶碱平衡提取量增大,浸提达到平衡的时间延长。不同溶剂量下荷叶碱浸提曲线如图 4所示。动力学拟合方程以lnC-ln(M-R)作图,结果如表 4、图 5所示,拟合曲线(R>0.95),线性关系良好,可用于描述不同浸提体积下荷叶中荷叶碱浸提动力学过程。
|
| 图 4 不同溶剂体积浸提动力学考察 |
|
| 图 5 不同溶剂体积浸提动力学拟合曲线[lnC-ln(M-R)] |
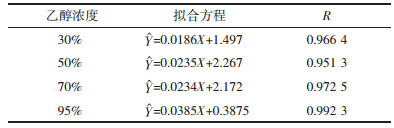
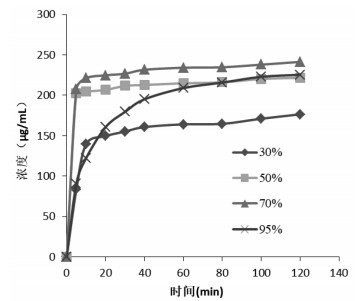
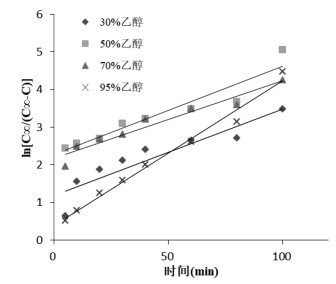
不同提取溶剂(30%、50%、70%、95%乙醇)下,荷叶中荷叶碱浸提动力学考察结果如表 5所示。实验范围内,不同溶剂提取过程中存在浓度交叉,70%乙醇具有最大提取速率、提取量,浸提曲线如图 6所示。动力学拟合方程以ln[C∞/(C∞-C)]-t作图,结果如表 6、图 7所示,拟合曲线R>0.95,线性关系良好,可用于描述不同溶剂下荷叶中荷叶碱浸提动力学过程。
|
| 图 6 不同溶剂浸提曲线 |
|
| 图 7 不同溶剂浸提动力学考察 |
基于Fick第一定律建立浸提动力学模型考察不同温度、溶剂量、溶剂种类对荷叶碱浸提规律的影响。结果,温度升高,浸提速率及浸提量提高。随浸提体积增大,荷叶碱平衡提取量增大。不同浓度溶剂提取过程中,存在浓度交叉,以70%乙醇提取率最高。
本研究对不同温度、溶剂量、溶剂中荷叶浸提动力学进行考察,基于Fick第一定律建立数学模型进行拟合与推测,不同溶剂中荷叶中荷叶碱浸提动力学符合一级一项浸提动力学模型。建立的中药浸提动力学模型,相关性良好,能够描述浸提温度、溶剂种类、浸提体积对荷叶碱浸提动力学的影响,为荷叶实际生产中提供理论依据与数据支持。
目前研究内容为药材中单一成分,后续应将所得荷叶浸提动力学模型应用于中药复方的研究,为确定中药复方的最佳提取条件提供参考与数据支持。
| [1] |
金元宝, 钟洁丹, 李雪玥, 等. 基于HPLC法利用正交实验法优化提取荷叶中荷叶碱[J]. 教育教学论坛, 2018(1): 272-273. DOI:10.3969/j.issn.1674-9324.2018.01.120 |
| [2] |
张静怡, 徐先顺, 徐珽, 等. HPLC法测定荷叶中荷叶碱[J]. 现代预防医学, 2015, 42(8): 1479-1552. |
| [3] |
刑毅, 刘杰. 索氏提取荷叶生物碱及纯化工艺探究[J]. 食品工业, 2018, 39(04): 230-234. |
| [4] |
郭福川, 李颖, 牛玉存, 等. 四种植物化学物预防性调节血脂作用快速评价[J]. 卫生研究, 2011, 40(6): 759. |
| [5] |
戴谆, 宋金春, 杨小青. 荷叶碱的药理作用研究进展[J]. 中国药师, 2016, 19(5): 988. DOI:10.3969/j.issn.1008-049X.2016.05.052 |
| [6] |
蒋锡兰, 王伦, 李甫, 等. 荷叶的抗氧化活性成分[J]. 应用与环境生物学报, 2017, 23(1): 89. |
| [7] |
Qi Q, Li R, Li H, et al. Identification of the anti-tumor activity and mechanisms of nuciferine through a network pharmacology approach[J]. Acta Pharmacol Sin, 2016, 37: 963. DOI:10.1038/aps.2016.53 |
| [8] |
Li S, Li X, Lamikanra O, et al. Effect of cooking on physicochemical properties and volatile compounds in lotus root (Nelum-bo nucifera Gaertn)[J]. Food Chem, 2017, 216: 316. DOI:10.1016/j.foodchem.2016.08.044 |
| [9] |
刘杰. 荷叶碱提取工艺的优化[J]. 中国实用医药, 2012, 07(32): 235-236. DOI:10.3969/j.issn.1673-7555.2012.32.189 |
| [10] |
Boustie J, Stigliani JL, Montanha J, et al. Antipoliovirus structureactivity relationships of some aporphine alkaloids[J]. J Nat Prod, 1998, 61(4): 480-484. DOI:10.1021/np970382v |
| [11] |
Kashiwada Y, Aoshima A, Ikeshiro Y, et al. Anti-HIV benzyliso-quinoline alkaloids and flavonoids from the leaves of Nelumbonueifera and structureactivity crreelations with related alkaloids[J]. Bioorg&Med Chem, 2005, 13(2): 443-448. |
| [12] |
David DB, Jeffrey JW, Mathew PJ, et al. Wind and watrosionand transport in semi-arid scrublands, grassland and forest ecosys-tems:quantifying dominance of horizontal wind driven transport[J]. Earth Surf. Processes Landform, 2003, 28: 1189-1209. DOI:10.1002/esp.1034 |
| [13] |
储茂泉, 古宏晨, 刘国杰. 中草药浸提温度对有效成分浸出浓度的影响[J]. 中草药, 2001, 32(1): 24-25. DOI:10.3321/j.issn:0253-2670.2001.01.012 |
| [14] |
储茂泉, 古宏晨, 刘国杰. 中草药浸提过程的动力学模型[J]. 中草药, 2000, 31(7): 26-28. |
| [15] |
苏辉, 王伯初, 刘玮琦, 等. 天然药物提取过程的动力学数学模型[J]. 中草药, 2011, 42(2): 384-391. |
| [16] |
陈少峰, 池汝安, 田君. 柴胡总黄酮提取条件优化及其动力学[J]. 武汉化工学院学报, 2006, 28(3): 10-13, 16. DOI:10.3969/j.issn.1674-2869.2006.03.003 |
| [17] |
田君, 池汝安, 高洪, 等. 乙醇提取土茯苓黄酮甙的动力学研究[J]. 天然产物研究与开发, 2005, 17(1): 11-15. DOI:10.3969/j.issn.1001-6880.2005.01.004 |
| [18] |
王唯涌, 韩鲁佳. 黄芩黄酮浸提过程动力学模型适用性分析[J]. 农业机械学报, 2009, 40(4): 116-120. |
| [19] |
邓辉, 史亚军, 王卉, 等. 丹参中丹酚酸B的提取动力学研究[J]. 陕西中医, 2015, 36(9): 1253-1254. DOI:10.3969/j.issn.1000-7369.2015.09.078 |
 2019, Vol. 38
2019, Vol. 38