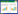文章信息
- 宋敏, 陈璐, 李春晓, 房志锐, 张璐莎, Coffie Joel Wake, 张丽媛, 马璐璐, 王虹
- SONG Min, CHEN Lu, LI Chunxiao, FANG Zhirui, ZHANG Lusha, Coffie Joel Wake, ZHANG Liyuan, MA Lulu, WANG Hong
- 脑心通胶囊对Ⅱ型糖尿病小鼠伤口愈合的作用
- Effect of Naoxintong capsule on wound healing in type Ⅱ diabetic mice
- 天津中医药大学学报, 2019, 38(4): 406-411
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(4): 406-411
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.04.21
-
文章历史
收稿日期: 2019-02-19
2. 天津中医药大学中西医结合学院, 天津 301617
2. School of Integrative Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
糖尿病足溃疡(DFU)是糖尿病的并发症之一,在世界范围内发病率很高,近年来,世界上有近30%的人口患有糖尿病,其中650万人患有慢性皮肤溃疡[1]。DFU的发病机制复杂,其中由糖尿病引起的缓慢的伤口愈合是糖尿病坏疽的主要原因[2]。在过去的几十年中,在预防DFU患者的发病率和治疗方面几乎没有取得突破,此外,目前用于DFU的治疗药物大多是生长因子,这使得治疗成本增加。因此,对于DFU的预防和治疗,迫切需要更有效、更特异的药物[3]。脑心通胶囊(NaoXinTong,NXT)是含有11种中草药,2种树脂药和3种动物药的精粉混合物[4]。现代药理学的研究表明,NXT能通过抑制小鼠树突状细胞的成熟、巨噬细胞一氧化氮吸入(iNO)和一氧化氮(NO)的生成来减少动脉粥样硬化[5-8]。而且脑心通能改善糖尿病小鼠的糖/脂代谢、维持组织结构完整性、降低糖尿病引起的肾功能障碍来抑制糖尿病肾病[9]。课题组前期研究研究结果显示NXT能促进心肌缺血小鼠心功能恢复,减小心肌梗死面积,其机制与促进心肌缺血边缘区血管新生有关[10]。但NXT是否可以促进糖尿病小鼠伤口愈合及血管新生不清楚,本研究采用db/db小鼠切除伤口夹板模型探讨了NXT对Ⅱ型糖尿病小鼠伤口愈合的作用及其可能的作用机制。
1 材料 1.1 动物8~12周SPF级雄性C57BL/6JNju(db/+)和BKS.Cg-Dock7m+/+Lepr db/JNju(db/db)小鼠由南京大学南京生物医学研究所提供。小鼠体内实验方案由天津中医药大学伦理委员会批准。小鼠在中国医学科学院放射医学动物研究所(天津)于温度22~25 ℃和相对湿度50%~60%条件下饲养。
1.2 药物脑心通超微粉末由陕西步长制药有限公司提供,由黄芪、赤芍、丹参、当归、川芎、桃仁、红花、制乳香、制没药、鸡血藤、牛膝、桂枝、桑枝、地龙、全蝎、水蛭组成。将脑心通超微粉末加入生理盐水中配制成0.07 g/mL溶液,分装备用。
1.3 试剂avertin(美国Sigma公司);RIPA(北京索莱宝科技有限公司);蛋白酶抑制剂,磷酸酶抑制剂和PMSF(瑞典巴塞尔罗氏集团);β-actin、PI3K/p-PI3K、AKT/p-AKT(美国Cell Signaling Technology有限公司);其他抗体,包括VEGF,eNOS/p-eNOS(上海Abcam有限公司);血糖仪和血糖试纸(瑞典巴塞尔罗氏集团);甲醇等其他常用试剂为国产分析纯,实验用水为去离子水。
2 方法 2.1 造模小鼠腹腔注射Avertin (16.5 mL/kg),在麻醉下从背部表面去除毛发后,在小鼠中线上创建一个6 mm的全层切除皮肤伤口。用粘合剂硅胶板固定在伤口周围,并用5-0缝合线缝合。在伤口上滴下庆大霉素后,用无菌透明敷料覆盖伤口,每2日更换1次。
2.2 分组及给药将db/db和db/+小鼠按体重随机分为3组:db/+Saline组、db/db Saline组、db/db NXT组[脑心通0.7 g/(kg·d)]。给药组给予相应的脑心通药液,模型组给予等量的生理盐水,每天灌胃给药1次,连续给药17 d。
2.3 伤口愈合分析用照相机对伤口闭合区进行追踪,每2天追踪1次。用Image J软件对创面闭合度进行量化,以创面愈合面积百分比表示,计算为:[1-(day X创面面积/day 0天创面面积)]×100%。
2.4 HE染色创面皮肤组织用4%聚甲醛固定,石蜡包埋,切片(5 μm)。石蜡切片加热60 ℃过夜,然后通过二甲苯和一系列分级乙醇溶液脱蜡。然后进行苏木精染色,盐酸分化,流水冲洗后酒精脱水,伊红溶液染色。最后梯度乙醇脱水、二甲苯透明、中性树胶封片。HE染色后,体式显微镜拍片,用Image J计算肉芽组织面积和上皮化程度。
2.5 免疫荧光评价小鼠在处死前30 min静脉注射50 μL的Griffonia Simpli-cifolia Lectin I(1 mL HKS缓冲液稀释)。创面皮肤组织用4%聚甲醛固定,石蜡包埋,切片(5 μm)。石蜡切片加热60 ℃过夜,然后通过二甲苯和一系列分级乙醇溶液脱蜡。切片用预热抗原修复液孵育10 min,在PBS中洗涤3次后,用5%胎牛血清在PBS中室温下封闭1 h。将一抗ANTI-SOYBEAN AGGLUTININ(PBS缓冲液稀释1:100)与切片在4 ℃下隔夜孵育,二抗DyLight®594 ANTI-GOAT IgG(H+L)(PBS缓冲液稀释1:200)在室温黑暗环境中孵育20 min。用抗荧光衰退淬灭剂封片,在倒置荧光显微镜下观察。
2.6 Western blotting将组织放入预冷的裂解液中(10 mL裂解液:10 mL RIPA+0.1 g蛋白酶抑制剂+0.1 g磷酸酶抑制剂+50 μL PMSF),研磨破碎,4 ℃离心,12 000 r/min共15 min,吸取上层上清液,BCA法测定蛋白浓度,定量。在10% SDS-PAGE上分离每个样品,并将其转移到PVDF膜上。在TBST中用5%牛血清白蛋白或脱脂牛奶(TBS中用0.1% Tween-20)封闭3 h后,在4 ℃下与各自的一抗孵育过夜,后用TBST彻底洗涤。然后,将膜与二抗辣根过氧化物酶(1:10 000)在室温下孵育1 h。用增强的化学发光检测试剂进行印迹检测。用Image J量化蛋白条带的灰度强度,并与每个样品中的β-actin进行归一化。
2.7 统计分析统计分析使用SPSS软件进行。实验的结果用x±s表示。多组间比较采用单因素方差分析(ANOVA),组间两两比较采用LSD-t检验。P < 0.05为差异具有统计学意义。
3 结果 3.1 脑心通胶囊对Ⅱ型糖尿病小鼠伤口愈合的影响术后给药16 d后,与正常小鼠的伤口愈合相比,糖尿病模型组小鼠在组织损伤后的伤口愈合速率明显降低(P < 0.05或P < 0.01),在糖尿病小鼠中,脑心通组与模型组相比较,损伤后10~14 d伤口愈合率脑心通组明显高于模型组(P < 0.05),说明脑心通能明显促进糖尿病小鼠的伤口愈合速率,见图 1。
|
| (A)创伤后伤口愈合照片,(B)0~16 d伤口闭合面积百分比,*P < 0.05,**P < 0.01 vs db/+Saline,#P < 0.05 vs db/db Saline(x±s,n=8)。 图 1 脑心通对Ⅱ型糖尿病小鼠伤口愈合的影响 |
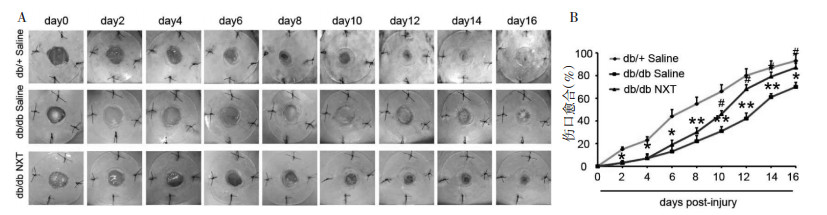
术后7,16 d,HE免疫组化染色,观察伤口边缘组织形态。如图 2所示:在术后7 d,3组小鼠都处于伤口愈合期,伤口边缘组织中能观察到明显的肉芽组织和上皮化,与db/+ Saline小鼠相比,db/db Saline小鼠伤口组织边缘肉芽组织面积和上皮化程度明显降低,而与db/db Saline相比,db/db NXT组小鼠伤口边缘上皮化明显增加,肉芽组织的面积无明显变化。术后16 d,db/+ Saline小鼠伤口完全愈合,伤口组织边缘肉芽组织和上皮化退化,角质层形成,与db/+ Saline小鼠相比,db/db Saline小鼠伤口组织边缘肉芽组织和上皮化明显,而在db/db小鼠中,伤口仍处于愈合阶段,伤口组织边缘能观察到明显的肉芽组织和上皮化,但与db/db Saline相比,db/db NXT组小鼠伤口边缘肉芽组织的面积增加和上皮化降低。
|
| (A)创伤后7、16天伤口组织边缘HE染色,(B-C)创伤后7、16天伤口边缘肉芽组织形成和上皮化定量,肉芽组织(Granulation Tissue,GT),上皮间隙(Epithelial Gap,EG),*P < 0.05,**P < 0.01,***P<0.001 vs db/+ Saline,#P < 0.05,##P < 0.01 vs db/db Saline (x±s,n≥7)。 图 2 脑心通对Ⅱ型糖尿病小鼠伤口处肉芽组织形成和上皮化的影响 |
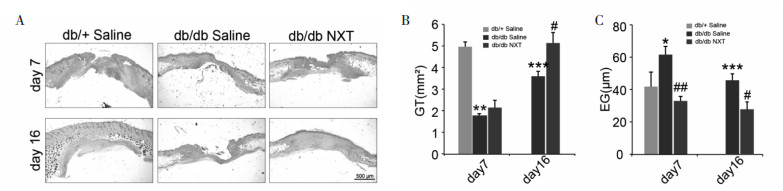
如图 3所示,与db/+相比较,db/db小鼠的体质量和血糖均高于db/+小鼠,而脑心通给药组与db/db模型组相比,体质量和血糖均没有明显变化。
|
| (A)db/+ Saline、db/db Saline与db/db NXT组体质量变化。(B) db/+ Saline、db/db Saline与db/db NXT组空腹血糖变化(x±s,n=8)。 图 3 脑心通Ⅱ型糖尿病小鼠体质量、空腹血糖的影响 |
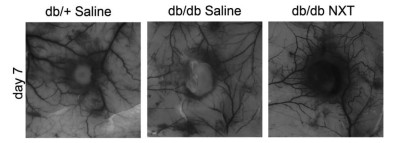
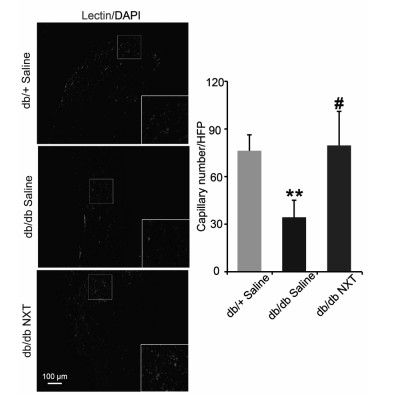
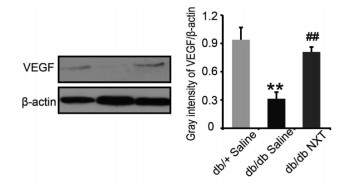
如图 4~6所示,与正常的小鼠相比,db/db Saline组伤口周围的血管密度和毛细血管密度明显降低(P < 0.01),而db/db NXT组与db/db Saline组相比,伤口周围的血管密度和毛细血管密度也明显增加(P < 0.05),Western blotting的结果显示,与正常组小鼠相比,在组织损伤7 d时,db/db Saline组VEGF表达量明显降低,而db/db NXT组与db/db Saline组相比,VEGF的表达量明显增加。
|
| 图 4 脑心通对Ⅱ型糖尿病小鼠伤口边缘血管密度的影响(n=6) |
|
| 损伤后7天Lectin免疫荧光染色和Lectin免疫荧光染色的量化,**P < 0.01 vs db/+ Saline,#P < 0.05 vs db/db Saline (x±s,n=6)。 图 5 脑心通对Ⅱ型糖尿病小鼠伤口边缘毛细血管的影响 |
|
| 损伤后7天组织中VEGF的表达,**P < 0.01 vs db/+ Saline,##P < 0.01 vs db/db Saline(x±s,n≥3)。 图 6 脑心通对Ⅱ型糖尿病小鼠伤口周围组织VEGF表达的影响 |
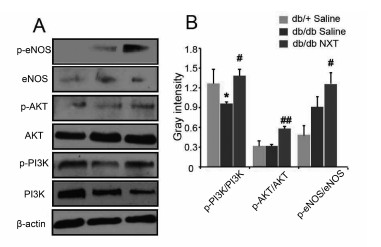
在图 7中,与正常小鼠相比,db/db Saline组的PI3K磷酸化明显降低(P < 0.05),而db/db NXT组与db/db Saline相比PI3K、AKT和eNOS磷酸化明显增加(#P < 0.05 and ##P < 0.01),说明脑心通能促进PI3K、AKT和eNOS的磷酸化,从而激活PI3K/AKT/eNOS信号通路。
|
| (A)组织损伤7 d后,伤口边缘区域PI3K/p-PI3K、AKT/p-AKT、eNOS/p-eNOS Western blotting结果,(B)A图的量化,*P < 0.05 vs db/+ Saline,#P < 0.05 and ##P < 0.01 vs db/db Saline (x±s,n≥3)。 图 7 脑心通对PI3K/AKT/eNOS信号通路的影响 |
糖尿病伤口愈合迟缓或者不愈合是导致DFU的主要原因[2]。目前,临床上用于治疗糖尿病伤口愈合的方法主要有加强伤口护理,降低局部压力,改善微循环和控制炎症反应等,但在临床应用中只能达到很低的愈合率。近年来干细胞技术、生长因子治疗、氧疗等虽然应用于实验室和临床,但仍存在治疗效果短暂和成本较高等弊端[11]。因此,对于DFU的治疗,需要更有效、更特异的药物。NXT是在经方补阳还五汤的基础上加入乳香、没药、丹参、鸡血藤增加其活血化瘀作用,临床上主要用来治疗缺血性心脑血管疾病。在本研究中,我们使用Ⅱ型糖尿病小鼠,建立切除性创面夹板模型,该模型将夹板紧密地贴附在创面周围的皮肤上,通过减少由于皮肤收缩和创面敷料引起的变化,实现创面均匀闭合,使伤口愈合的过程更接近于Ⅱ型糖尿病人伤口愈合的过程[12]。笔者研究结果显示NXT可以促进Ⅱ型糖尿病小鼠伤口愈合,提示NXT可以用于治疗糖尿病并发症。
组织损伤时释放出多种损伤相关分子,引发急性促炎反应,导致各种促炎介质(如细胞因子和趋化因子)的释放,这些介质诱导炎症细胞募集,分泌细胞因子、生长因子等促进细胞外基质的降解,以及各种细胞,主要是成纤维纤维细胞的增殖和迁移,形成肉芽组织,最后肉芽组织变薄,细胞外基质的聚集和沉积形成瘢痕[13-16]。在肉芽组织的形成过程中,细胞的增殖和迁移所需的氧气和营养物质需要血管的运输,因此血管新生在肉芽组织的形成过程中发挥了很大的作用。但是在糖尿病患者中,高糖环境和持续的炎症反应使内皮细胞的数量减少,其增殖、迁移、黏附、血管新生的能力减弱,微血管损伤,血管新生受损,伤口愈合推迟[17]。笔者以前的研究表明,NXT能减小急性心肌梗死小鼠心肌梗死面积,促进心功能恢复,其机制与促进缺血组织血管新生有[18]。本研究采用Ⅱ型糖尿病小鼠伤口愈合模型进一证实NXT可以促进损伤组织血管新生及肉芽组织形成,加速伤口愈合。
伤口愈合中的血管新生依赖于促血管生长因子的作用,血管内皮生长因子(VEGF)是已知最强的促进血管新生因子,VEGF与其受体结合后可促进内皮细胞增殖迁移,从而促进血管新生,但是在糖尿病环境下,VEGF的表达下调,内皮细胞增殖和粘附的能力减弱,血管新生受到抑制[19-20]。PI3K/AKT/eNOS信号通路是激活酪氨酸激酶信号通路,当VEGF与内皮细胞表面受体的结合能激活细胞内酪氨酸激酶,触发多种促进血管生成的下游信号,大量的证据表明PI3K/AKT/eNOS相关的信号通路参与内皮细胞的存活与增殖,从而促进血管新,磷脂酰肌醇3-激酶(PI3K)的磷酸化能刺激诱导下游蛋白丝氨酸苏氨酸激酶(AKT)的磷酸化,磷酸化的AKT导致其下游一氧化氮合酶(eNOS)底物的激活,从而促进NO的产生,NO是维持内皮细胞生物学功能的基本分子[10, 21]。笔者结果表明脑心通能促进PI3K、AKT和eNOS磷酸化,从而激活PI3K/AKT/eNOS信号通路,增加VEGF的表达,促进血管新生和伤口愈合。笔者以前的研究显示脑心通能激活VEGF/eNOS信号通路增加缺血区毛细血管密度促进心肌缺血小鼠心功能恢复[21]。本研究结果显示在伤口愈合的过程中脑心通能激活PI3K/AKT/eNOS信号通路,增加VEGF的表达,促进血管新生从而促进肉芽组织的形成,加速Ⅱ型糖尿病小鼠伤口愈合。
综上所述,脑心通胶囊能促进Ⅱ型糖尿病小鼠伤口愈合,其作用机制与激活PI3K/AKT/eNOS信号通路、上调VEGF的表达从而促进组织血管新生有关。本研究为NXT应用于糖尿病并发症的治疗提供了实验依据。然而NXT成分复杂,其促进Ⅱ型糖尿病伤口愈合多靶点作用机制还有待进一步探讨。
| [1] |
Gould L. Chronic wound repair and healing in older adults:current status and future research[J]. J Am Geriatr Soc, 2015, 63(3): 427-38. DOI:10.1111/jgs.13332 |
| [2] |
Zhang SS, Tang ZY, Fang P, et al. Nutritional status deteriorates as the severity of diabetic foot ulcers increases and independently associates with prognosis[J]. Exp Ther Med, 2013, 5(1): 215-222. DOI:10.3892/etm.2012.780 |
| [3] |
Reish RG, Eriksson E. Scars:A review of emerging and currently available therapies[J]. Plastic & Reconstructive Surgery, 2009, 122(4): 1068-1078. |
| [4] |
Ma X. Identification of "Multiple components-multiple targets-multiple pathways" associated with naoxintong capsule in the treatment of heart diseases using UPLC/Q-TOF-MS and network pharmacology[J]. Evid Based Complement Alternat Med, 2016, 2016(12): 1-15. |
| [5] |
李树仁, 王天红, 张宝军, 等. 脑心通胶囊对冠心病临界病患者炎症反应及预后的影响[J]. 中国中医药杂志, 2012, 32: 607-611. |
| [6] |
黎丽娴, 陈立, 赵焕佳, 等. 脑心通胶囊对急性心肌梗死患者血管内皮细胞功能及梗死面积影响[J]. 中国中西医结合杂志, 2011, 31: 1615-1618. |
| [7] |
Zhong XN. Effects of Naoxintong on atherosclerosis and inducible nitric oxide synthase expression in atherosclerotic rabbit[J]. Chin Med J (Engl), 2013, 126: 1166-1170. |
| [8] |
Zhang F, Huang B, Ye Z, et al. BNC protects H9c2 Cardiomyoblasts from H2O2-Induced oxidative injury through ERK1/2 signaling Pathway[J]. Evid Based Complement Alternat Med, 2013, 2013(5): 1-12. |
| [9] |
Yang S, Liu M, Chen Y, et al. Naoxintong Capsules inhibit the development of diabetic nephropathy in db/db mice[J]. Scientific Reporets, 2018, 8: 9158-9171. DOI:10.1038/s41598-018-26746-1 |
| [10] |
Wang H, Qiu LZ, Ma Y, et al. Naoxintong inhibits myocardial infarction injury by VEGF/eNOS signaling-mediated neovascularization[J]. Journal of Ethnopharmacology, 2017(209): 13-23. |
| [11] |
朱万博. 糖尿病患者创面难愈机制及治疗研究[J]. 中国糖尿病杂志, 2016, 24: 1135-1139. DOI:10.3969/j.issn.1006-6187.2016.12.018 |
| [12] |
Barrientos S, Stojadinovic O, Golinko MS. The mouse excisional wound splinting Saline, including applications for stem cell transplantation[J]. Nat Protoc, 2013, 8(2): 302-309. DOI:10.1038/nprot.2013.002 |
| [13] |
Monaco JL, Lawrence WT. Acute wound healing an overview[J]. Clinics in Plastic Surgery, 2003, 30(1): 1-12. |
| [14] |
Barrientos S, Stojadinovic O, Golinko MS. Growth factors and cytokines in wound healing[J]. Wound Repair and Regeneration, 2010, 16(5): 585-601. |
| [15] |
Chen Z. Activation and regulation of the granulation tissue derived cells with stemness-related properties[J]. Stem Cell Res Ther, 2015, 6(1): 85. DOI:10.1186/s13287-015-0070-9 |
| [16] |
Rennert RC. Biological therapies for the treatment of cutaneous wounds:phase Ⅲ and launched therapies[J]. Expert Opinion on Biological Therapy, 2013, 13(11): 1523-1541. DOI:10.1517/14712598.2013.842972 |
| [17] |
Drela E, Stankowska K, KulwasA, et al. Endothelial progenitor cells in diabetic foot syndrome[J]. Adv Clin Exp Med, 2012, 21: 249-254. |
| [18] |
邱丽珍, 陈璐, 李春晓, 等. 脑心通胶囊促进后下肢缺血损伤小鼠内皮祖细胞动员与归巢[J]. 中国中药杂志, 2016, 23: 4416-4423. |
| [19] |
Bao P. The role of vascular endothelial growth factor in wound healing[J]. Journal of Surgical Research, 2009, 153(2): 347-358. DOI:10.1016/j.jss.2008.04.023 |
| [20] |
Losi P, Briganti E, Errico C, et al. Fibrin-basde scaffold incorporating VEGF and bFGF-load nanoparticles stimulates wound healing in diabetic mice[J]. Acta Biomater, 2013, 9: 7814-7821. DOI:10.1016/j.actbio.2013.04.019 |
| [21] |
Ahmad KA, Ze H, Chen J, et al. The protective effects of a novel synthetic β-elemene derivative on human umbilical vein endothelial cells against oxidative stress-induced injury:Involvement of antioxidation and PI3k/Akt/eNOS/NO signaling pathways[J]. Biomedicine & Pharmacotherapy, 2018(106): 1734-1741. |
 2019, Vol. 38
2019, Vol. 38