文章信息
- 王青, 苏聪平, 张惠敏, 罗慧, 焦文超, 李琳, 张晶璇, 郭淑贞
- WANG Qing, SU Congping, ZHANG Huimin, LUO Hui, JIAO Wenchao, LI Lin, ZHANG Jingxuan, GUO Shuzhen
- 芪参颗粒中獐牙菜苷对过量异丙肾上腺素致小鼠心力衰竭的保护作用
- Protective effect of sweroside on heart failure induced by excessive isoproterenol in mice
- 天津中医药大学学报, 2019, 38(5): 468-472
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(5): 468-472
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.05.14
-
文章历史
收稿日期: 2019-05-25
2. 北京中医药大学北京中医药研究院, 北京 100029
2. Beijing University of Traditional Chinese Medicine, Beijing Institute of Traditional Chinese Medicine, Beijing 100029, China
心力衰竭(简称心衰)是指由于各种原因导致的心肌结构和功能异常,引起心室收缩功能(射血)和/或舒张功能(充盈)受损的临床综合征。《中国心血管病报告2017》[1]指出,心衰现患者人数高达450万,且患病率随年龄增加上升。随着中国逐渐步入老龄化社会,心衰防治工作将是中国医疗卫生事业的巨大挑战。
芪参颗粒以益气温阳、活血解毒立法,治疗心衰药效确切。前期研究表明:其清热解毒药味可通过改善能量代谢效率治疗心衰[2]。金银花是芪参颗粒中清热解毒治法的代表性药物。獐牙菜苷,又名当药苷,是金银花中含量最高的环烯醚萜苷类化合物,有可能是芪参颗粒干预心衰的主要活性成分之一。既往獐牙菜苷的药理研究主要集中在治疗关节炎[3]、骨质疏松[4]、糖尿病[5]等。治疗心血管疾病的相关报道较少,仅有一篇报道[6]显示獐牙菜苷可以有效对抗乌头碱引发的大鼠心律失常,其作用机制与调节细胞自噬有关。
为进一步研究獐牙菜苷治疗心衰的药理活性,本研究采用BATMAN-TCM数据库对獐牙菜苷治疗心衰的作用及靶点进行预测,并采用异丙肾上腺素致心衰小鼠,观察其干预心衰的药效,分析起效环节,旨在发现獐牙菜苷干预治疗心衰的作用及其机制,进一步阐明芪参颗粒的效应成分及其机制,同时为治疗心衰提供新思路和新的候选药物。
1 材料 1.1 动物SPF级C57/BL6N小鼠,体质量18~22 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证号为SCXK(京)2016-0006。饲养于北京中医药大学SPF级动物实验室,恒温恒湿环境,自由饮水,普通饲料,适应性喂养一周后开始造模给药。
1.2 试剂獐牙菜苷由成都普思生物科技有限公司提供(批号:PS0111123)。卡托普利由中美上海施贵宝制药有限公司(批号:AAQ3404)。盐酸异丙肾上腺素(ISO)由西格玛-奥德里奇(上海)贸易有限公司提供(批号:101722747)。钠钾ATP酶α1抗体由Abcam(上海)公司提供(货号:ab7671)。羊抗小鼠IgG-HRP标记抗体由北京拜尔迪生物技术有限公司提供(货号:DE0602)。RIPA裂解液由北京普利莱基因技术有限公司提供(货号:C1053)。
1.3 仪器加拿大Vevo®2100小动物超声影像平台,匈牙利3DHIESTECH数字切片扫描系统Pannoramic 250/MIDI,美国Bio-Rad凝胶成像系统Universal Hood Ⅱ,美国伯乐Bio-Rad小型垂直电泳转印系统。
1.4 BATMAN-TCM在线生物信息数据库本数据库的网址http://bionet.ncpsb.org/batman-tcm/。
2 方法 2.1 分组与模型制备C57/BL6小鼠常规饲养,适应性饲养一周后,随机分为空白组(8只)、模型组(11只)、卡托普利组(9只)、獐牙菜苷组(9只)。模型组与给药组采用课题组前期建立的梯度造模法[7]:通过皮下注射过量ISO(第1日20 mg/kg,第2日10 mg/kg,第3~14日5 mg/kg)构建心衰小鼠模型。卡托普利组每天给予卡托普利16.5 mg/kg,獐牙菜苷组每天给予獐牙菜苷120 mg/kg[8],从造模第1天起给药,给药14 d。空白组每日给予等量蒸馏水。
2.2 心功能检测实验终点,采用加拿大Vevo®2100小动物超声影像平台评价小鼠心功能。测量左室收缩末内径(LVIDs)、左室舒张末内径(LVIDd),计算射血分数(EF)和短轴缩短率(FS)。每只动物采样3次,记录3个连续心动周期的平均值用于后续分析。
2.3 病理学检测取材时将心脏置于1%磷酸盐缓冲溶液(PBS)清洗血液,使用数码相机,拍摄、观察心脏整体形态。
心脏组织沿中心最大横径处切开,心底部浸入4%多聚甲醛固定24 h后,常规乙醇梯度脱水、二甲苯透明、浸蜡包埋、切片贴片,进行苏木精-伊红染色(HE)。
2.4 数据库靶点预测打开http://bionet.ncpsb.org/batman-tcm/,选择example 3,输入“Sweroside”,及该化合物的pubmed CID:161036,确定Score cutoff为20,以P < 0.05为统计学意义范围进行检索獐牙菜苷治疗心衰疾病靶点。
2.5 Western blot检测候选靶点心肌组织液氮速冻,-80 ℃保存。RIPA裂解液提取心肌组织总蛋白。上样量为30 μg,电泳浓缩胶时电压为80 V,电泳分离胶时,电压为120 V,电泳1.5 h。电转采用恒流300 mA,1.5 h。5%脱脂奶粉封闭1 h,一抗4°孵育过夜(小鼠单克隆抗体,ATP1A1,1:5 000),TBS-T缓冲液漂洗3次,每次10 min;取出聚偏二氟乙烯膜(PVDF)加入二抗(羊抗小鼠IgG-HRP标记,1:5 000),室温孵育1 h,TBS-T缓冲液洗膜3次后,滴加ECL发光液,曝光。记录每条蛋白泳带的灰度值,采用Image lab进行定量分析。
2.6 统计学方法采用SAS8.4统计软件进行数据分析,所有数据均以均数±标准差(x±s)表示,多组之间比较采用单因素方差分析,组间两两比较采用LSD法P < 0.05为差异有统计学意义。
3 实验结果 3.1 小鼠心脏超声模型组与空白组相比,EF、FS值显著降低(P < 0.01),LVIDs值显著增加(P < 0.01)、LVIDd有所增加(P < 0.05);与模型组相比,獐牙菜苷可以显著改善过量ISO致心衰小鼠的EF和FS值(P < 0.01),使LVIDs显著降低(P < 0.01),对LVIDd无显著影响,该作用与阳性药卡托普利相近。见图 1。
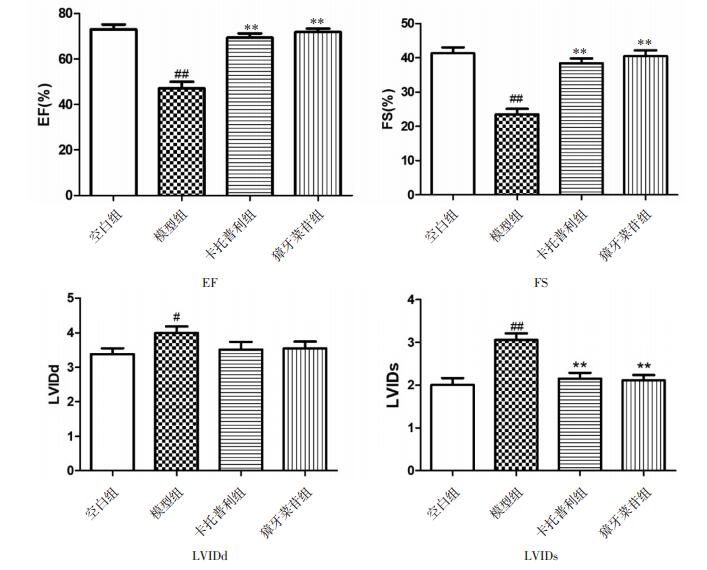
|
| 与空白组相比,#P < 0.05;##P < 0.01;与模型组相比,**P < 0.01 图 1 獐牙菜苷对过量ISO致心衰小鼠EF、FS、LVIDd、LVIDs的影响 |
剖检可见,与空白组小鼠相比,模型组小鼠心脏变大,给药组小鼠心脏与空白组小鼠心脏大小相近(见图 2)。心脏HE染色切片显微镜下观察可见,与空白组小鼠相比,模型组小鼠心脏组织左心室壁变薄,心肌纤维变细,部分动物心脏组织可见心肌纤维坏死、炎细胞浸润等病理改变;与空白组小鼠相比,卡托普利组和獐牙菜苷组小鼠心脏组织左心室壁厚度基本正常,心肌纤维无明显变细。见图 3。
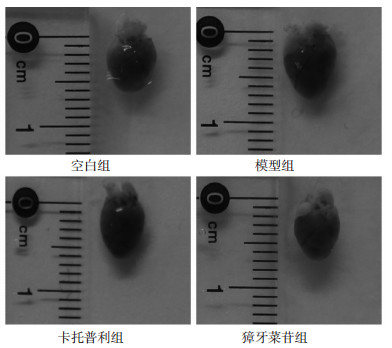
|
| 图 2 獐牙菜苷对过量ISO致心衰小鼠心脏大体形态的影响 |
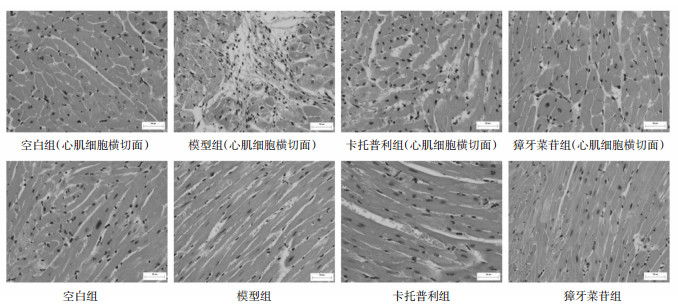
|
| 图 3 獐牙菜苷对过量ISO致心衰小鼠心脏组织病理结果(HE染色,40×) |
BATMAN-TCM数据库预测獐牙菜苷治疗心衰靶点为ATP1A1(ATPase Na+/K+ Transporting Subunit Alpha 1)。
3.4 Western blot结果与空白组相比,模型组ATP1A1蛋白表达水平显著下调(P < 0.01);与模型组相比,獐牙菜苷组ATP1A1表达上升(P < 0.01)。
4 讨论心衰是多种心系疾病的重要转归,是各种心脏疾病的严重和终末阶段。目前西医多采用抑制神经内分泌激活的黄金三角治疗策略[9],尽管有一定的疗效,但不良反应较多,远未能满足临床需求。中医药中国的重要宝库,具有多水平、多层次、多途径、毒副作用小的起效特点。芪参颗粒治疗心衰疗效确切,机制研究涉及较广,但多采用复方整体研究思路[10],对效应成分的研究还不够。
为进一步揭示芪参颗粒发挥药效的主要成分,对芪参颗粒有效活性成分进行药效筛选。獐牙菜苷是芪参颗粒中特色药味金银花的有效成分,但目前关于其治疗心血管疾病的研究报道较少。故本研究依据BATMAN-TCM数据库对獐牙菜苷治疗心衰的作用靶点进行分类预测和筛选,预测靶点为,即Na+-K+-ATP酶α1亚基(ATP1A1)。三磷酸腺苷酶(NKA酶),是存在于细胞膜上的一种膜蛋白,由α、β、γ 3种亚基组成,α亚基是其中最重要的催化亚基,大小约为112 kDa,含有ATP、Na+、K+及强心苷的结合位点[11]。α亚基的表达具有组织特异性和种属差异性,α1表达最为广泛,存在于所有细胞中,Na+-K+-ATP酶可利用ATP的水解产生能量,使3个Na+移出细胞,2个K+移入细胞,确保跨膜Na+、K+电化学梯度的产生和维持。
实验结果证明,皮下注射过量ISD可引起模型组小鼠发生心衰。獐牙菜苷可以显著改善过量ISD引起的心衰,且作用机制与预测靶点ATP1A1有关。心衰发生时,NKA酶α亚基的表达会发生改变,α1亚基具有离子泵与信号调节的功能[12]。目前报道强心苷类药物的唯一作用靶点是NKA酶,但强心苷类药物具有药物治疗安全范围狭窄、容易中毒的缺点。獐牙菜苷可能通过ATP1A1发挥强心作用,一方面有助于揭示中药复方芪参颗粒起效的物质基础,另一方面这可能为具有强心作用的药物研究提供新的候选化合物。开发中医药宝库,挖掘更多活性成分,明确其靶标,有助于中医药事业的发展繁荣。
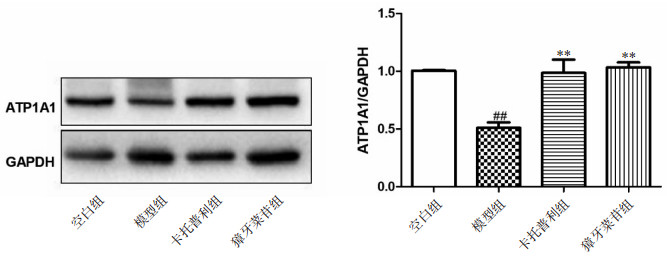
|
| 与空白组相比,##P < 0.01;与模型组相比,**P < 0.01 图 4 Western blot法检测各组小鼠ATP1A1蛋白表达变化 |
本研究通过过量ISO构建小鼠心衰模型,运用网络药理学方法预测靶点,并在蛋白表达水平进行验证,表明獐牙菜苷治疗心衰的药效与上调ATP1A1的表达量有关,为獐牙菜苷成为抗心衰药物的候选药物奠定了基础。但獐牙菜苷干预心衰的药效还需要通过其他动物模型进行验证。ATP1A1是否为獐牙菜苷的直接作用靶点,ATP1A1的表达量变化是否与獐牙菜苷的抗心衰药效存在因果关系,都还有待进一步的深入研究。
| [1] |
陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2017》概要[J]. 中国循环杂志, 2018, 23(1): 1-8. |
| [2] |
Ren W, Gao S, Zhang H, et al. Decomposing the mechanism of Qishen Granules in the treatment of heart failure by a quantitative pathway analysis method[J]. Molecules, 2018, 23(7): 1829. DOI:10.3390/molecules23071829 |
| [3] |
Zhang R, Wang CM, Jiang HJ, et al. Protective effects of sweroside on IL-1beta-induced inflammation in rat articular chondrocytes through suppression of NF-kappaB and mTORC1 signaling pathway[J]. Inflammation, 2018, 42(2): 496-505. |
| [4] |
Sun H, Li L, Zhang A, et al. Protective effects of sweroside on human MG-63 cells and rat osteoblasts[J]. Fitoterapia, 2013(84): 174-179. |
| [5] |
Huang XJ, Li J, Mei ZY, et al. Gentiopicroside and sweroside from Veratrilla baillonii Franch. induce phosphoryla tion of Akt and suppress Pck1 expression in hepatoma cells[J]. Biochem Cell Biol, 2016, 94(3): 270-278. DOI:10.1139/bcb-2015-0173 |
| [6] |
Ma LQ, Yu Y, Chen H, et al. Sweroside alleviated aconi tine-induced cardiac toxicity in H9c2 cardiomyoblast Cell Line[J]. Front Pharmacol, 2018(9): 1138. |
| [7] |
任莹璐, 王腾宇, 张惠敏, 等. 基于网络药理学预测的芪参颗粒干预过量异丙肾上腺素诱导小鼠心力衰竭的机制研究[J]. 中西医结合心脑血管病杂志, 2018, 17(5): 551-554. |
| [8] |
Yang QL, Yang F, Gong JT, et al. Sweroside ameliorates alpha-naphthylisothiocyanate-induced cholestatic liver injury in mice by regulating bile acids and suppressing proinflammatory responses[J]. Acta Pharmacol Sin, 2016, 37(9): 1218-1228. DOI:10.1038/aps.2016.86 |
| [9] |
Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Rev Esp Cardiol (Engl Ed), 2016, 69(12): 1167. |
| [10] |
Li C, Wang J, Wang Q, et al. Qishen granules inhibit myocardial inflammation injury through regulating arachidonic acid metabolism[J]. Sci Rep, 2016(6): 36949. |
| [11] |
Srikanthan K, Shapiro JI, Sodhi K. The Role of Na/K-ATPase signaling in oxidative stress related to obesity and cardiovascular disease[J]. Molecules, 2016, 21(9): 1172. DOI:10.3390/molecules21091172 |
| [12] |
Liu L, Wu J, Kennedy DJ. Regulation of cardiac remodeling by cardiac Na+/K+-ATPase isoforms[J]. Front Physiol, 2016, 7: 382. |
 2019, Vol. 38
2019, Vol. 38




