文章信息
- 王献瑞, 赵西子, 王晓明, 郭亚卿, 潘桂湘, 黄宇虹
- WANG Xianrui, ZHAO Xizi, WANG Xiaoming, GUO Yaqing, PAN Guixiang, HUANG Yuhong
- 固相萃取LC-MS/MS法测定疏血通注射液中次黄嘌呤浓度
- SPE-LC-MS/MS method for determination of hypoxanthine concentration in Shuxuetong injection
- 天津中医药大学学报, 2019, 38(5): 478-481
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(5): 478-481
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.05.16
-
文章历史
收稿日期: 2019-05-20
2. 天津中医药大学第二附属医院, 天津 300250
2. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
疏血通注射液是由水蛭[1-2]、地龙[3-4]两味动物类中药经低温提取和膜分离等工艺制成的中药复方制剂[5],具有活血化瘀、通经活络的功效,临床常用于瘀血阻络所致的缺血性中风病中经络急性期,症见半身不遂、口舌歪斜、语言謇涩[6-7]。疏血通注射液化学成分复杂,含有多肽、多糖、氨基酸、次黄嘌呤等物质[8-10],目前其真正发挥药效作用的物质基础尚不明确。据文献报道[11-12],次黄嘌呤具有明确的生物活性,能透过细胞膜进入细胞内,提高多种酶的活性,参与机体一些重要生理机能的调节。因此,本文以次黄嘌呤为指标成分,建立液相色谱串联质谱(LC-MS/MS)法对其进行定量分析,以期为疏血通注射液质量分析、评价以及质量标准的制定提供参考和依据。
目前,疏血通注射液中次黄嘌呤的测定,采用的大多是高效液相色谱-紫外法(HPLC-UV)[13-14],检测波长为254 nm。由于疏血通注射液中众多成分在254 nm处具有紫外吸收,需进行长达50 min的梯度洗脱,使次黄嘌呤与注射液中的其他干扰物质实现完全的色谱分离,次黄嘌呤出峰时间为13 min,整个分析周期相对较长[15]。LC-MS/MS具有高选择性、高灵敏度、高准确性的特点[21],尤其是具有独特的质量分辨能力,能在复杂基质中专属、灵敏、准确地检测某个或某几个成分。本研究采用固相萃取LC-MS/MS法测定疏血通注射液中次黄嘌呤浓度,分析时间缩短至3.50 min,次黄嘌呤出峰时间为1.02 min,可较大程度提高分析的效率。
1 仪器与试药 1.1 仪器Waters ACQUITY UPLC超高效液相色谱仪(美国waters公司),Waters Xevo TQ-S三重串联四极杆质谱仪(美国waters公司);MiniSpin Plus高速离心机(德国Eppendorf公司),AX205十万分之一电子天平(瑞士Mettler Toledo公司),Synergy UV超纯水机(美国Millipore公司)。
1.2 试剂和药品疏血通注射液(牡丹江友博药业股份有限公司)。次黄嘌呤标准品(德国Sigma公司,纯度99%以上),6-巯基嘌呤标准品(德国Aldrich公司,纯度98%以上)。甲醇(色谱纯,德国Sigma公司),甲酸(色谱纯,ROE公司),超纯水为Millipore超纯水系统制得。Sep-pak C18固相小柱(500 mg,waters公司)。
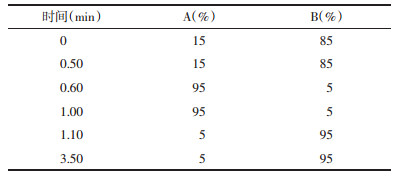
2 方法与结果 2.1 色谱条件Waters ACQUITY UPLC超高效液相色谱仪系统:二元泵系统、自动进样器、柱温箱,Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm)分析柱,BEH C18(5 mm×2.1 mm,1.7 μm)保护柱;流动相为甲醇(A),0.1%甲酸水(B),流速:0.3 mL/min;柱温40 ℃,进样量2 μL,分析时间为3.50 min。梯度洗脱程序见表 1。
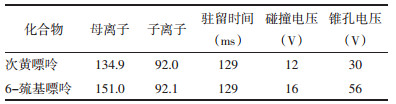
Waters Xevo TQ-S三重四极杆质谱,ESI负离子模式,MRM扫描方式。参数设置:毛细管电压3.0 kV,锥孔电压30 V,氮气压力7 psi,脱溶剂气温度400 ℃,脱溶剂气流速800 L/h,锥孔气流速150 L/h,碰撞气流速0.15 mL/min。化合物MRM方法参数见表 2。
精密称取次黄嘌呤适量,加甲醇制成100 μg/mL的次黄嘌呤储备液;另称取内标6-巯基嘌呤适量,少量甲醇溶解后用甲醇-水(含0.2%甲酸)(2:8)配制成125 μg/mL的6-巯基嘌呤储备液。用甲醇-水(2:8,含0.2%甲酸)稀释上述储备液,制得含次黄嘌呤系列浓度500、400、300、200、100 ng/mL的混合对照品溶液(含内标250 ng/mL)。
2.3.2 供试品溶液制备精密移取100 μL疏血通注射液和100 μL浓度为125 μg/mL的6-巯基嘌呤溶液,加于已活化的C18固相萃取小柱上,用300 μL水洗除杂,再用1.00 mL甲醇-水(2:8,含0.2%甲酸)洗脱,取洗脱液100 μL用甲醇-水(2:8,含0.2%甲酸)稀释10倍,摇匀,再取200 μL用甲醇-水(2:8,含0.2%甲酸)稀释5倍,混匀,即得。
2.3.3 阴性对照液制备取1 mL疏血通注射液,加黄嘌呤氧化酶37 ℃水浴温孵2 h,精密移取100 μL经酶促反应后的疏血通注射液,加于C18固相萃取小柱上,其余按“2.3.2”项下方法操作,制成不含次黄嘌呤的阴性对照液。
2.4 专属性试验取阴性对照液、对照品溶液和供试品溶液分别进样测定,次黄嘌呤、6-巯基嘌呤色谱峰形良好,测定无干扰,次黄嘌呤保留时间为1.02 min,6-巯基嘌呤保留时间为1.22 min,结果见图 1。
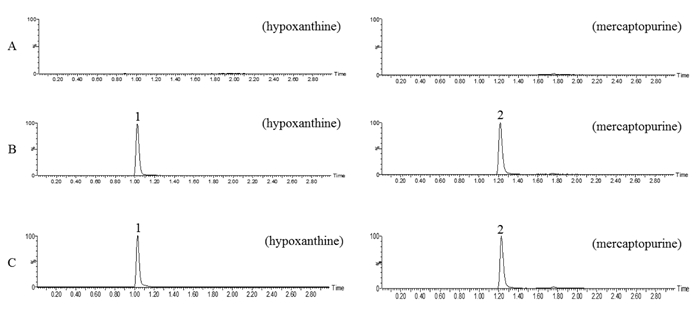
|
| 色谱峰1为次黄嘌呤,峰2为6-巯基嘌呤。A.阴性对照液,B.混合对照品溶液,C.含有内标的供试品溶液 图 1 疏血通注射液中次黄嘌呤及内标的MRM色谱图 |
吸取“2.3.1”项下系列浓度混合对照品溶液,进样2 μL测定,以次黄嘌呤质量浓度(X)为横坐标,待测物与内标的峰面积比值(Y)为纵坐标绘制标准曲线,进行线性回归,得回归方程Y=4.299×10-3X+9.246×10-3,r=0.999,表明次黄嘌呤在0.1~0.5 μg/mL范围内线性关系良好。
2.6 精密度实验精密吸取对照品混合溶液2 μL,按“2.1”项下色谱条件重复进样6次,测得次黄嘌呤与内标峰面积比值,相对标准偏差(RSD)为0.54%,表明仪器精密度良好。
2.7 重复性实验精密移取同一批号的疏血通注射液100 μL,按“2.3.2”项制备供试品溶液,平行6份,进样测定,RSD为0.86%,表明样品重现性良好。
2.8 稳定性实验室温下,精密吸取同一供试品溶液2 μL,分别在0、2、4、6、8、12、24、48 h进样,测次黄嘌呤与内标峰面积比值,RSD为0.84%。结果表明供试品溶液在48 h内稳定。
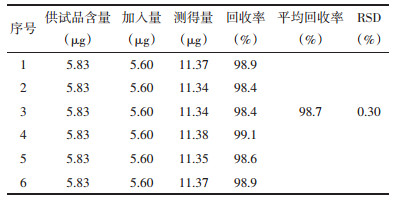
2.9 加样回收率实验精密移取同一批号已知含量的疏血通注射液6份,每份50 μL,精密加入浓度为200 ng/mL的对照品溶液28 μL,按“2.3.2”项下处理与测定,计算回收率,结果见表 3。
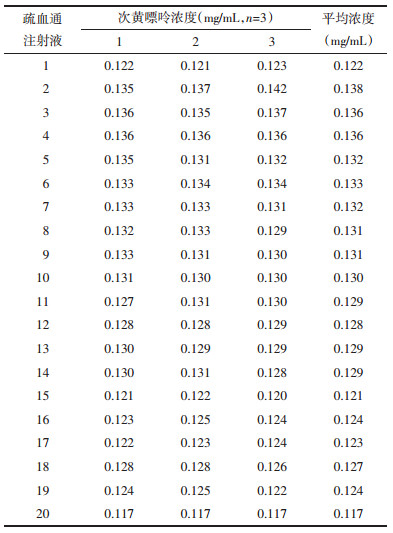
分别精密移取各批号疏血通注射液100 μL,按“2.3.2”项下方法制备供试品溶液,内标法计算次黄嘌呤浓度,结果见表 4。
实验分别考察了乙腈-水和甲醇-水等流动相系统,结果发现当使用乙腈-水或乙腈-水(含0.1%甲酸)为流动相时,次黄嘌呤峰形尖而细,但主峰后出现一个小的裂分峰;当使用甲醇-水为流动相时,次黄嘌呤峰形较宽,且裂分为两个大小相当的双峰,但若将水相改为0.1%甲酸水时,即以甲醇-水(含0.1%甲酸)为流动相,峰形对称尖锐且未出现裂分,响应较高。当以甲醇-水(含0.2%甲酸)为流动相时,其峰形和响应与甲醇-水(含0.1%甲酸)相当,考虑到色谱柱对酸的耐受程度,实验最终选择甲醇-水(含0.1%甲酸)作为流动相。
3.2 稀释溶剂的选择在供试品和对照品溶液制备过程中,发现终溶液如果所含甲醇比例较高,会因与流动相不匹配而产生强溶剂效应,导致色谱峰形的畸变;反之,如果采用纯水稀释系列溶液,则会因为内标在水中的溶解度低而析出形成浑浊液体。实验考察比较了甲醇-水系统(水相不含,或含有0.1%甲酸、0.2%甲酸、0.3%甲酸)不同比例5:5、4:6、3:7和2:8作为稀释剂时,次黄嘌呤和内标6-巯基嘌呤的峰形和响应,结果表明当以甲醇-水(2:8,含0.2%甲酸)为稀释剂时,二者的响应最高且峰形良好。
3.3 离子源的选择考察了待测物在ESI和APCI两种电离方式下的响应,发现采用APCI电离源,次黄嘌呤和6-巯基嘌呤的响应极其微弱,而采用ESI电离源二者的响应提高了几个数量级,这可能与次黄嘌呤和6-巯基嘌呤均为极性化合物有关,更适合选用ESI电离源。
3.4 电离方式的选择将次黄嘌呤和6-巯基嘌呤对照品溶液经由蠕动泵连续进样,比较正、负电离方式下化合物的响应,发现次黄嘌呤和6-巯基嘌呤在负离子模式下,均可产生响应较高且稳定的[M-H]-离子。因此选择在负离子模式下采用MRM扫描方式检测。
3.5 实验结果分析本文建立的分析方法可方便、准确测定疏血通注射液中次黄嘌呤浓度,为其提供技术支持,较常规UV检测方法可大大缩短分析时间。国家食品药品监督管理局颁布的WS3-548(Z-084)-2005(Z)文件,要求疏血通注射液中含次黄嘌呤不得低于0.05 mg/mL,由表 4可见,20个批次疏血通注射液中次黄嘌呤浓度稳定集中在0.117~0.138 mg/mL,即(0.129±0.005)mg/mL(n=20),表明产品质量合格、生产工艺稳定,次黄嘌呤可作为疏血通注射液质量分析、评价的指标成分。
4 结论本文所建立的固相萃取LC-MS/MS方法简便、准确、灵敏,可用于疏血通注射液中次黄嘌呤浓度测定。
| [1] |
张春和. 应用水蛭治疗泌尿男科疾病临床举隅[J]. 云南中医中药杂志, 2009, 30(9): 16-17. DOI:10.3969/j.issn.1007-2349.2009.09.013 |
| [2] |
梁进权, 王宁生, 宓穗卿. 水蛭抗凝抗血栓活性及其与品种、提取方法的关系[J]. 中西医结合心脑血管病杂志, 2009, 7(9): 1096-1098. DOI:10.3969/j.issn.1672-1349.2009.09.044 |
| [3] |
郭征兵. 中药地龙的药理作用及活性成分分析[J]. 当代医学, 2017, 23(19): 199-200. DOI:10.3969/j.issn.1009-4393.2017.19.108 |
| [4] |
王春玲. 中药地龙的活性成分与药理作用研究[J]. 亚太传统医药, 2015, 11(7): 53-54. |
| [5] |
方尚芬. 疏血通注射液治疗急性脑梗死64例疗效观察[J]. 中西医结合心脑血管病杂志, 2015, 13(2): 261-262. DOI:10.3969/j.issn.16721349.2015.02.050 |
| [6] |
周伟华. 疏血通注射液治疗急性脑梗死患者的临床疗效[J]. 中国药物经济学, 2015, 10(8): 65-67. |
| [7] |
曾青青. 疏血通治疗急性脑梗塞临床观察[J]. 深圳中西医结合杂志, 2016, 26(5): 33-34. |
| [8] |
王萌, 张健. 疏血通注射液的质量工艺与用药安全的相关性[J]. 中国中药杂志, 2012, 37(18): 2818-2819. |
| [9] |
于丽. 从疏血通看中药注射剂的提取工艺和质量控制[J]. 中国处方药, 2009(9): 54-55. |
| [10] |
严叶霞. 疏血通注射液与4种溶媒配伍稳定性考察[J]. 中国药师, 2013, 16(7): 1084-1085. DOI:10.3969/j.issn.1008-049X.2013.07.063 |
| [11] |
郑文安, 徐宁善. 苯二氮受体的内源性配体——次黄嘌呤核苷和乙烯3-羧基β-咔啉[J]. 生理科学进展, 1985(1): 65-67. |
| [12] |
龚慧敏.多聚次黄嘌呤胞嘧啶核苷酸poly(I: C)对人脐血树突状细胞功能影响的研究[D].福州: 福建医科大学, 2009.
|
| [13] |
袁晓环, 王春涛, 胡静. 高效液相色谱检测疏血通注射液中次黄嘌呤[J]. 中国生化药物杂志, 2008, 29(3): 192-194. |
| [14] |
孙运霞, 李静莉. 注射用疏血通的质量标准研究[J]. 时珍国医国药, 2006, 17(3): 383-384. DOI:10.3969/j.issn.1008-0805.2006.03.039 |
| [15] |
吕小丽, 高庆宇. 液质联用仪器分析实验的开发和教学实践[J]. 化学教育, 2016, 37(22): 22-25. |
 2019, Vol. 38
2019, Vol. 38