文章信息
- 马丽, 李新悦, 梁春霞, 张兵, 刘静静, 祁东利, 刘志东
- MA Li, LI Xiyue, LIANG Chunxia, ZHANG Bing, LIU Jingjing, QI Dongli, LIU Zhidong
- 热熔挤出技术制备小檗红碱固体分散体及其体外评价
- Preparation and in vitro evaluation of berberrubine solid dispersion
- 天津中医药大学学报, 2019, 38(5): 501-505
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(5): 501-505
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.05.21
-
文章历史
收稿日期: 2019-06-10
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 301617
2. Tianjin State Key Laboratory of Modern Chinese Medicine-Province and Ministry Co-Established State Key Laboratory Cultivation Base, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
小檗红碱(Berberrubine)是一类异喹啉类生物碱[1],主要存在于黄连、黄柏等中药[2]。但因其含量较低,一直未能引起广泛关注。近年来,随着对小檗碱作用机制的深入研究,作为小檗碱体内重要代谢产物之一的小檗红碱也随之引起了科研工作者的重视。研究表明,小檗红碱具有抗炎、抑菌、抗肿瘤和降血糖等药理活性,但因其具有一定肾毒性及较低的生物利用度,从而严重制约了小檗红碱的临床应用[3-4]。
据报道,固体分散体(SD)不但可以有效地提高难溶性药物的溶解度、增加药物稳定性及提高生物利用度[5],而且可以通过选择相应的载体达到缓、控释作用[6-7]。近年来,SD作为速释、缓释及局部给药制剂的中间体受到广泛的关注。热熔挤出(HME)技术是制备固体分散体的方法之一,该法所制备的固体分散体具有密度高和孔隙率低的特点,已广泛应用于缓、控释给药系统的制备[8]。与溶剂法、溶剂-熔融法、熔融法、超临界CO2萃取法和喷雾(冷冻)干燥法等传统方法相比较具有操作方便、工艺简洁、不使用有机溶剂、自动化程度高及适合工业化生产等优点[9]。
本研究以Soluplus®为药物载体,采用HME技术制备小檗红碱固体分散体。采用差示扫描量热分析仪、粉末X射线衍射仪、扫描电子显微镜、傅里叶变换红外光谱仪对制备的小檗红碱固体分散体进行表征,并考察挤出物在不同介质中的溶解度和体外溶出度,为小檗红碱的相关制剂研究提供参考。
1 材料与仪器 1.1 仪器高效液相色谱仪(Agilent 1260,安捷伦科技有限公司);十万分之一天平(XP 205,Mettler Toledo);超纯水系统(Milli-Q,美国Millipore公司);HME双螺杆热熔挤出机(安拓思纳米技术有限公司);差示扫描量热仪(Jade DSC,美国Perkin Elmer公司);扫描电子显微镜(JSM-7500F,日本日立公司);透皮扩散实验仪(TK-20B,上海锴凯科技贸易有限公司);粉末X射线衍射仪(D/Max-2500PC,日本理学股份公司);傅里叶红外光谱仪(Nicolet 6700,美国赛默飞世尔科技有限公司);全自动智能溶出仪(DT-820,德国ERWEKA公司)。
1.2 药品与试剂小檗红碱对照品(天津中新药业团股份有限公司,纯度97%);小檗红碱(由天津中医药大学中药学院邱峰教授课题组提供,纯度>80%);Soluplus®(德国巴斯夫股份公司);乙腈(Fisher Chemical);甲酸(东京化成工业株式会社);甲醇(天津市康科德科技有限公司);盐酸(利安隆博华医药化学有限公司);结晶乙酸钠(天津市风船科技有限公司);磷酸二氢钾(天津市风船科技有限公司)。
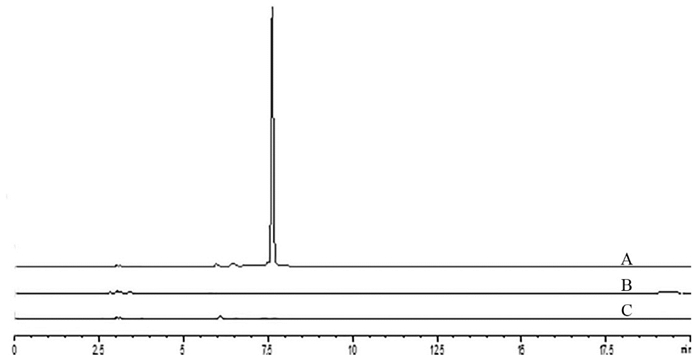
2 方法与结果 2.1 小檗红碱分析方法的建立 2.1.1 色谱条件采用Agilent Eclipse Plus C18(250 mm×4.6 mm,5 μm)色谱柱;以0.1%甲酸水(A)-乙腈(B)为流动相,进行梯度洗脱,0~10 min,95%~10% A;10~15 min,10%~95% A;15~20 min,95% A;检测波长340 nm;流速1 mL/min;柱温30 ℃;进样量10 μL。HPLC色谱图见图 1,溶剂与Soluplus®均对小檗红碱含量测定无干扰。
|
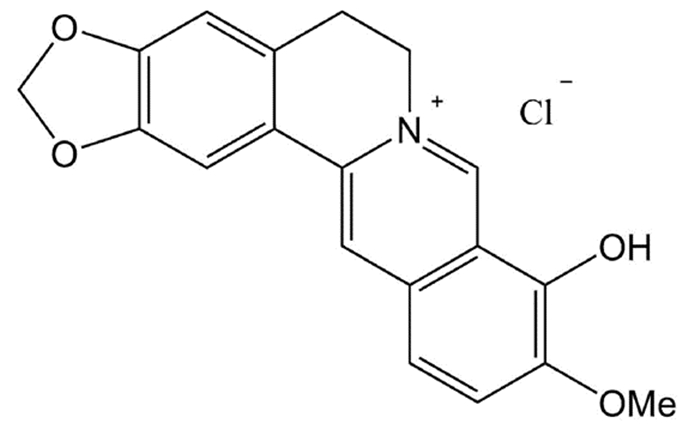
| 图 1 小檗红碱化学结构式 |
|
| 小檗红碱对照品(A),空白甲醇(B),辅料Soluplus®(C) 图 2 测定甲醇中小檗红碱含量的专属性图谱 |
精密称取小檗红碱对照品适量,加甲醇溶解并定容于10 mL量瓶中,作为储备液,备用。用甲醇将储备液分别稀释成每1 mL含小檗红碱2.08、4.16、20.80、41.60、83.20、104.00、166.40、208.00 μg的溶液,按“2.1.2”项下色谱条件测定小檗红碱的峰面积。以样品色谱峰面积为纵坐标(
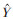
分别取2.1.2项下低(2.08 μg/mL)、中(20.80 μg/mL)、高(166.40 μg/mL)3种浓度的小檗红碱对照品溶液连续进样6次,考察精密度。结果低、中、高3种浓度精密度RSD分别是0.14%、0.06%、1.86%,表明仪器精密度良好。
2.1.4 稳定性实验分别取2.1.2项下低(2.08 μg/mL)、中(20.80 μg/mL)、高(166.40 μg/mL)3种浓度的小檗红碱对照品溶液,于0、2、4、6、8、12、24 h测定,评价药物稳定性。结果RSD分别是1.04%、0.43%、2.60%,表明对照品溶液24 h内稳定。
2.1.5 回收率实验分别取2.1.2项下低(2.08 μg/mL)、中(20.80 μg/mL)、高(166.40 μg/mL)3种浓度的小檗红碱对照品溶液,按药辅比为1:6(小檗红碱:Soluplus®=1:6)加入Soluplus®,考察回收率。平均回收率为99.46%,RSD为0.62%。
2.2 小檗红碱固体分散体的制备分别称取小檗红碱10 g,Soluplus® 30 g过筛混合均匀,得到物理混合物,待仪器升至设定温度后,将物理混合物投入加料斗中挤出,室温放置24 h,粉碎并过60目筛,制得小檗红碱固体分散体A,备用。另取小檗红碱10 g,Soluplus® 60 g,同法制备小檗红碱固体分散体B,备用。
2.3 固体分散体表征 2.3.1 扫描电子显微镜观察将小檗红碱、Soluplus®、物理混合物、小檗红碱固体分散体A和小檗红碱固体分散体B取适量均匀撒在贴有导电胶带的样品座上,喷金,真空干燥后置SEM下,于不同倍率下观察所得粒子的表面形态。
由图 3可知,小檗红碱(A)以针状结晶体存在,Soluplus®(B)为椭圆形块状晶体结构,物理混合物(C)中两种形态的晶体均存在,而固体分散体中无独立存在的小檗红碱针状型晶体,成无规则形态,凝集成块,其药物可能以非晶形态吸附在载体表面。

|
| 图 3 小檗红碱(A),载体Soluplus®(B),物理混合物(C),小檗红碱固体分散体A(D)与小檗红碱固体分散体B(E)的扫描电镜图 |
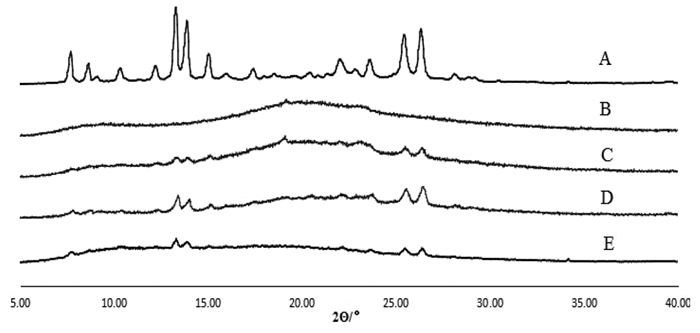
精密称取小檗红碱、Soluplus®、物理混合物、小檗红碱固体分散体A和小檗红碱固体分散体B 5~10 mg置铝制样品盘中,压制后放入DSC的样品室中,并放置参比盘。保持干燥的氮气环境(30 mL/min),待系统稳定后,以10 ℃/min的速度从30 ℃升温到350 ℃,记录样品的热力学曲线,见图 5。
|
| 图 5 小檗红碱(A),载体Soluplus®(B),物理混合物(C),小檗红碱固体分散体A(D)与小檗红碱固体分散体B(E)的X射线衍射图谱 |
图 4所示,小檗红碱在300 ℃右有一明显的晶体吸热峰,Soluplus®在70 ℃和320 ℃左右有一明显的放热峰,物理混合物中放热峰明显,小檗红碱固体分散体中小檗红碱的吸热峰消失,表明小檗红碱以非晶体形态分散于载体中。
|
| 图 4 小檗红碱(A),载体Soluplus®(B),物理混合物(C),小檗红碱固体分散体A(D)与小檗红碱固体分散体B(E)的DSC图谱 |
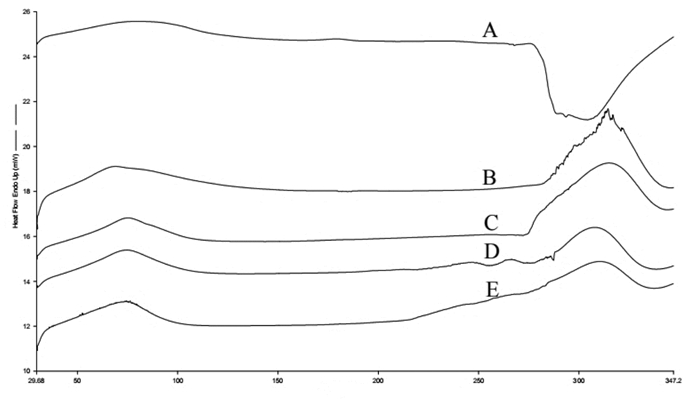
以铜-Kα射线为辐射源,辐射强度设置为40 kV和100 mA,扫描步长0.02°,扫描范围5°~80°,扫描速度5 °/min,对小檗红碱、Soluplus®、物理混合物、小檗红碱固体分散体A和小檗红碱固体分散体B进行X射线衍射分析。
图 5显示,小檗红碱的峰值为7.72°、8.64°、12.2°、13.28°、13.88°、15.04°、22.04°、22.64°、25.44°和26.32°,说明其为晶体结构,因而溶解度较低。Soluplus®的峰值为9.04°,在物理混合物中小檗红碱的衍射峰变得微弱,在固体分散体B中小檗红碱的主峰更微弱甚至部分峰消失,表明小檗红碱以非晶体形态分散于载体中。
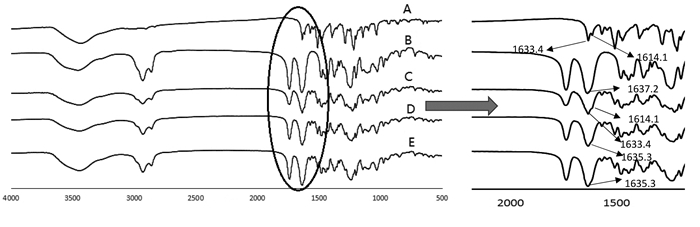
2.3.4 傅里叶变换红外光谱分析分别取小檗红碱、Soluplus®、物理混合物、小檗红碱固体分散体A和小檗红碱固体分散体B适量,与干燥的KBr均匀混合压片置于红外光谱仪中,在400~4 000 cm-1范围内扫描,得到相应红外谱图。
图 6显示,小檗红碱的C=O伸缩振动峰在1 633.41 cm-1、N-H弯曲振动峰在1 614.13 cm-1;Soluplus®的C=O伸缩振动峰在1 637.27 cm-1;物理混合物中药物的C=O和N-H峰与小檗红碱的位置一样,而固体分散体的图谱,小檗红碱的N-H峰消失,且图谱中Soluplus®的特征峰明显,说明药物与载体之间可能形成氢键,药物是均匀地分散在载体中。
|
| 图 6 小檗红碱(A),载体Soluplus®(B),物理混合物(C),小檗红碱固体分散体A(D)与小檗红碱固体分散体B(E)的傅里叶变换红外光谱图谱 |
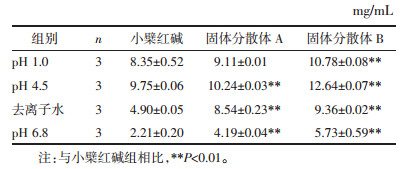
分别取过量的小檗红碱、小檗红碱固体分散体A、小檗红碱固体分散体B置于西林瓶中,分别加入10 mL的去离子水、0.1 mol/L的稀盐酸溶液、pH 4.5的醋酸-醋酸钠溶液及pH 6.8的磷酸盐缓冲液,用保鲜膜封口,放入透皮扩散实验仪中。在(37.0±0.5)℃、100 r/min条件下搅拌24 h,搅拌结束后静置2 h。取适量上清液过0.45 μm的微孔滤膜,续滤液以相应溶媒稀释至适宜浓度后进行测定,并计算小檗红碱的饱和溶解度,结果见表 1。
小檗红碱固体分散体较小檗红碱在4种介质中的溶解度均有所提高,特别是在pH 6.8的磷酸缓冲液中,小檗红碱固体分散体A的溶解度较小檗红碱提高了1.90倍,小檗红碱固体分散体B的溶解度较小檗红碱提高了2.59倍。
2.5 溶出度的测定分别精密称取适量小檗红碱、小檗红碱固体分散体A、小檗红碱固体分散体B及其物理混合物(约相当于小檗红碱15 mg)于硬壳胶囊中,按《中华人民共和国药典》2015版第4部制剂通则项下0931溶出度与释放度测定第一法测定。以0.1 mol/L的稀盐酸900 mL为溶出介质,转速为100 r/min,温度为(37.00±0.5)℃,依法操作。在5、10、15、30、45、60、120、240、360、480、720 min时取样,每次取样5 mL(即时补充同温溶出介质5 mL),经0.45 μm的滤膜过滤后,按2.1.1项下方法测定续滤液,并计算各时间点的药物累积溶出度。
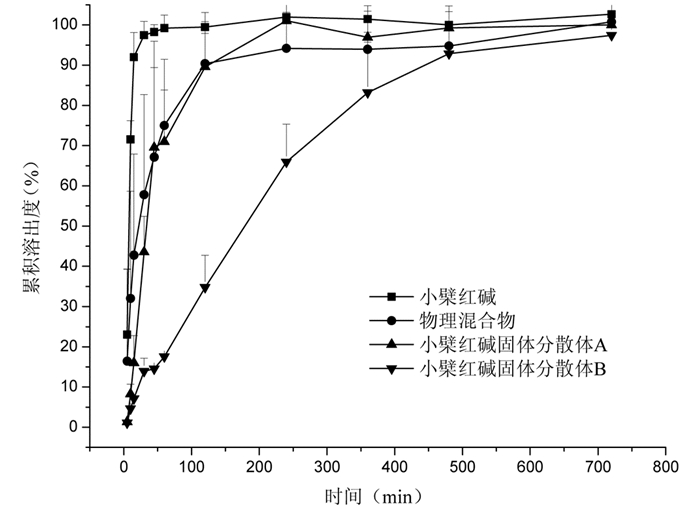
|
| 图 7 小檗红碱,物理混合物,固体分散体A及固体分散体B在0.1 mol/L的盐酸中的累计溶出度(n=3,x±s) |
在0.1 mol/L稀盐酸中,小檗红碱在短时间内释放速度迅速,在15 min左后累计溶出度达到90%,不利于临床应用[10]。小檗红碱与Soluplus®的物理混合物在120 min内累积溶出度达到90%,固体分散体A在240 min累积溶出度接近90%,固体分散体B在480 min累积溶出度接近90%。结果显示小檗红碱固体分散体延缓了小檗红碱的释放,有利于维持血药浓度平衡,可降低给药频率,减轻肾脏负担。
3 讨论热熔挤出过程中,适宜的载体浓度、黏度与取代基不仅会影响药物的释放[11],而且可以有效防止药物“再结晶”,从而增加其稳定性。Soluplus®是一种专门用于热熔挤出技术的两亲性高分子聚合载体,是聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物,该载体玻璃化转变温度低,有很好的抑晶作用,主要用于提高难溶性药物溶解性和增加药物稳定性[12-13]。
通过热熔挤出技术,以Soluplus®作为载体制备了载体与药物质量比为1:3和1:6的A、B两种固体分散体。SEM、DSC、XRD和FT-IR理化表征的结果显示,小檗红碱固体分散体中小檗红碱以非晶态分散于载体Soluplus®中。溶解度实验结果显示,小檗红碱固体分散体B较原料药溶解度提高2.59倍,差异具有显著性。体外释放度实验结果表明,所制备的小檗红碱固体分散体B具有一定的缓释效果。
本实验制备的小檗红碱固体分散体能显著提高药物溶解度,且能延缓体外释放行为。推测该固体分散体可提高小檗红碱口服生物利用度,可为小檗红碱的应用与相关制剂研究提供参考。
| [1] |
Kobayashi Y, Yamashita Y, Fujii N, et al. Inhibitors of DNA topoisomerase Ⅰ and Ⅱ isolated from the Coptis rhizomes[J]. Planta Medica, 1995, 61(5): 414-418. DOI:10.1055/s-2006-958127 |
| [2] |
Cui HS, Hayasaka S, Zhang XY, et al. Effect of berberrubine on interleukin-8 and monocyte chemotactic protein-1 expression in human retinal pigment epithelial cell line[J]. Life Sciences, 2006, 79(10): 949-956. DOI:10.1016/j.lfs.2006.05.004 |
| [3] |
Park KD, Lee JH, Kim SH, et al. Synthesis of 13-(Substituted benzyl) Berberine and Berberrubine Derivatives as Antifungal Agents[J]. Cheminform, 2006, 16(15): 3913-3916. |
| [4] |
杨勇, 张保顺, 李学刚. 小檗红碱毒性的初步研究[J]. 南方医科大学学报, 2009, 29(11): 2349-2350. DOI:10.3321/j.issn:1673-4254.2009.11.025 |
| [5] |
Kamble R, Sharma S, Mehta P. Norfloxacin mixed solvency based solid dispersions:An in-vitro and in-vivo investigation[J]. Journal of Taibah University for Science, 2017, 11(3): 512-522. DOI:10.1016/j.jtusci.2016.11.003 |
| [6] |
汤伟, 庞建国, 朱兴一. 硫辛酸缓释固体分散体的制备及其体外释放度的考察[J]. 中国新药杂志, 2017(14): 110-115. |
| [7] |
陈小云, 张振海, 郁丹红, 等. 丹参酮组分缓释固体分散体的研究[J]. 中草药, 2013, 44(17): 2391-2396. |
| [8] |
陈美婉, 陈文荣, 陈桐楷, 等. 热熔挤出技术制备固体分散体的应用研究[J]. 药学学报, 2012(2): 163-167. |
| [9] |
Stankovi M, Frijlink HW, Hinrichs WLJ. Polymeric formulations for drug release prepared by hot melt extrusion:application and characterization[J]. Drug Discovery Today, 2015, 20(7): 812-823. DOI:10.1016/j.drudis.2015.01.012 |
| [10] |
Zhao YQ, Yang N, Fei F, et al. Sensitive Analysis and Pharmacokinetic Study of Berberrubine Using LC-MS/MS[J]. Chinese Herbal Medicines, 2017, 9(3): 236-249. |
| [11] |
唐波, 张晶, 宋洪涛. 热熔挤出技术在口服缓控释制剂中的应用进展[J]. 解放军药学学报, 2011, 27(6): 544-547, 552. |
| [12] |
Mai K, Al-Taani B, Alsmadi M, et al. Enhancement of the dissolution and bioavailability from freeze-dried powder of a hypocholesterolemic drug in the presence of Soluplus[J]. Powder Technology, 2018(329): 25-32. |
| [13] |
Salawi AS. Nazzal S, The rheological and textural characterization of soluplus(R)/Vitamin E composites[J]. International Journal of Pharmaceutics, 2018, doi: https://doi.org/10.1016/j.ijpharm.2018.05.049.
|
 2019, Vol. 38
2019, Vol. 38