文章信息
- 石羡茹, 王泰一, 高佳明, 马玉玲, 李菊, 朱彦
- SHI Xianru, WANG Taiyi, GAO Jiaming, MA Yuling, LI Ju, ZHU Yan
- 从脑心轴解析多靶点抗心律失常中西药物的治疗前景
- Multi targeting anti-arrhythmic Chinese and western drugs: a therapeutic potential viewed from brain-heart axis
- 天津中医药大学学报, 2019, 38(5): 506-511
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(5): 506-511
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.05.22
-
文章历史
收稿日期: 2019-04-10
2. 天津国际生物医药联合研究院中药新药研发中心, 天津 300457;
3. 天津天士力控股集团有限公司研究院, 天津 300410
2. Tianjin International Joint Academy of Biomedicine, Tianjin 300457, China;
3. Tianshili pharmaceutical group co., Ltd., Tianjin 300410, China
心律失常是心血管疾病中最普遍也最常见的疾病,中国每年约有54万人死于心脏猝死,而将近90%的猝死原因是心律失常[1]。心脏活动的起源和传导障碍导致心脏搏动的频率和节律异常会直接造成心律失常,但除此之外交感神经,副交感神经等也进行着对心律的调控,且其机制复杂,研究发现卒中病理下会经由神经递质,免疫系统,电解质途径等对心脏功能产生一定的影响[2]。临床手术,药物治疗等传统治疗心律异常的手段多在病人明显感到不适时,通过现代医学手段来进行诊断治疗,但往往效果欠佳。因此了解调节心律的其他途径或有助于从未病角度来防治卒中患者心律异常的发生,同时也可从非离子通道途径来寻求治疗心律失常的潜在靶点,本综述现以卒中为主的大脑功能异常对心律的影响途径以及可以以脑心轴相关靶点作为心律失常治疗靶点的药物应用前景做一综述。
1 方法通过Pubmed和中国知网检索从1995到2018年3月所有关于中风与心律失常的研究,使用以下关键词进行检索:“心脑关系”“脑出血”“脑缺血”“颅内出血”“中风”“心律失常”“长QT综合症”“室性心动过速”“离子通道”“自主神经系统”“中医药”。对包含以上关键词的文献及这些文献的参考文献进行进一步的检索。
2 现有抗心律失常药物的作用机理及分类演化钠,钾,钙等离子通道相关电生理机制异常是引起心律失常的基础机制,因此对常见心律失常的分类便是据异变在心脏的部位和心律失常的速度或节律来进行的[3]。抗心律失常药物的经典分类是根据Vaughan Williams分类系统所进行的。4类抗心律失常药物的作用方式是对Na+,K+,Ga2+通道功能和β肾上腺素能受体进行相应的调控。此经典的分类方法为抗心律失常药物根据其对动作电位的影响,药物成分,药物与心律失常的关系进行分类提供了科学依据[4]。在Taormina,Sicily会议中提出的对抗心律失常药的Sicilian Gambit分类法保留了Vaughan Williams的分类并在其基础上相应的增加了0级HCN离子通道阻断剂,Ⅴ类作用于机械门控型离子通道的药物,Ⅵ类介导细胞间电偶联的药物,和Ⅶ类在信号传导过程中通过改变结构重塑而对心律产生影响的药物[4]。修订后的方案或有助于对正在调查中的新药进行分类。
3 大脑对心律的调节作用离子通道的缺陷与心律失常的发生密切相关,越来越多的研究表明多分子和多靶点尤其以脑心轴为主的相关靶点在心律失常的发生中起着重要的作用。心脏与大脑的相互作用会导致两者中一个处于疾病状态时,另一个的功能也受到影响,心脑两者受着共同的调节系统的影响,与中医理念所提出的“心脑共主神明”不谋而和。Byer[5]首次报告了大脑血管疾病会引起心肌损伤和心律不齐。脑心轴变化引起的生理学病变包括大脑病变诱发的自主神经失调、神经内分泌调节紊乱;全身炎症过程;微泡;微RNA;肠道微生物组;免疫反应等。经由这些途径都会影响心脏的生理功能[2]。一些急性脑部患者可能会同时伴随有心律失常,心肌酶增加甚至心脏猝死等临床反应[6]。基于此深入研究心脑相互影响的机制将对临床心脏疾病的治疗,预防与保护带来新的可能性。作为一种极性脑血管疾病脑卒中已成为全球第二大致死性疾病因此本综述将以卒中为背景来讨论大脑功能异常对心律的影响。
4 卒中与心律失常的关系脑卒中是全球范围内死亡率和致残率均较高的疾病,大量的临床及实验表明中风即使在没有危险因素和预先存在的心脏病的情况下也会导致心功能不全,特别是在老年卒中患者[7-11]。在使用抗凝药物前,房颤患者患卒中的风险是常见致卒中病因导致卒中的4~5倍[12]。因此卒中与心律失常往往可能同时发生在患者身上。了解其相互作用机理对临床卒中与心律失常的治疗与用药将提供很大的帮助。本综述将通过以下几个方面重点介绍以脑卒中为主的脑损伤对心脏功能的影响并重点论述可以以脑为靶向治疗心律失常的一些多靶点复方药的临床应用前景。
5 卒中背景下心律失常的病理生理学研究通常将卒中后的直接死亡原因归于神经损伤,而临床研究发现卒中后引起的心血管并发症已成为造成卒中后死亡的第二大原因。在过去的几十年里,中风后心律失常的发病机制引起了国内外广泛的关注。中风后引起心律失常与下丘脑-垂体-肾上腺轴(N-甲基D-天冬氨酸受体),自主神经系统(岛叶皮质,儿茶酚胺),电解质,免疫应答等途径密切相关(见图一)。本综述将中风与心律失常的关系分以下部分进行讨论。
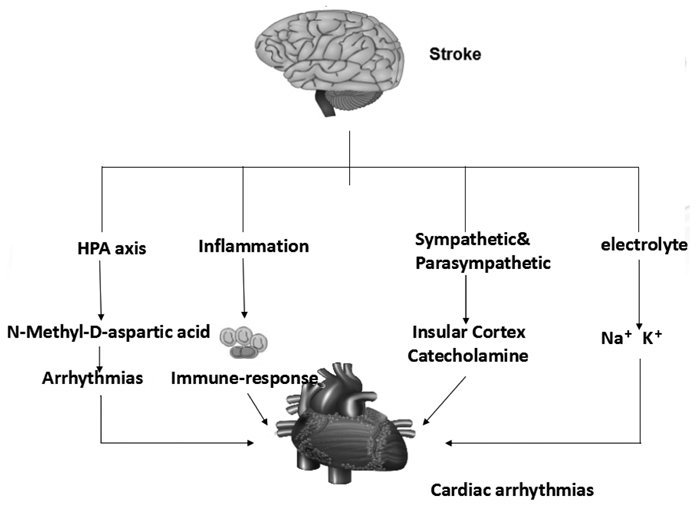
|
| 图 1 卒中背景下大脑对心脏的影响途径 卒中后主要会经由下丘脑-垂体-肾上腺轴,免疫应答,交感副交感神经系统,电解质等相关途径影响心律 |
缺血性中风后下丘脑室核会激活N-甲基-D-天冬氨酸受体[13]。N-甲基-D-天冬氨酸受体是离子型谷氨酸受体,对钾离子和钙离子具有高度渗透性。N-甲基-D-天冬氨酸受体的激活会导致瞬时外向钾离子和L型钙离子的下调,导致心室心律失常[13-14]。瞬时外向钾电流在动作电位Ⅰ期复极中发挥重要作用,瞬时外向钾电流的下调会造成动作电位时程的延长,在临床上会引起心肌梗死,心房颤动,心力衰竭等心脏疾病。另下丘脑室旁核神经元NMDAR的激活可导致血管紧张素Ⅱ介导的高血压[15]。
5.2 自主神经系统 5.2.1 岛叶皮质岛叶皮质在自主神经系统平衡中起关键作用。Oppenheimer等人的早期研究揭示了岛叶皮质,自主神经改变和心律异常间的关系,研究使用大鼠模型,在电刺激前岛叶皮质后在所记录的心电图上观察到类似于缺血性中风后所有的心律失常现象。13只实验动物中有12只出现不同程度的心律失常和传导障碍,如p波改变,渐进性QRS复合波扩张和室性早搏,对照动物并未发生明显的心电图改变。这些发现确定了调节中风后患者心律失常的中枢和外周心脏自主神经改变的皮质位置[13]。Sander等人的进一步研究特别报道出与其他部位相比,岛叶梗塞患者QT间期延长和VA的发生率更高[16]。
5.2.2 儿茶酚胺经过对出血性卒中患者进行研究观察发现血浆儿茶酚胺浓度的升高和缺血性中风后心律失常的发生率成正比,且有若干研究发现蛛网膜下腔出血后血浆中去甲肾上腺素及其相关代谢物浓度增加,表明中风后致心律失常交感神经活性的增强与体循环中儿茶酚胺水平的增加相关[17-19]。中风后儿茶酚胺激增会直接或通过后反应引起心律失常,临床上,儿茶酚胺激增后常呈现QTc间期延长和室性早搏[20-23],在正常心脏收缩过程中环磷酸腺苷(cAMP)通过激活β受体打开钙通道。钙的流入和钾的流出会刺激肌动蛋白,使心肌收缩,细胞内钙离子的吸收会促进肌肉的放松,急性中风会提高交感神经张力,从而促进儿茶酚胺的释放[24],过量儿茶酚胺过度激活β-肾上腺素能受体可导致钙通道强直性开放导致细胞内钙离子积累,胞内高钙离子浓度及肌肉无力放松会导致代谢不平衡和细胞死亡[25]。儿茶酚胺激增的后反应是心肌中儿茶酚胺过量会导致冠状血管收缩,心肌缺血,从而破坏心肌细胞结构引发心律失常[26]。蛛网膜下腔出血后也发现患者会出现局部性肌细胞溶解和肌原纤维变性[26-27],而肌原纤维变性主要是心内膜下的,因此会使心脏传导系统出现障碍引起心律失常[26]。
5.3 免疫应答反应卒中会增强巨噬细胞向心脏的浸润,并增加心肌细胞中IL-1β、IL-6、MCP-1、TGF-β,白细胞等炎症因子水平[28]。并且会在一定程度上诱导心肌纤维化和心肌肥厚。TGF-β通过调节心肌成纤维细胞的分化、迁移和胶原分泌而介导心肌发生纤维化。心肌巨噬细胞的增加与MCP-1有关,MCP-1会促进单核细胞向心脏的迁移[28],脑损伤会诱发心肌氧化应激反应从而导致心肌细胞受损[2, 29-30],受损心肌细胞可表达MCP-1,继而促进单核细胞进入心脏[31],这些炎症细胞又可在心脏中分泌MCP-1,加剧心肌损伤,继而导致一连串的炎症反应。心肌巨噬细胞会经由Toll样受体(TLR2)和NLRP3炎症小体而增加心肌1L-1β的产生,1L-1β会使动作电位时程延长,且会导致心肌细胞中钾电流的下调[32]。有临床和实验数据表明卒中患者的血脑屏障功能会有相应减弱[33]继而引起全身炎症反应的可能性会加大。因此抑制TGF-β,MCP-1表达,抑制巨噬细胞浸润会是预防或减少卒中后心脏功能出现障碍的治疗靶点。
5.4 电解质紊乱卒中后交感神经过度激活也会导致电解质紊乱,如出现低钾血症和低镁血症。先前的研究发现电解质紊乱与QTc间期延长,TdP和其他类型心律失常存在关联[34-37];儿茶酚胺持续刺激与膜Na+/K+-ATP酶有关的β-肾上腺素受体可引起钾离子内流,导致低血钾症,低血钾症将导致心室复极时间延长,传导减慢和起搏器活动异常从而引起心律失常。此外缺镁会损害膜Na+/K+ ATP酶的功能,从而阻碍肾小管对K+的重吸收,造成代谢性碱中毒,而代谢性碱中毒会将K+驱入细胞以换取H+的向外运动而进一步加剧低血钾症。基于此在对心律失常患者进行治疗时可适当给予离子补充剂作为辅助治疗。
6 多靶点抗心律失常药物作用机制探讨为避免单一离子通道调节剂在抗心律失常的同时引发新的心律失常,临床常将不同的抗心律失常药物联合应用使其作用集中在一组特定的细胞和组织上,这些效应分别影响心脏的自动节律性、动作电位的生成和动作电位的传导,现报道已有有效单体及组分药可实现同时作用于对心律有调控作用的多种离子通道。胺碘酮衍生物决奈达隆就是一种多离子通道抑制剂其电生理效应范围广范,可阻断心房肌细胞的L型钙电流、延迟整流钾电流(IKR,IKS)和内向整流钾电流(IK1)[38]。还能有效阻断离体心房肌细胞的心肌钠电流(INa)[39]。中浓度的决奈达隆还可阻断HCN4转染细胞的起搏电流[40]。与其他心律控制药物相比,决奈达隆在减少药源性心律失常和降低死亡率等方面效果显著[41-43]。且临床数据表明决奈达隆用药患者同等条件下与服用其他抗心律失常药的患者相比房颤同时伴随心肌梗死和卒中的风险也较低[39]。AHA/ACC/HRS和CCS指南已将决奈达隆作为在无结构性心脏病的患者中维持房颤后心律的一线药物疗法[44]。
抗心律失常复方中药稳心颗粒也是临床常用的多靶点抗心律失常药且其同时具有治疗和保护心肌的双重作用[45],从各种动物和细胞研究中积累的证据表明稳心颗粒可有效缩短QRS和QT间期,减少心房/心室颤动发生率和减慢室性心动过速[46]。其对峰值钠电流(Ina)、晚钠电流(Nal)、瞬时外向钾电流(ITO)、L型钙电流(ICaL),起搏电流(IF)都有调节作用[46],且可通过抑制炎症反应、减少氧化应激、调节血管运动紊乱、降低细胞凋亡、抗内皮损伤、抗心肌缺血、抗心肌纤维化、抗心肌肥厚等发挥其心脏保护作用[46]。
7 以脑为靶向治疗心律失常的复方中药,单体药物应用现状与应用前景在临床个体化精准医疗的今天决奈达隆,稳心颗粒等可实现多靶点治疗效果的抗心律失常药已成为国际临床用药的最新要求。基于心脑相互作用的多面性,在以脑心轴为靶点治疗心律失常方面已有研究报道多靶点中药复方药丹红注射液不仅有改善脑梗,保护血脑屏障,抑制络氨酸羟化酶活性等脑保护作用[47],而且有降低心肌梗死模型中PCK蛋白浓度,下调心肌β1肾上腺素能受体的高表达等心脏保护作用。其可通过β肾上腺素能通路有效改善因卒中而引起的心脏异常情况。临床抗心律失常药除决奈达隆,稳心颗粒等多离子通道靶点抗心律失常药可作为一线用药外,基于引起心律失常的其他原因,在治疗心律失常尤其是卒中引起的心律失常时可联合应用β受体阻断剂,N-甲基-D -天冬酸受体阻断剂等β肾上腺素受体通路相关靶点治疗药物,并可口服钾离子补充剂作为辅助治疗以实现广泛意义上的多靶点全方位治疗。
8 结语除离子通道异常会影响心律失常外,脑心轴为主的功能异常也成为造成心律失常一大原因。多靶点抗心律失常的中西药较单一靶点抗心律失常药物的效果更佳且致心律失常副作用较轻,因此有望在临床上得到更广泛的使用。而以脑心轴为靶向的β肾上腺素受体通路相关靶点抗心律失常药物的使用将使得对多靶点抗心律失常药物的界定不再局限于心肌细胞离子通道层面。
| [1] |
Fu DG. Cardiac arrhythmias:diagnosis, symptoms, and treatments[J]. Cell biochemistry and biophysics, 2015, 73(2): 291-296. |
| [2] |
Chen Z, Venkat P, Seyfried D, et al. Brain-Heart Interaction[J]. Circulation research, 2017, 121(4): 451-468. DOI:10.1161/CIRCRESAHA.117.311170 |
| [3] |
Wu Y, Li J, Xu L, et al. Mechanistic and therapeutic perspectives for cardiac arrhythmias:beyond ion channels[J]. Science China Life sciences, 2017, 60(4): 348-355. DOI:10.1007/s11427-016-9005-6 |
| [4] |
Lei M, Wu L, Terrar DA, et al. Modernized Classification of Cardiac Antiarrhythmic Drugs[J]. Circulation, 2018, 138(17): 1879-1896. DOI:10.1161/CIRCULATIONAHA.118.035455 |
| [5] |
Martins JB, Zipes DP. Effects of sympathetic and vagal nerves on recovery properties of the endocardium and epicardium of the canine left ventricle[J]. Circulation research, 1980, 46(1): 100-110. DOI:10.1161/01.RES.46.1.100 |
| [6] |
Egerer E, Siemonsen S, Erbguth F. Acute diseases of the brain and heart:A reciprocal culprit-victim relationship[J]. Medizinische Klinik, Intensivmedizin und Notfallmedizin, 2018, 113(6): 456-463. DOI:10.1007/s00063-018-0465-3 |
| [7] |
Burch GE, Meyers R, Abildskov JA. A new electrocardiographic pattern observed in cerebrovascular accidents[J]. Circulation, 1954, 9(5): 719-723. DOI:10.1161/01.CIR.9.5.719 |
| [8] |
Ay H, Koroshetz WJ, Benner T, et al. Neuroanatomic correlates of stroke-related myocardial injury[J]. Neurology, 2006, 66(9): 1325-1329. DOI:10.1212/01.wnl.0000206077.13705.6d |
| [9] |
Oppenheimer SM. Neurogenic cardiac effects of cerebrovascular disease[J]. Current opinion in neurology, 1994, 7(1): 20-24. DOI:10.1097/00019052-199402000-00005 |
| [10] |
Tokgozoglu SL, Batur MK, Topcuoglu MA, et al. Effects of stroke localization on cardiac autonomic balance and sudden death[J]. Stroke, 1999, 30(7): 1307-1311. DOI:10.1161/01.STR.30.7.1307 |
| [11] |
Mosterd A, Hoes AW. Clinical epidemiology of heart failure[J]. Heart (British Cardiac Society), 2007, 93(9): 1137-1146. DOI:10.1136/hrt.2003.025270 |
| [12] |
Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke:the Framingham Study[J]. Stroke, 1991, 22(8): 983-988. DOI:10.1161/01.STR.22.8.983 |
| [13] |
Jia S, Xia Q, Zhang B, et al. Involvement of the paraventricular nucleus in the occurrence of arrhythmias in middle cerebral artery occlusion rats[J]. J Stroke Cerebrovasc Dis, 2015, 24(4): 844-851. DOI:10.1016/j.jstrokecerebrovasdis.2014.11.025 |
| [14] |
Liu X, Shi S, Yang H, et al. The activation of N-methyl-daspartate receptors downregulates transient outward potassium and L-type calcium currents in rat models of depression[J]. American journal of physiology Cell physiology, 2017, 313(2): C187-C196. DOI:10.1152/ajpcell.00092.2017 |
| [15] |
Glass MJ, Wang G, Coleman CG, et al. NMDA Receptor Plasticity in the Hypothalamic Paraventricular Nucleus Contributes to the Elevated Blood Pressure Produced by An giotensin Ⅱ[J]. The Journal of neuroscience:the official journal of the Society for Neuroscience, 2015, 35(26): 9558-9567. DOI:10.1523/JNEUROSCI.2301-14.2015 |
| [16] |
Sander D, Klingelhofer J. Changes of circadian blood pressure patterns after hemodynamic and thromboembolic brain infarction[J]. Stroke, 1994, 25(9): 1730-1737. DOI:10.1161/01.STR.25.9.1730 |
| [17] |
Grad A, Kiauta T, Osredkar J. Effect of elevated plasma norepinephrine on electrocardiographic changes in subarachnoid hemorrhage[J]. Stroke, 1991, 22(6): 746-749. DOI:10.1161/01.STR.22.6.746 |
| [18] |
Dilraj A, Botha JH, Rambiritch V, et al. Levels of catecholamine in plasma and cerebrospinal fluid in aneurysmal subarachnoid hemorrhage[J]. Neurosurgery, 1992, 31(1): 42-50. |
| [19] |
Naredi S, Lambert G, Eden E, et al. Increased sympathetic nervous activity in patients with nontraumatic subarachnoid hemorrhage[J]. Stroke, 2000, 31(4): 901-906. |
| [20] |
Milic M, Bao X, Rizos D, et al. Literature review and pilot studies of the effect of QT correction formulas on reported beta2-agonist-induced QTc prolongation[J]. Clinical Therapeutics, 2006, 28(4): 582-590. DOI:10.1016/j.clinthera.2006.04.010 |
| [21] |
Lambert E, Du XJ, Percy E, et al. Cardiac response to norepinephrine and sympathetic nerve stimulation following experimental subarachnoid hemorrhage[J]. Journal of the Neurological Sciences, 2002, 198(1-2): 43-50. DOI:10.1016/S0022-510X(02)00073-4 |
| [22] |
Kawahara E, Ikeda S, Miyahara Y, et al. Role of autonomic nervous dysfunction in electrocardio-graphic abnormalities and cardiac injury in patients with acute subarachnoid hemorrhage[J]. Circulation Journal:Official Journal of the Japanese Circulation Society, 2003, 67(9): 753-756. DOI:10.1253/circj.67.753 |
| [23] |
Sato K, Masuda T, Izumi T. Subarachnoid hemorrhage and myocardial damage clinical and experimental studies[J]. Japanese Heart Journal, 1999, 40(6): 683-701. DOI:10.1536/jhj.40.683 |
| [24] |
Mertes P, Carteaux J, Jaboin Y, et al. Estimation of myocardial interstitial norepinephrine release after brain death using cardiac microdialysis[J]. Transplantation, 1994, 57(3): 371-377. DOI:10.1097/00007890-199402150-00010 |
| [25] |
Koppikar S, Baranchuk A, Guzman JC, et al. Stroke and ventricular arrhythmias[J]. International journal of cardiology, 2013, 168(2): 653-659. DOI:10.1016/j.ijcard.2013.03.058 |
| [26] |
Samuels MA. Neurogenic heart disease:a unifying hypothesis[J]. The American journal of cardiology, 1987, 60(18): 15-19. DOI:10.1016/0002-9149(87)90678-3 |
| [27] |
Todd GL, Baroldi G, Pieper GM, et al. Experimental catecholamine-induced myocardial necrosis. I. Morphology, quantification and regional distribution of acute contraction band lesions[J]. Journal of molecular and cellular cardiology, 1985, 17(4): 317-338. DOI:10.1016/S0022-2828(85)80132-2 |
| [28] |
Yan T, Chen Z, Chopp M et al. Inflammatory responses mediate brain-heart interaction after ischemic stroke in adult mice[J]. Journal of cerebral blood flow and metabolism, 2018, doi: 271678X18813317.
|
| [29] |
Zhao Q, Yan T, Li L et al. Immune response mediates cardiac dysfunction after traumatic brain injury[J]. Journal of neurotrauma, 2019, doi: org/10.1089/nea.2018.5766.
|
| [30] |
Larson BE, Stockwell DW, Boas S, et al. Cardiac reactive oxygen species after traumatic brain injury[J]. The Journal of Surgical Research, 2012, 173(2): e73-81. DOI:10.1016/j.jss.2011.09.056 |
| [31] |
Taghavi Y, Hassanshahi G, Kounis NG et al. Monocyte chemoattractant protein-1(MCP-1/CCL2) in diabetic retinopathy: latest evidence and clinical considerations[J]. 2019, 31(1): 42-55.
|
| [32] |
Monnerat G, Alarcon ML, Vasconcellos LR, et al. Macrophagedependent IL-1beta production induces cardiac arrhythmias in diabetic mice[J]. Stroke, 2016, 7: 13344. |
| [33] |
Kumar P, Shen Q, Pivetti CD, et al. Molecular mechanisms of endothelial hyperpermeability:implications in inflammation[J]. Expert Reviews In Molecular medicine, 2009, 11: e19. DOI:10.1017/S1462399409001112 |
| [34] |
Frangiskakis JM, Hravnak M, Crago EA, et al. Ventricular arrhythmia risk after subarachnoid hemorrhage[J]. Neurocritical Care, 2009, 10(3): 287-294. DOI:10.1007/s12028-009-9188-x |
| [35] |
Di Pasquale G, Pinelli G, Andreoli A, et al. Holter detection of cardiac arrhythmias in intracranial subarachnoid hemorrhage[J]. The American Journal of Cardiology, 1987, 59(6): 596-600. DOI:10.1016/0002-9149(87)91176-3 |
| [36] |
van den Bergh WM, Algra A, Rinkel GJ. Electrocardiographic abnormalities and serum magnesium in patients with subarachnoid hemorrhage[J]. Stroke, 2004, 35(3): 644-648. |
| [37] |
Fukui S, Otani N, Katoh H, et al. Female gender as a risk factor for hypokalemia and QT prolongation after subarachnoid hemorrhage[J]. Neurology, 2002, 59(1): 134-136. |
| [38] |
Gautier P, Guillemare E, Marion A, et al. Electrophysiologic characterization of dronedarone in guinea pig ventricular cells[J]. Journal of Cardiovascular Pharmacology, 2003, 41(2): 191-202. DOI:10.1097/00005344-200302000-00007 |
| [39] |
Lalevee N, Nargeot J, Barrere-Lemaire S, et al. Effects of amiodarone and dronedarone on voltage-dependent sodium current in human cardiomyocytes[J]. Journal of Cardiovascular Electrophysiology, 2003, 14(8): 885-890. DOI:10.1046/j.1540-8167.2003.03064.x |
| [40] |
Bogdan R, Goegelein H, Ruetten H. Effect of dronedarone on Na+, Ca2+ and HCN channels[J]. Naunyn-Schmiedeberg's archives of Pharmacology, 2011, 383(4): 347-356. DOI:10.1007/s00210-011-0599-9 |
| [41] |
Piccini JP, Hasselblad V, Peterson ED, et al. Comparative efficacy of dronedarone and amiodarone for the maintenance of sinus rhythm in patients with atrial fibrillation[J]. Journal of the American College of Cardiology, 2009, 54(12): 1089-1095. DOI:10.1016/j.jacc.2009.04.085 |
| [42] |
Freemantle N, Lafuente-Lafuente C, Mitchell S, et al. Mixed treatment comparison of dronedarone, amiodarone, sotalol, flecainide, and propafenone, for the management of atrial fibrillation[J]. Europace, 2011, 13(3): 329-345. DOI:10.1093/europace/euq450 |
| [43] |
Friberg L. Safety of dronedarone in routine clinical care[J]. Journal of the American College of Cardiology, 2014, 63(22): 2376-2384. DOI:10.1016/j.jacc.2014.02.601 |
| [44] |
Nattel S. Dronedarone in atrial fibrillation——Jekyll and Hyde[J]. The New England journal of medicine, 2011, 365(24): 2321-2322. DOI:10.1056/NEJMe1111997 |
| [45] |
Zheng R, Tian G, Zhang Q, et al. Clinical safety and efficacy of Wenxin Keli-Amiodarone combination on heart failure complicated by ventricular arrhythmia:a systematic review and meta-analysis[J]. Frontiers in physiology, 2018, 9: 487. DOI:10.3389/fphys.2018.00487 |
| [46] |
Tian G, Sun Y, Liu S, et al. Therapeutic effects of Wenxin Keli in cardiovascular diseases:an experimental and mechanism overview[J]. Frontiers In Pharmacology, 2018, 9: 1005. DOI:10.3389/fphar.2018.01005 |
| [47] |
Nagatsu T, Nagatsu I. Tyrosine hydroxylase (TH), its cofactor tetrahydrobiopterin (BH4), other catecholamine-related enzymes, and their human genes in relation to the drug and gene therapies of Parkinson's disease (PD):historical overview and future prospects[J]. Journal of neural transmission (Vienna, Austria:1996), 2016, 123(11): 1255-1278. DOI:10.1007/s00702-016-1596-4 |
 2019, Vol. 38
2019, Vol. 38




