文章信息
- 黄明, 熊可, 李霄, 吕玲, 李霖, 张晗
- HUANG Ming, XIONG Ke, LI Xiao, LV Ling, LI Lin, ZHANG Han
- 心力衰竭动物模型的研究进展
- Advances in animal models of heart failure
- 天津中医药大学学报, 2019, 38(6): 534-540
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(6): 534-540
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.06.05
-
文章历史
收稿日期: 2019-05-19
2. 天津中医药大学中医药研究院, 方剂学教育部重点实验室, 天津 301617
2. Tianjin University of Traditional Chinese Medicine Research Institute, Key Laboratory of Pharmacy, Ministry of Education, Tianjin 300617, China
心力衰竭(HF)是由于心脏结构或功能性疾病导致心室充盈或射血能力受损的一组复杂临床综合征,发病率高,是各种心血管病发生发展的共同结局。其主要临床表现为呼吸困难、乏力,以及肺瘀血和外周水肿[1]。根据世界卫生组织公布的数据,全世界心力衰竭患者的数量已达到2 250万或更多,并且仍在以每年200万的速度增长,且目前没有特别理想的解决方案,因此心力衰竭的研究已成为心血管领域的焦点和热点。动物实验是进入临床阶段之前的必要过程,所以建立成熟稳定的心力衰竭动物模型来了解疾病进展并研究新的治疗方法显得尤为重要。心衰动物模型通过多种手段模拟人类心衰的发病过程,能提供心衰的发病机制及防治的科学基础和理论依据。由于大型动物心衰模型对基础实验设备及操作技术要求较高,加之造模成本昂贵,故而在进行药效筛选及机制研究中,常选用成本低廉且操作相对简便的小型心衰动物模型。笔者归纳了近年来文献中常用的心衰模型制作方法及原理,主要包括主动脉缩窄法、肺动脉高压法、盐负荷法、冠状动脉结扎法、阿霉素法、异丙肾上腺素法等,供研究者根据研究目的选择不同的实验动物模型,综述如下。
1 缺血型心力衰竭模型心肌缺血或心肌梗死是导致心力衰竭常见的危险因素,其机制为心脏缺血区血流灌注和供氧减少?能量代谢异常和心肌细胞膜离子通透性变化,导致心肌收缩能力下降,持续性激活非缺血区代偿性应激和神经内分泌系统,同时缺血区心肌细胞凋亡和细胞外间质纤维化。心肌梗死后将逐渐出现心肌重构,导致后期左室扩张和心功能持续性下降,最终当心脏无法维持足够的心排血量时,遂出现心力衰竭的临床症状[2-3],包括呼吸困难、体液潴留、活动耐受下降和组织灌注降低[4]。依据此原理,现在已有许多技术可用于复制缺血模型,常用的有冠状动脉结扎法和冠状动脉堵塞法。
1.1 冠状动脉结扎法冠状动脉结扎法模型的复制原理是通过模拟低心输出量来诱导慢性心力衰竭。具体方法是结扎动物的左冠状动脉或左前降支和左旋支,通常模型复制时间为4~8周。该方法显示出的神经内分泌激活方式和心肌纤维化与人类的心肌纤维化过程相似[5],但是这种造模方法对实验者的技术有较高要求,如大鼠的心脏很小,脉搏很快,肉眼不易识别左冠状动脉,从而导致实验失败[6]。冠状结扎的部位是本造模方法成功的关键,李娟等[5]选择结扎大鼠的左心耳下缘与肺动脉圆锥之间的冠状动脉,术后显示模型成功。李雪健等[7]通过比较3种造模方法,认为冠脉结扎法制作的HF模型能模拟HF在心肌细胞形态学、血流动力学等方面的临床变化。由于冠状动脉结扎术对实验者熟练程度要求较高,且术后病死率居高不下,阻碍了其应用[8]。为了解决此问题,喻斌等[9]通过改良研究认为选250~300 g体质量的大鼠,10%的水合氯醛以3 mL/kg剂量麻醉、无创气管插管、充分暴露心脏、小号针缝合、以2次/s频率对大鼠进行心肺按压,连续5~6次,能够减少手术后大鼠病死率。总之,冠脉结扎法制作的模型接近人类充血性心力衰竭的病理生理演变过程,但是其术后病死率较高,并且对操作者的手术水平要求颇高。
1.2 冠状动脉堵塞法冠状动脉堵塞法制作心力衰竭模型的原理是通过导管介入技术将汞,塑料微球等栓塞物质注入模型动物的冠状动脉,使其心肌组织发生缺血,最终模拟人类慢性缺血性心力衰竭的整个病理过程。米亚非等[10]通过冠状动脉微栓塞法成功建立了心力衰竭模型,模型复制时间为3~6周。该模型被认为反映了心力衰竭的自然病理变化和血流动力学变化,适用于心力衰竭的研究。此外,血管壁损伤也是人体内形成血栓的重要因素之一,郝春华等[11]用光化学诱导法人为地破坏了大鼠冠状动脉血管内皮组织,引起血液动力学改变形成血栓,成功诱发心肌梗死,该模型形成的血栓接近患者的生理和病理状况,此法对制作心肌梗死后心力衰竭模型有借鉴意义。见表 1。
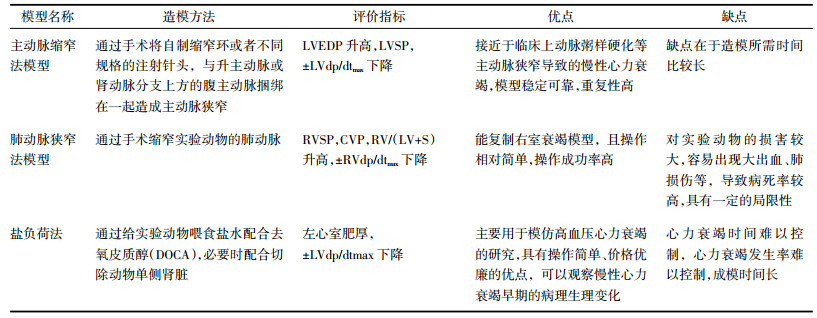
主动脉缩窄法制作心力衰竭模型的原理是通过手术将自制缩窄环或者不同规格的注射针头,与升主动脉或肾动脉分支上方的腹主动脉捆绑在一起造成主动脉狭窄,最终制作成慢性心力衰竭模型。此方法造模相对周期较长,接近于临床上动脉粥样硬化等主动脉狭窄导致的慢性心力衰竭,心力衰竭的程度与动脉管的狭窄程度呈正相关。李晓梅等[12]用26~27G针头与KM小鼠主动脉弓结扎,造成主动脉弓狭窄70%左右,至12周出现失代偿性心力衰竭。钟明等[13]研究发现将实验兔腹主动脉内径减少40%~50%术后第8周,左室舒张末压(LVEDP)明显升高, 松弛时间常数明显延长,成功地建立了DHF动物模型。该方法接近人类左室肥厚的生理和病理过程,改进了升主动脉缩窄动物易发急性左心衰竭和高死亡率高的缺点。胡咏梅等[14]采用在Wistar大鼠双肾动脉上方0.5 cm处将8号针头与腹主动脉共同结扎制作心衰模型,在4周末和8周末观察大鼠的平均动脉压(MBP)、LVSP、左室重量指数(LVMI),研究结果发现腹主动脉狭窄法心衰模型和缩窄时间密切相关。伍凤仪等[15]在制作主动脉缩窄法模型时都选用7号针头与腹主动脉捆扎。据文献报道,结扎SD或Wistar大鼠的腹主动脉,9号针头可造成35%~50%狭窄[16];8号针头可使腹主动脉腹主动脉管腔环形缩窄约50%~60%[17];7号注射针头可使大鼠腹主动脉直径减少70%~80%[18]。通过文献分析,缩窄主动脉弓法导致的血流动力学改变对心脏的影响相对腹主动脉缩窄法较强[19],但是该法类似于冠状动脉结扎法,对操作者的技术水平要求较高,所以研究者宜根据实验时间、技术水平等需要,选择相应方法。
2.2 肺动脉狭窄法肺动脉狭窄法制作心力衰竭模型的原理是通过手术缩窄实验动物的肺动脉,引起右心排血障碍,右心室后负荷加重,进而右心室肥厚最终发展成右心力衰竭竭。Braun等[20]选用雄性Wistar大鼠制作心力衰竭大鼠模型,结扎其肺动脉3周,结果显示大鼠出现了心肌细胞凋亡和右心室肥大。李莹等[21]通过研究证明缩窄实验动物肺动脉可严重影响其体内的相关血流动力学参数和血液流动状态。但是Gomez-Arroyo等[22]实验结果显示啮齿动物术后虽然有压力后负荷明显升高,但其仍保留着线粒体的基因表达和代谢功能。且文献报道肺动脉结扎术后的成年啮齿动物模型中,围手术期病死率高达40%[23]。总之,该方法具有实验操作成功率高的优点,但对实验动物有很大的损害,容易出现大出血,肺损伤等,导致病死率高。因此,通过这种方法制作右心力衰竭的模型具有一定的局限性。
2.3 盐负荷法盐负荷法制作心力衰竭模型的原理是通过给实验动物喂食盐水配合去氧皮质醇(DOCA),必要时配合切除动物单侧肾脏,使其出现水钠潴留,加重心脏前后负荷,以模仿高血压心脏病进展的病理过程。李慧丽等[24]选择雄性SD大鼠作为实验对象,切除其左侧肾脏,并在手术后1周肌内注射DOCA(25 mg/只,每周2次,连续4周),同时给大鼠喂食盐水,持续8周,大鼠出现了左心室明显肥厚的表现。该方法主要用于模拟高血压心力衰竭的研究。它具有操作简单,价格优惠的优点,可以观察慢性心力衰竭早期的病理生理变化。但是该方法的缺点在于难以控制心力衰竭的发生率并且成模时间长[25]。见表 2。
该模型的制作主要是通过人为造成动静脉瘘,主动脉关闭不全、下腔静脉狭窄、二尖瓣关闭不全和大量快速输液来制作。目前动静脉瘘法常用于实验,通常使用腹主动脉-下腔静脉造瘘法。制作容量负荷性动物心力衰竭模型的原理是使实验动物动脉系统的血液分流到低压的静脉系统,以此增加心脏的前负荷和静脉的回心血量,最终导致心力衰竭[26]。目前动静脉瘘法常用于实验,通常使用腹主动脉-下腔静脉造瘘法。王学惠等[28]运用腹主动脉-下腔静脉造瘘法制成心力衰竭模型,通过实验研究证明给予容量超负荷心力衰竭大鼠外源性euregulin-1β可有效减轻其心肌损伤,改善血流动力学改变,保护心肌细胞的结构,纠正大鼠的心功能。张敏莉等[29]实验对比腹主动脉-下腔静脉造瘘法和主动脉缩窄法大鼠模型,应用超声心动图、血流动力学检测、心脏称量以及组织切片等多种方法评价心脏结构和功能,认为动静脉瘘法手术操作相对简单,所需的设备和仪器简单价廉。该法适用于研究心力衰竭的代偿机制和因容量超负荷导致的不伴有收缩功能障碍的舒张功能不全[27]。但动静脉造瘘增加容量负荷的方法相对于主动脉缩窄法等文献报道较少,应用不广泛。
4 药物诱导型心力衰竭模型此类模型的制作原理是将引起心肌功能异常或心脏损伤的化合物注射入动物体内,以造成抑制心肌的收缩功能或心脏损伤,最终引起心力衰竭。目前报道多种药物可致心力衰竭,常用的造模药物有异丙肾上腺素(ISO)、阿霉素(ADR)。
4.1 阿霉素诱导法阿霉素是一种广谱抗肿瘤化疗药物,常用于治疗白血病和淋巴瘤,其会导致心肌组织氧自由基的损伤和生物膜脂质的过氧化反应[30],可引起实验动物心脏衰竭。两心室扩大、射血分数下降、心室壁变薄是阿霉素导致的心力衰竭的主要表现,此模型主要适用于慢性充血性心力衰竭、心肌病的研究以及新的治疗方法评估。郭长升等[31]选用SD大鼠,采用腹腔注射2 mg/mL盐酸阿霉素生理盐水溶液,按照4 mg/kg体质量(即2 mL/kg体质量)剂量注射,每周1次,连续6周,累计总量24 mg/kg体质量复制慢性心力衰竭模型。黄磊等[32-34]等选用SD大鼠进行静脉或腹腔注射2~5 mg/kg ADR,持续2~6周,出现大鼠LVEDP、LVSP等下降,心肌细胞肌浆凝聚,炎症细胞出现浸润和间质水肿,由此证实心肌性心衰模型制备成功。
另外,斑马鱼这种新型模式生物也被用于制作ADR诱导心脏损伤模型。徐卓然等[35]选用24 hpf斑马鱼胚胎,将64.4 μmol/LADR作用于他们以制造心脏毒性模型,并且进行了机制探讨。赵慧等[36]将阿霉素低、中、高浓度组(20、30、40 μg/mL)作用于36 h斑马鱼胚胎,成功建立阿霉素诱导的斑马鱼心肌损伤模型。但是该模型的缺点是左心功能不全的程度是可变的,而且心律失常发病率相对较高,由此导致模型病死率较高[37]。
4.2 异丙肾上腺素诱导心力衰竭模型异丙肾上腺素诱导心力衰竭模型的制作原理是通过ISO引起心肌细胞钙超载,心肌兴奋增强,心肌持续强烈收缩,耗氧量增大,加重心脏负荷,最终导致心力衰竭[38]。目前关于采用异丙肾上腺素诱导心力衰竭模型的文献报道较多,但是注射剂量、注射方式、持续时间有较大差异。徐清斌等[39]研究中使用5 mg/kg异丙肾上腺素皮下注射大鼠,持续7 d,实验结果显示实验大鼠心率、LVSP和+LVdP/dtmax均显著下降(P < 0.01),-LVdP/dtmin显著升高(P < 0.01),建立心力衰竭模型。张惠敏等[40]使用盐酸异丙肾上腺素梯度造模法制作心力衰竭模型,罗时珂等[41]研究发现大鼠皮下注射2.5mg/(kg·d)ISO制作心力衰竭模型较为适宜。该类模型虽然操作相对简单,但是由于动物批次、药物批号、给药途径的不同会影响动物模型的制备,必须进行预试以确定最终的实验方案。见表 3。
随着分子生物学技术的进步,很多学者通过靶向诱变/转基因或药理学研究与心力衰竭相关的基因表达的变化,但任何这种模拟心力衰竭的方法都可能被指责过于简单化[42],且对个体基因操纵的研究与疾病真实病因病理无关[43]。目前已发表了5 000多项心脏转基因/敲除研究,但这并不是疾病模型,只是被证明对于研究单个信号通路或研究单个基因的作用不可或缺[42]。但随着基因技术不断发展和改良,该模型仍将是研究心力衰竭发生机制和探索新治疗靶点的有力工具。目前国内外文献对转基因制作心力衰竭模型综述较少,现就已发表的转基因心力衰竭模型及探索作一简要综述。
5.1 遗传型心力衰竭模型SHHF/Mcc-/facp大鼠是一种可复制性自发性充血性心力衰竭(CHF)的遗传模型,且都会出现呼吸困难、端坐呼吸、紫绀、皮下水肿和腹水等充血性心力衰竭的典型症状,超声心动图显示所有的心室都扩张,心室壁增厚,2个心室+dP/dT降低和EDP升高[44]。该鼠携带facp肥胖基因,且其基因编码1个有缺陷的Leptin受体(SH-HF/Mcc-facp),从而导致肥胖和HF[45]。SHHF大鼠从15个月就出现心力衰竭,相较SHR大鼠的18个月较早,这些动物都表现出RAAS和钙代谢的改变[46]。Concei等[47]研究发现自发衰老倾向(SAMP8)小鼠是与衰老相关的良好心力衰竭模型,在6个月大时,与对照组(SAMR1)相比,该动物模型显示E/A比,E′和E′/A′显着降低以及EDPVR,纤维化和TGF-β表达增加。
5.2 基因敲除技术基因敲除技术通过敲除与心力衰竭相对应的实验动物基因的位点诱导心力衰竭。配体维生素D受体(VDR)在控制心血管稳态中起着重要作用,无论是全动物VDR基因敲除(VDR-/-)还是肌细胞特异性VDR基因缺失都会导致心脏结构和功能的改变,与心脏脂肪变性(肥胖和糖尿病)相关的临床状态也与低循环25OH维生素D水平有关。因此,Glenn DJ[48]等研究了VDR缺陷在小鼠(VDR-/-小鼠)模型中的表达作用,它在心肌细胞中选择性地表达参与甘油三酯合成的二酰基甘油酰基转移酶(DGAT1),最终这些小鼠表现出晚期心肌病和心力衰竭。此法为基因敲除制备心力衰竭模型提供了新思路。Pereira[49]等研究C57小鼠缺乏α2A/α2C肾上腺素能受体(α2A/α2CARKO)能增加心脏血管紧张素Ⅱ水平,并于第5个月观察到心室功能障碍和心力衰竭表现,并且与心脏胶原体积分数增加有关。
5.3 基因转入技术基因转入技术通过将特殊加工的基因引入实验动物的基因组中诱导心力衰竭。Mu等[50]采用基因显微注射技术构建了具有心脏特异性表达的人SIRT1(SIRT1H363Y)的显性失活形式的转基因小鼠,其能抑制内源性SIRT1活性,病理学超声心动图都证实小鼠存在扩张性心肌病,表现出明显的心力衰竭症状,这些结果表明小鼠心脏中SIRT1(SIRT1H363Y)过表达的显性失活形式导致心肌细胞凋亡和早发性心力衰竭,这表明SIRT1在出生后早期维持正常心脏发育中起关键作用。
5.4 基因干扰技术基因干扰技术诱发心力衰竭是通过将microRNA与特定mRNA组合以调节特定基因的表达。聂祥等[51]在用主动脉弓缩窄术制作心力衰竭模型时,同时采用重组腺相关病毒(rAAV-9)介导miR-665在心脏中表达,采用超声心动图检测心脏形态和功能变化以及应用蛋白免疫印迹法等方法检测相关分子机制变化,发现过表达miR-665能够增加心功能损伤和心肌肥厚,并且发现其机制是通过抑制冠状动脉微血管的形成进而诱发心力衰竭。
转基因模型可用于探索与心力衰竭相关的基因,并为心力衰竭的基因治疗提供理论基础,但目前文献报道不多,缺点是价格相对昂贵并且不能完全反映临床患者的真实病因和病理情况。见表 4。
近年来研究人员在心力衰竭模型制作中主要选用大鼠和小鼠,造模方法主要有冠状动脉结扎法、冠脉堵塞法、主动脉缩窄法、腹主动脉缩窄法、动静脉瘘法、药物诱导法,最为常用的是腹主动脉缩窄法、冠状动脉结扎法、异丙肾上腺素诱导法,这3种方法可操作性强,成功率高,但是心力衰竭是一个长期的复杂的过程,没有一种模型能完全复制疾病的自然进程,每种造模方法都有其自身的优势和局限性,所以实验者应根据自己的研究方向和实验需求选择合适的心力衰竭模型。随着分子生物学的发展,研究者也在不断地探索新的心力衰竭造模方法,运用基因敲除、基因替换、转基因等技术,使心脏特异基因发生表达改变以制作心力衰竭模型。此外,斑马鱼这一模式生物具有胚胎发育快、实验成本低、周期短,且第1周可以不依赖血液循环等特点,目前也已经探索建立了多种心脏损伤模型,在心力衰竭研究领域具有很大的应用潜力。心力衰竭的动物实验研究在现有条件下,虽然已取得了较大的进展和成果,并为临床提供了一定的理论基础。但同时也存在着很多不足之处,如动物模型与临床上心力衰竭在发病机理还有一定的差异,中医证型的模型研究还没形成规范,实验指标尚缺乏特异性,这些也将是今后研究的重点和主要方向。总之,未来我们还需要进一步探索更加具有可靠性、可重复性、经济性等特点的造模方法,为心力衰竭的研究提供更合适的动物模型,从而推动人类攻克心衰这类疾病的历史进程。
| [1] |
中华医学会心血管病学分会. 中国心力衰竭诊断和治疗指南2014[J]. 中华心血管病杂志, 2014, 42(2): 98-123. |
| [2] |
Hunt SA, Abraham WT, Chin MH, et al. 2009 focused update incorporated intothe ACC/AHA 2005 Guidelines for the Diagnosis and Management of HeartFailure in Adults:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines:developed incollaboration with the International Society for Heart and Lung Transplantation[J]. Circulation, 2009, 119(14): e391-479. |
| [3] |
Heart Failure Society of America, Lindenfeld J, Albert NM, et al. HFSA 2010 Comprehensive Heart Failure Practice Guideline[J]. J Card Fail, 2010, 16(6): e1-194. |
| [4] |
Mann DL, Bristow MR. Mechanisms and models in heart failure:the biomechan-ical model and beyond[J]. Circulation, 2005, 111(21): 2837-2849. |
| [5] |
李娟, 丁永芳, 葛海燕, 等. 冠状动脉结扎致心肌纤维化大鼠模型的建立[J]. 中国实验动物学报, 2012, 20(5): 1-4. |
| [6] |
李昌繁, 江时森. 心力衰竭动物模型的研究进展[J]. 医学研究生学报, 2007, 20(5): 532-534. |
| [7] |
李雪健, 张晓, 车运输, 等. 大鼠心力衰竭模型的建立与评估[J]. 心脏杂志, 2016, 28(6): 671-675. |
| [8] |
张玉珠, 张艳, 于洪浩. 益气活血复方对慢性心力衰竭大鼠NRF-1影响的实验研究[J]. 中华中医药学刊, 2017, 35(9): 2378-2381. |
| [9] |
喻斌, 周静, 吕高红, 等. 心梗所致心力衰竭大鼠模型复制的改良初探及评价[J]. 中国药理学通报, 2011, 27(4): 577-580. |
| [10] |
米亚非, 李小鹰. 冠状动脉微栓塞致心力衰竭模型的研究进展[J]. 军医进修学院学报, 2006, 27(4): 308-310. |
| [11] |
郝春华, 王维亭, 宋书辉, 等. 光化学法诱导大鼠冠状动脉血栓模型的建立和应用[J]. 中国药理学通报, 2012, 28(1): 143-146. |
| [12] |
李晓梅, 马依彤, 杨毅宁, 等. 小鼠主动脉弓缩窄模型的建立及评价[J]. 中国比较医学杂志, 2008, 18(11): 24-29. |
| [13] |
钟明, 张薇, 卜培莉, 等. 兔舒张性心力衰竭模型的建立[J]. 基础医学与临床, 2001(4): 379-382. |
| [14] |
胡咏梅, 李法琦, 罗羽慧, 等. 腹主动脉缩窄大鼠模型制作及临床意义[J]. 重庆医科大学学报, 2004, 29(3): 322-324. |
| [15] |
伍凤仪, 朱林强, 张银霞, 等. 腹主动脉缩窄术致心力衰竭大鼠模型肾脏损伤的探究[J]. 现代医院, 2016, 16(12): 1735-1737. |
| [16] |
柏胜男. 大鼠舒张性心力衰竭动物模型的建立[J]. 黑龙江医药, 2011, 24(6): 897-898. |
| [17] |
胡咏梅, 李法琦, 罗羽慧, 等. 腹主动脉缩窄大鼠模型制作及临床意义[J]. 重庆医科大学学报, 2004, 29(3): 322-324. |
| [18] |
侯剑辉, 叶博然, 刘钰君, 等. 大鼠慢性充血性心力衰竭模型的建立与评价[J]. 现代医院, 2012, 12(4): 26-28. |
| [19] |
芦玲巧, 曾翔俊, 郝刚. 大鼠心力衰竭模型的构建与鉴定[J]. 中国比较医学杂志, 2012, 22(8): 22-25. |
| [20] |
Braun MU, Szalai P, strasser RH, et al. Rightventricularhyper-trophyandapoptosisafterpulmonaryarterybanding:RegulationofPKCisozymes[J]. CardiovascularResearch, 2003, 59(3): 658-667. |
| [21] |
李莹, 罗先武, 李映男, 等. 肺动脉局部狭窄对血液流动的影响[J]. 清华大学学报:自然科学版, 2009, 49(5): 707-710, 714. |
| [22] |
Gomez-Arroyo J, Mizuno S, Szczepanek K, et al. Metabolic gene remodeling and mitochondrialdysfunction in failing right ventricular hypertrophysecondary to pulmonary arterial hypertension[J]. CircHeart Fail, 2013, 6(1): 136-144. |
| [23] |
李梦婷, 彭成, 谢晓芳. 心力衰竭小型动物模型研究进展[J]. 中国实验方剂学杂志, 2018, 24(5): 213-219. |
| [24] |
李慧丽, 王彬尧, 张峰, 等. 一种慢性心力衰竭模型的建立[J]. 心脏杂志, 2004, 16(3): 287. |
| [25] |
周岩, 孙兰军, 徐强. 慢性心力衰竭大鼠模型研究进展[J]. 辽宁中医杂志, 2014, 41(8): 1782-1784. |
| [26] |
王靓, 黄金玲, 施慧, 等. 对慢性心力衰竭实验动物模型制作方法的研究进展[J]. 当代医药论丛, 2014, 12(10): 291-293. |
| [27] |
孙艳侠, 王国干. 心力衰竭动物模型研究进展[J]. 中国比较医学杂志, 2011, 21(7): 73-78. |
| [28] |
王学惠, 卓小桢, 倪雅娟, 等. euregulin-1β对容量超负荷心力衰竭大鼠的治疗作用[J]. 西安大学学报(医学版), 2012, 33(2): 194-198. |
| [29] |
张敏莉, 肖晗, 白燕, 等. 容量负荷和压力负荷型心脏肥大大鼠模型的建立及评价[J]. 中国病理生理杂志, 2006, 22(4): 660-665. |
| [30] |
Lu L, Wu W, Yan J, et al. Adriamycin-inducedautophagic cardiomyocyte death plays a pathogenic rolein a rat model of heart failure[J]. Int J Cardiol, 2009, 134(1): 82-90. |
| [31] |
郭长升, 赵京生, 王香荣, 等. 心得宁口服液对大鼠慢性心力衰竭模型左心室指数、全心指数及心脏动力学的影响[J]. 中华中医药学刊, 2018, 36(3): 672-674. |
| [32] |
王斌, 张野, 朱海娟, 等. 瑞芬太尼预处理对心力衰竭大鼠心肌的保护作用[J]. 中国药理学通报, 2012, 28(7): 956-960. |
| [33] |
黄磊, 许立, 张雯, 等. 白藜芦醇改善阿霉素性心力衰竭的机制研究[J]. 中药药理与临床, 2015, 31(3): 24-28. |
| [34] |
王楚盈, 李玉梅, 刘畅, 等. 附子人参有效组分配伍对阿霉素致慢性心力衰竭大鼠血流动力学的影响及其机制研究[J]. 中药新药与临尿药理, 2015, 26(1): 39-43. |
| [35] |
徐卓然, 陈芳源, 沈莉, 等. 阿霉素对斑马鱼心脏毒性的评估及机制探索[J]. 诊断学理论与实践, 2016, 15(1): 30-36. |
| [36] |
赵慧, 费飞, 丛丽烨, 等. 阿霉素诱导的斑马鱼心肌损伤模型研究[J]. 上海中医药大学学报, 2019, 33(1): 50-55. |
| [37] |
耿阳, 刘学刚. 建立动物心力衰竭模型的方法及意义[J]. 中华全科医学, 2014, 12(2): 282-285. |
| [38] |
邓青秀, 彭成. 中医药心力衰竭动物模型的研究现状[J]. 四川动物, 2011, 30(2): 296-300. |
| [39] |
徐清斌, 熊爱琴, 杨龙玉, 等. 氧化苦参碱对充血性心力衰竭大鼠心肌组织相关因子表达的影响[J]. 华中科技大学学报(医学版), 2018, 47(5): 568-573, 588. |
| [40] |
张惠敏, 任莹璐, 柳金英, 等. 穿心莲内酯干预异丙肾诱导的心力衰竭小鼠的效应及其机制研究[J]. 天津中医药大学学报, 2018, 37(3): 221-224. |
| [41] |
罗时珂, 李萍, 程晓曙. 异丙肾上腺素诱导慢性心力衰竭大鼠模型的建立[J]. 重庆医学, 2012, 41(4): 352-354. |
| [42] |
Breckenridge R. Heart failure and mouse models[J]. Disease Models & Mechanisms, 2010, 3(3-4): 138. |
| [43] |
Stuart A. Cook, Angela Clerk, Peter H. Sugden. Are transgenic mice the 'alkahest' to understanding myocardial hypertrophy and failure?[J]. Journal of Molecular & Cellular Cardiolog, 2009, 46(2): 118-129. |
| [44] |
Mccune SA, Park S, Radin MJ, et al. SHHF/Mcc-/facp Rat Model:A Genetic Model of Congestive Heart Failure[J]. Results in Mathematics, 2013, 33(1-2): 30-39. |
| [45] |
Gomes AC, Falco-Pires I, Pires A L, et al. Rodent models of heart failure:an updated review[J]. Heart Failure Reviews, 2013, 18(2): 219-249. |
| [46] |
Heyen JRR, Blasi ER, Kristen N, et al. Structural, functional, and molecular characterization, of the SHHF model of heart failure[J]. American Journal of Physiology-Heart and Circulatory Physiology, 2002, 283(5): H1775-H1784. |
| [47] |
Concei OG, Heinonen I, Louren OAP, et al. Animal models of heart failure with preserved ejection fraction[J]. Netherlands Heart Journal, 2016, 24(4): 275-286. |
| [48] |
Glenn DJ, Cardema MC, Gardner DG. Amplification of lipotoxic cardiomyopathy in the VDR gene knockout mouse[J]. J Steroid Biochem Mol Biol, 2016, 164: 292-298. |
| [49] |
Pereira MG, Ferreira JCB, Bueno CR, et al. Exercise training reduces cardiac angiotensin Ⅱ levels and prevents cardiac dysfunction in a genetic model of sympathetic hyperactivity-induced heart failure in mice[J]. European Journal of Applied Physiology, 2009, 105(6): 843-850. |
| [50] |
Mu WL, Zhang QJ, Tang XQ, et al. Overexpression of a dominant-negative mutant of SIRT1 in mouse heart causes cardiomyocyte apoptosis and early-onset heart failure[J]. Science China Life Sciences, 2014, 57(9): 915-924. |
| [51] |
聂祥, 樊佳慧, 李华萍, 等. MiR-665通过抑制冠状动脉微血管形成促进心力衰竭[J]. 中国分子心脏病学杂志, 2018, 18(5): 2585-2587. |
 2019, Vol. 38
2019, Vol. 38