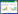文章信息
- 车文文, 郭永明, 王丹, 赵舒蒙, 郭义, 章明星
- CHE Wenwen, GUO Yongming, WANG Dan, ZHAO Shumeng, GUO Yi, ZHANG Mingxing
- 电针治疗周围神经损伤后损伤局部差异表达基因分析
- Analysis of local differentially expressed genes in peripheral nerve injury treated by electroacupuncture
- 天津中医药大学学报, 2019, 38(6): 583-587
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(6): 583-587
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.06.17
-
文章历史
收稿日期: 2019-03-28
2. 天津中医药大学中医学院, 天津 301617;
3. 天津中医药大学中西医结合学院, 天津 301617
2. College of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. College of Integrated Traditional Chinese and Western Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
周围神经损伤(PNI)是临床常见疾病,交通事故是导致PNI的主要原因[1]。虽然周围神经损伤后可以再生,但是其结构比较复杂,致使周围神损伤后的功能恢复率只能达到损伤前的70%左右[2]。PNI还会导致骨骼肌失去神经支配,长期失神经状态则会引起肌容量丧失、肌纤维重构,肌卫星细胞减少等病理改变,最终造成不可逆的失神经性肌萎缩,致使运动功能恢复不理想[3-4]。近些年来神经修复水平有了明显的提高,但神经功能恢复效果仍不尽如人意。大量研究表明电针疗法对PNI治疗效果显著[5]。团队前期研究结果已表明电针治疗周围神经损伤有效[6-7]。然而,电针对PNI治疗作用的具体机制尚不完全明确,还需要进一步的研究。高通量转录组测序技术是从转录组水平来研究基因表达谱的一个新的技术手段,其凭借高灵敏度、高通量和低成本的优势成为从全基因组水平研究基因表达的主要方法[8]。本研究利用高通量测序技术对坐骨神经损伤局部神经组织进行转录组测序,并结合生物信息学技术对获得的差异表达基因开展功能注释、信号通路分析等方面的研究,以进一步阐明电针治疗周围神经损伤的作用机制,为电针进一步推广应用提供理论基础。
1 材料与方法 1.1 实验动物及样品采集依据文献报道和实验动物“3R原则”,本实验选取Wistar大鼠9只[4-5],雄性,8周龄,SPF级,随机分为空白组、模型组、电针模型组,对电针模型组、模型组建立坐骨神经横断伤模型,电针刺激患侧环跳(+)、足三里(-),电针参数:输出频率5赫兹,断续波,15 min,强度以患肢轻微颤动为度。电针6 d后,在坐骨神经横断伤处,以损伤处为中心取1 cm长的神经组织样品,并迅速置于液氮中,然后放入-80 ℃超低温冰箱内冷冻保存,用于RNA提取和转录组测序。
1.2 测序方法进行样品的total RNA抽提,后纯化total RNA,再进行质检,质检合格的RNA可进行后续的测序实验。对纯化后的total RNA进行rRNA去除、片段化、第1链cDNA合成、第2链cDNA合成、末端修复、3’末端加A、连接接头、富集等步骤,完成测序样本文库构建,文库质检合格后进行上机测序,进行双端测序。对测序得到的raw reads进行质控。所有的样品测序量都满足质控标准后进行数据分析。
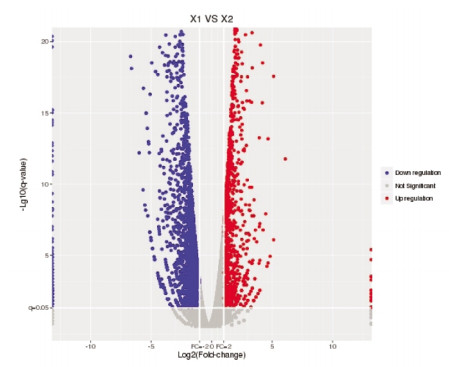
2 结果 2.1 差异表达基因以P≤0.05、Fold-change≥2为条件,筛选3个样本的差异表达基因。模型组与空白组相比,检测到4170个显著性差异基因,下调差异基因3 001个,上调差异基因1 169个(图 1)。电针模型组和模型组相比,检测出104个显著性差异基因,80个差异基因下调,24个差异基因上调(图 2)。其中有69条基因造模后表达趋势与电针后表达趋势相反,62条基因造模后表达上调,经过电针后表达下调,7条基因造模后表达下调,经过电针后表达上调,因此这69个基因是3组共同差异表达基因,其在模型制备以及电针干预后均发生显著的差异表达。这些差异基因中经过电针刺激后,上调最明显的5个基因为:Igh-1a、Igkc、Ncald、Igf2、Has3;下调最明显的5个基因为:Tchh、AABR07052585.1、Myh1、Mylpf、Actn3。
|
| 图 1 空白组和模型组差异基因火山图 |
|
| 图 2 电针模型组和模型组差异基因火山图 |
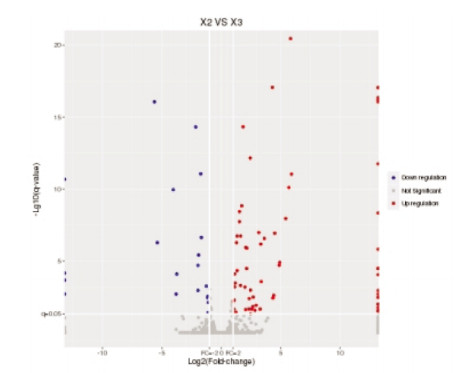
基因本体论(GO)是一个国际标准化的基因功能分类系统,提供了一个全面描述生物体的基因属性和基因产物的动态更新词汇库[11]。将模型组与空白组、电针模型组与模型组的差异基因做GO功能分类统计,从生物工程(biological process,BP)、细胞组分(CC)和分子功能(MF)3个方面进行基因功能分析,筛选标准为P < 0.05。
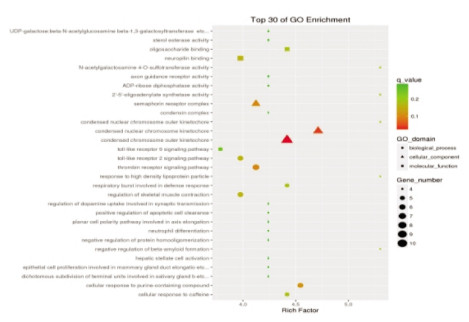
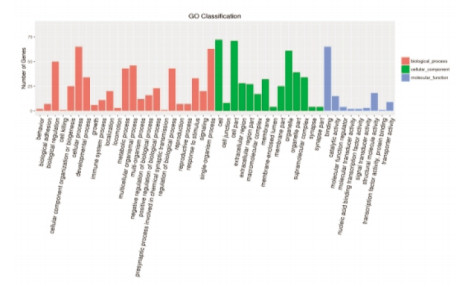
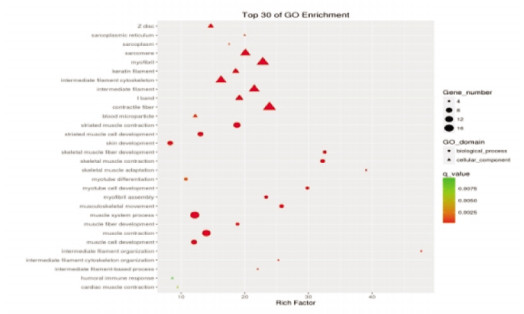
空白组与模型组共45 187个基因得到了注释,BP类别中:细胞过程、单一生物过程所含基因最多,CC类别中:细胞、细胞部分类所占比例最高,MF类别中:结合、催化活性类所包含的基因最多;GO功能富集主要与细胞发育、迁移,信号转导、神经系统发育等相关(图 3、图 4)。电针模型组与模型组共92个差异基因得到分类注释,BP类别中细胞过程和单一生物过程包含的基因最多,在CC类别中:细胞类、细胞部分类所占比例最高,而在MF类别中:占主导地位的是结合类;GO功能富集主要与钙离子结合、免疫应答、以及电压门控阳离子通道活性等过程相关(图 5、图 6)。
|
| 图 3 空白组与模型组差异基因GO分类结果 |
|
| 图 4 空白组与模型组差异基因GO富集结果 |
|
| 图 5 电针模型组与模型组差异基因GO分析结果 |
|
| 图 6 电针模型组与模型组差异基因GO富集结果 |
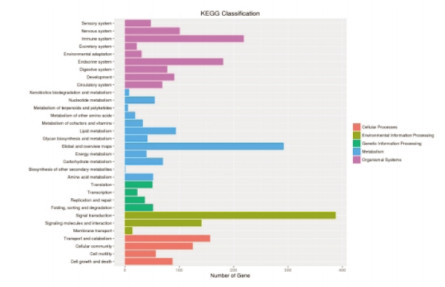
KEGG数据库是系统分析基因产物在细胞中的代谢途径以及这些基因产物功能的数据库。利用该数据库有助于把基因及表达信息作为一个整体的网络进行研究。对差异基因进行KEGG分析,空白组与模型组差异表达基因分析主要涉及与信号转导、免疫系统、全局和概览图相关的通路。电针模型组与模型组差异表达基因主要涉及免疫系统、信号转导、细胞群落3个方面,如图 7,8所示。

|
| 图 7 电针模型组与模型组差异基因KEGG分析结果 |
|
| 图 8 空白组与模型组差异基因KEGG分析结果 |
对差异基因进行KEGG通路富集,以P-value<0.05为标准,模型组与空白组之间的差异表达基因显著富集了53条KEGG信号通路。电针模型组与模型组之间的差异表达基因涉及了19条KEGG信号通路,去掉与研究方向无关的通路,剩余可能与研究方向相关的通路8个,富集结果如表 1所示。
周围神经损伤是常见的致残性疾病,属于中医“痹症”、“痿证”的范畴,《内经》就提出“治痿独取阳明”的理论。在本次实验中,选择“环跳”、“足三里”两穴,环跳穴位于足少阳胆经上,主要用于下肢痿痹等疾病的治疗,足三里穴属于足阳明胃经,补益要穴,电针刺激环跳、足三里可促进神经功能的恢复,深刺可以增加神经生长因子的表达[12-13]。研究表明电针疗法不仅具有针刺穴位本身的作用,还可以产生弱电场,促进再生神经向阴极生长,且5 Hz电针对于神经损伤的再生修复作用优于高频电针[14-15]。故本实验选择环跳为阳极足三里为阴极,电针参数选择断续波、5 Hz,强度以肌肉出现轻微抽动为准。
目前,针灸治疗周围神经损伤经过大量的临床和实验研究已被证明是一种行之有效的方法。大量基础研究显示,电针能够改善周围神经损伤后运动终板内的营养物质含量和结构,能够延缓肌肉的萎缩,促进神经生长相关因子的增多、促进雪旺细胞大量增生并且分泌多种神经活性物质,抑制脊髓前角和背根神经元凋亡,进而促进周围神经损伤后形态和功能恢复[16-22]。近年来学者们逐渐认识到周围神经损伤后修复与再生的微环境是决定其结局的关键,此微环境可概括为神经再生通道建立、神经营养因子调节、炎性反应、激素调节、信号通路调控及酶的调节等6个方面,有研究表明电针对神经修复机制可能与神经损伤后神经元、轴突的再生记忆微环境的改变有关,但具体机制尚不明确,还需要进一步的研究[23-26]。高通量转录组测序技术是从转录组水平来研究基因表达谱的一个新的技术手段,现在被广泛应用于挖掘功能基因、开发分子标记、揭示代谢调控途径等方面,本研究采用该技术获取大量电针治疗周围神经损伤的转录信息,并对差异基因进行定量、定性研究,筛选电针对神经的修复机制可能激活的信号通路,进一步阐释电针的作用机制。
本实验的结果表明空白组、模型组、电针模型组间基因有显著的区别,说明电针后的大鼠在基因表达水平上存在特异表现,揭示这些差异表达基因可能在坐骨神经损伤的发生、发展中扮演重要角色。空白组与模型组共筛选出4 170个显著性差异基因,其中3 001个基因在模型组中表达下调,1 169个基因在模型组中表达上调;电针组和模型组一共检测出104个差异表达基因显著, 其中24个基因在电针组组织中表达上调,80个基因在电针组组织中表达下调,进一步的筛选发现差异最为显著的30个基因中,20个为下调基因,10个基因表达上调,表达显著上调的前5位基因是:AABR07051592.2、Igkc、Igh-1a、Igf2、LOC100912707;表达显著下调的前5位基因是:Acta1、Myh1、Ryr1、Myl1、Mylpf。GO富集分析结果表明电针可能是通过对免疫过程、离子通道、细胞骨架的调节而达到对周围神经损伤的治疗作用。KEGG分析表明经过电针以后主要涉及免疫系统、信号转导、细胞群落3个方面的变化,其中细胞群落中涉及粘着斑、黏合连接、紧密连接等方面的变化,免疫系统中涉及补体、白细胞经内皮迁移、趋化因子信号通路、造血细胞系等方面的变化,信号转导方面涉及cAMP信号通路、AMPK信号通路、FoxO信号通路、TGF-β信号通路、ras信号通路、钙信号通路、cgmp-pkg信号通路、PI3K-Akt信号通路、MAPK信号通路等方面的变化,表明电针可能通过调控某些基因的表达从而影响神经的传导及机体免疫功能的改变;结合KEGG富集分析结果,基于电针治疗周围神经损伤研究现状筛选了可能与研究方向相关的8个通路:白细胞跨内皮迁移通路、γ-氨基丁酸能突触通路、胆碱能突触通路、5-羟色胺突触通路、钙信号通路、紧密连接通路、粘着斑通路、肌动蛋白细胞骨架的调控通路。
综上所述,电针治疗周围神经损伤机制可能是通过改变细胞电位平衡、神经元轴突再生骨架结构的重建以及白细胞的迁移而改变周围神经损伤后修复与再生的微环境,然而具体的分子机制还需结合相关的差异基因及具体信号通路,进一步研究。
| [1] |
Taylor CA, Braza D, Rice JB, et al. The Incidence of Peripheral Nerve Injury in Extremity Trauma[J]. American Journal of Physical Medicine & Rehabilitation, 2008, 87(5): 381-385. |
| [2] |
Griffin JW, Hogan MCV, Chhabra AB, et al. Peripheral Nerve Repair and Reconstruction[J]. The Journal of Bone and Joint Surgery (American), 2013, 95(23): 2144. DOI:10.2106/JBJS.L.00704 |
| [3] |
Barns M, Gondro C, Tellam RL, et al. Molecular analyses provide insight into mechanisms underlying sarcopenia and myofibre denervation in old skeletal muscles of mice[J]. The International Journal of Biochemistry & Cell Biology, 2014, 53(8): 174-185. |
| [4] |
Milan G, Romanello V, Pescatore F, et al. Regulation of autophagy and the ubiquitin-proteasome system by the FoxO transcriptional network during muscle atrophy[J]. Nature Communications, 2015(6): 6670. |
| [5] |
章明星, 刘阳阳, 刘建卫, 等. 电针治疗周围神经损伤的临床研究进展[J]. 光明中医, 2016, 31(08): 1196-1199. DOI:10.3969/j.issn.1003-8914.2016.08.071 |
| [6] |
郭义, 石田寅夫, 李庆雯, 等. 不同频率电针对周围神经再生与修复影响的临床与实验研究[J]. 天津中医药大学学报, 2006, 25(3): 177-181. DOI:10.3969/j.issn.1673-9043.2006.03.025 |
| [7] |
赵伟, 刘延祥, 王占魁, 等. 自噬对电针治疗大鼠实验性坐骨神经损伤后神经再生的影响[J]. 天津中医药大学学报, 2014, 33(6): 351-354. |
| [8] |
Wei W, Wang Y, Zhang Q, et al. Global characterization of Artemisia annua glandular trichome transcriptome using 454 pyrosequencing[J]. BMC Genomics, 2009, 10(1): 465-475. DOI:10.1186/1471-2164-10-465 |
| [9] |
Lin X, Zhihong Y, Ya Z, et al. Deep RNA sequencing reveals the dynamic regulation of miRNA, lncRNAs, and mRNAs in osteosarcoma tumorigenesis and pulmonary metastasis[J]. Cell Death & Disease, 2018, 9(7): 772. |
| [10] |
Sun J, Chen G, Jing Y, et al. LncRNA Expression Profile of Human Thoracic Aortic Dissection by High-Throughput Sequencing[J]. Cellular Physiology and Biochemistry, 2018, 1027-1041. |
| [11] |
Ashburner M, Ball CA, Blake JA, et al. Gene ontology:tool for the unification of biology. The Gene Ontology Consortium[J]. Nat Genet, 2000, 25(1): 25-29. DOI:10.1038/75556 |
| [12] |
叶晓春, 邵水金, 国海东, 等. 电针对坐骨神经损伤大鼠脑源性神经营养因子的影响[J]. 中国中医药信息杂志, 2017, 24(6): 60-63. DOI:10.3969/j.issn.1005-5304.2017.06.015 |
| [13] |
李野.针刺环跳穴不同组织部位对坐骨神经损伤大鼠电生理和c-fos影响的实验研究[D].沈阳: 辽宁中医药大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10162-1013158257.htm
|
| [14] |
王亚军, 郭义. 电针促进周围神经再生的实验研究进展[J]. 天津中医药, 2002, 19(4): 73-74. DOI:10.3969/j.issn.1672-1519.2002.04.049 |
| [15] |
陈家泽, 陈传伟, 孙锋. 针刺对大鼠坐骨神经损伤后腓肠肌萎缩的影响[J]. 实用医学杂志, 2008, 24(8): 1313-1315. DOI:10.3969/j.issn.1006-5725.2008.08.015 |
| [16] |
闫泓池, 马铁明, 陶星, 等. 深刺"环跳"在大鼠坐骨神经损伤修复中的抗凋亡机制[J]. 针刺研究, 2018, 43(11): 711-717. |
| [17] |
章明星, 刘阳阳, 刘建卫. 电针治疗周围神经损伤的机制研究进展[J]. 辽宁中医杂志, 2016(8): 1769-1771. |
| [18] |
王瑞辉, 戴静宜, 屈红艳, 等. 针刺对坐骨神经损伤后雪旺细胞的影响[J]. 陕西中医学院学报, 2008, 31(2): 30-31. |
| [19] |
王中鹏, 孙佳璐, 孙忠人, 等. 针刺治疗失神经肌萎缩的机制及研究展望[J]. 针灸临床杂志, 2012, 28(9): 73-75. DOI:10.3969/j.issn.1005-0779.2012.09.034 |
| [20] |
于跃, 吴剑聪, 李小琴, 等. 电针影响坐骨神经损伤大鼠脊髓前角神经营养因子-3表达的研究[J]. 环球中医药, 2014, 7(4): 262-265. DOI:10.3969/j.issn.1674-1749.2014.04.006 |
| [21] |
Gordon T, Chan KM, Sulaiman OAR, et al. Accelerating axon growth to overcome limitations in functional recovery after peripheral nerve injury[J]. Neurosurgery, 2009, 65(Supplement): A132-A144. |
| [22] |
杜旭, 王瑞辉, 张秋红, 等. 电针对坐骨神经损伤大鼠雪旺细胞及其神经功能的影响[J]. 陕西中医, 2012, 33(5): 621-624. DOI:10.3969/j.issn.1000-7369.2012.05.066 |
| [23] |
范红石, 王艳, 陈国平. 周围神经损伤后轴突再生微环境的研究进展[J]. 中国康复理论与实践, 2015, 21(3): 288-291. DOI:10.3969/j.issn.1006-9771.2015.03.011 |
| [24] |
刘守尧, 王云亭. 电针干预周围神经损伤后再生的机制探讨[J]. 中日友好医院学报, 2014, 28(5): 302-303. DOI:10.3969/j.issn.1001-0025.2014.05.013 |
| [25] |
陶星, 马铁明. 针刺治疗周围神经损伤及再生修复相关机制探讨[J]. 针刺研究, 2016, 42(1): 90-93. |
| [26] |
高洁, 刘良明, 伍亚民. 周围神经损伤后轴突再生的分子机制研究进展[J]. 中国康复理论与实践, 2010, 16(5): 436-438. DOI:10.3969/j.issn.1006-9771.2010.05.016 |
 2019, Vol. 38
2019, Vol. 38