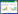文章信息
- 王昭昕, 杨莉, 卢国彦, 张玥, 于英莉, 周昆
- WANG Zhaoxin, YANG Li, LU Guoyan, ZHANG Yue, YU Yingli, ZHOU Kun
- 补骨脂水提药渣灌胃给药4周的大鼠亚慢性毒性实验研究
- A four-weeks sub-chronic toxicity study of the debris after decoction of Fructus Psoraleae by intragastric administration in rats
- 天津中医药大学学报, 2019, 38(6): 588-592
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(6): 588-592
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.06.18
-
文章历史
收稿日期: 2019-06-03
2. 方剂学教育部重点实验室, 天津 301617
2. Key Laboratory of Prescriptions, Ministry of Education, Tianjin 301617, China
补骨脂是豆科植物补骨脂(Psoraleacorylifolia L.)的干燥成熟果实,主要含香豆素类、黄酮类和单帖酚类等成分[1]。始载于《雷公炮炙论》,药性苦、辛、温,归肾、脾经[2],有补肾壮阳、补脾健胃的功能。补骨脂在临床上多以水煎的方式入药,在中成药生产过程中也多采用水提。补骨脂水提后的药渣即被废弃,不仅造成资源浪费,而且容易由此引发环境污染问题[3]。本课题组前期实验研究发现补骨脂水提后药渣仍具有药效,对维甲酸诱导的大鼠骨质疏松有治疗作用[4],并且能够显著抑制环磷酰胺诱导的大鼠外周白细胞减少,其效果甚至优于等剂量补骨脂生药及其水提物[5]。由此可见,补骨脂水提药渣仍然具有一定的药用价值。但是目前对补骨脂水提后药渣的安全性研究相对匮乏。本研究对补骨脂水提后药渣的毒性进行研究,通过比较补骨脂生药和药渣对大鼠的毒性作用,为补骨脂水提后药渣的再利用提供研究基础,为提高补骨脂药材的综合利用提供依据。
1 材料 1.1 受试样品补骨脂药材、补骨脂生药粉、补骨脂水提药渣,均为天津中医药大学中医药研究院王跃飞研究员团队制备提供,产品批号:20120920。
补骨脂生药粉:补骨脂药材直接粉碎,制得棕色补骨脂生药粉;经含量测定,内含补骨脂素、异补骨脂素、补骨脂苷、异补骨脂苷、补骨脂酚、补骨脂甲素、补骨脂乙素,分别为:5.007 4、4.140 9、14.225 4、10.109 9、62.515 7、2.264 1、4.369 7 mg/g生药。
补骨脂水提药渣:补骨脂药材经水沸提取后,滤布过滤得到的滤渣再用水提取,浸提液60 ℃减压烘干,制得水提药渣(折合1.33 g生药/g药渣)。经含量测定,内含补骨脂素、异补骨脂素、补骨脂苷、异补骨脂苷、补骨脂酚、补骨脂甲素、补骨脂乙素,分别为:4.156 3、3.552 7、0.753 0、0.399 1、67.954 5、1.786 7、3.696 4 mg/g生药。
1.2 动物及饲养SD大鼠,SPF级,雌雄各半,共70只,购自北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2009-0015。动物饲养于天津中医药大学实验动物中心。所用饲料为全价颗粒饲料,由天津市华荣实验动物科技有限公司生产。
1.3 试剂与仪器白蛋白(ALB)、碱性磷酸酶(ALP)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、血清肌酐(CREA)、总胆固醇(TC)、总蛋白(TP)、总甘油三酯(TG)和总胆汁酸(TBA)试剂盒均为中生北控生物科技股份有限公司生产。
总抗氧化能力(T-AOC)和丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所。
离心机(赛默飞,Legend Micro17型),恒温培养振荡器(上海世平实验设备有限公司,SPH-103B型),全自动封闭脱水机(Leica,ASP300S型),切片机(Leica,RM2135型),显微镜(OLYMPUS,BX51型),包埋机(天津航空机电公司,BMJ-1)型,多功能酶标仪(Tecan,InfiniteM200型),全自动生化分析仪(日立,7020型)。
2 方法 2.1 分组与给药雌、雄SD大鼠按体质量随机分为5组,每组7只,共70只。对照组灌胃给予等体积的溶剂,补骨脂生药高剂量6 g/kg(生药量)和补骨脂生药低剂量3 g/kg(生药量)剂量组,补骨脂药渣高剂量6 g/kg(生药量)和补骨脂药渣低剂量3 g/kg(生药量)剂量组,每日给药1次,连续灌胃给药4周。
2.2 一般状况观察给药期间每周称质量一次,根据体重调整给药剂量,每日给药前观察动物的毛色、进食、活动等情况。
2.3 血清生化检测大鼠灌胃给药4周结束后,禁食不禁水12 h,实验前大鼠用10%水合氯醛麻醉,经腹主动脉取血5 mL,3 000 r/min离心10 min,分离得到血清,通过自动生化仪检测指标ALB、ALP、ALT、AST、BUN、CRE、TC、TP、TG以及TBA。
2.4 MDA和T-AOC的含量测定取动物肝脏,制备成10%的肝脏匀浆,用比色法检测大鼠肝脏中MDA和硫代巴比妥酸(TBA)法检测T-AOC水平,具体操作按试剂盒说明书进行。
2.5 肝脏脏器系数及组织病理学检查剖腹摘取大鼠心脏、肝脏、肾脏、脾脏、胸腺,称质量,计算脏器系数(脏器质量/体质量)。切取大鼠一叶肝脏和左肾于10%中性甲醛溶液中固定,固定液为组织体积的5~10倍,固定48 h,石蜡切片,常规HE染色,光镜下观察组织病变。
2.6 数据处理和统计实验结果以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以P < 0.05为差异具有统计学意义[6]。
3 结果 3.1 补骨脂生药和药渣对大鼠一般情况的影响在整个灌胃给药期间,各给药组大鼠进食、活动情况正常,毛色无异常变化,雌雄各组动物均无死亡。
3.2 补骨脂生药和药渣对大鼠体质量的影响补骨脂生药和药渣灌胃给药4周对雌雄大鼠体重变化的影响如表 1所示:与对照组相比,灌胃给药4周后,生药高剂量组雄性大鼠体质量显著降低,雌性大鼠体质量亦呈现下降趋势。其他组大鼠体质量无明显变化。
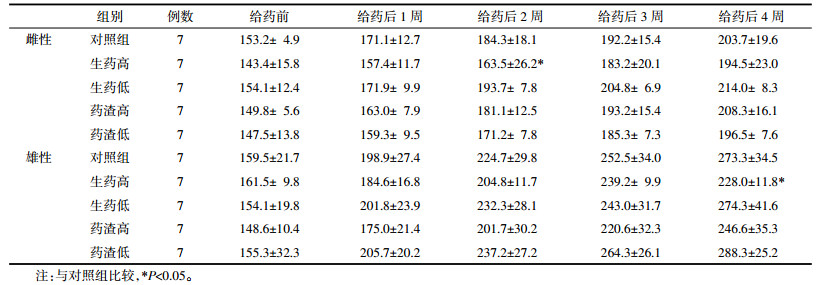
与对照组比较,生药高剂量组雄性大鼠ALB显著升高;生药低剂量组雄性大鼠TBA、T-CHO均显著降低,雌性大鼠各参数无显著差异(P > 0.05);药渣高剂量组雄性大鼠TBA、TC、ALB均显著降低,雌性大鼠ALP显著升高;药渣低剂量组雄性大鼠TC和ALB显著降低,雌性大鼠BUN显著升高。与生药低剂量组相比,药渣低剂量组雄性大鼠ALB显著升高,见表 2。
与对照组比较,生药高、低剂量组雄性大鼠MDA均显著升高,且低剂量组MDA值较对照组升高188.54%;生药高剂量组,药渣高、低剂量组雄性大鼠T-AOC均显著升高,且较对照组T-AOC值分别升高72.73%、127.27%、163.64%。雌性大鼠生药高、低剂量组MDA显著升高;生药高剂量组和药渣高、低剂量组T-AOC均显著升高。与生药组相比,雌雄大鼠的药渣组MDA均显著降低;雄性药渣低剂量组T-AOC显著升高。见图 1。

|
| 图 1 补骨脂生药和药渣给药1个月对雌雄性大鼠MDA和T-AOC的影响 |
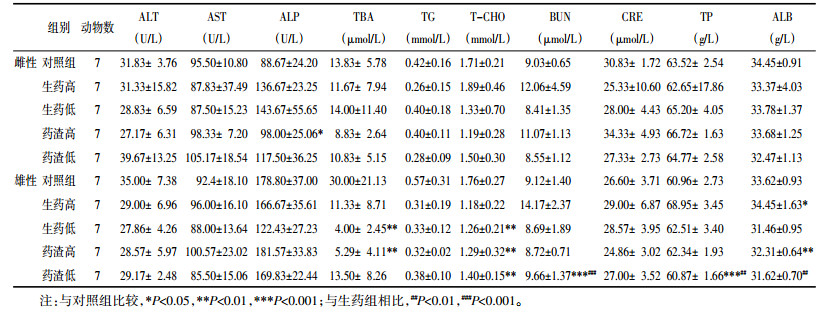
与对照组相比,雄性大鼠生药高、低剂量组,药渣高、低剂量组的肝、肾系数均有显著升高,且生药组高、低剂量组肝、肾脏器系数分别较对照组升高136.47%和34.59%;药渣高、低剂量组肝、肾脏器系数分别较对照组的升高69.02%、33.05%;药渣高、低剂量组,生药高、低剂量组胸腺系数显著降低。与生药低剂量组相比,药渣低剂量组肝脏系数显著降低。雌性大鼠生药高、低剂量组,药渣高、低剂量组的肝系数显著升高;药渣高、低剂量组肾系数显著升高;药渣低剂量组胸腺系数显著降低,其他各组无显著差异;与生药组相比,药渣组肝系数显著降低。见表 3。
光镜下观察,与对照组相比,给药组大鼠的肝脏和肾脏在光镜下未见明显的组织病变。
4 讨论补骨脂作为中国传统中医临床常用药,多以水煎的方式入药,在中成药生产过程中也多采用水提,而其水提后的药渣即被废弃。本研究结果表明,与对照组相比,补骨脂生药和水提后药渣均使大鼠体重降低,在不同程度上提高肝、肾脏器系数、升高MDA水平,降低胸腺系数,存在相似的毒性作用。特别是生药高剂量组和药渣高剂量组,显著提高了大鼠TBA、TC、ALB等参数,提高了MDA水平,并降低了T-AOC水平,使肝脏系数显著升高,毒性作用明显,且对雌雄大鼠毒性差异不明显。但是从与生药组比较的情况看,药渣组的肝脏系数、MDA水平有所降低,而且药渣低剂量组较生药低剂量组T-AOC含量也显著升高。这些结果提示补骨脂水提后药渣毒性较补骨脂生药有所降低。
对补骨脂水提物和水提后药渣的成分进行分析,发现补骨脂水煎剂中的成分主要是补骨脂素、异补骨脂素、补骨脂苷、异补骨脂苷和极少量补骨脂酚[7],其中补骨脂素和异补骨脂素是水煎剂中吸收入血的主要有效成分[8];而补骨脂药渣中则含有较多的补骨脂酚,补骨脂素、异补骨脂素的含量比生药略少,几乎没有补骨脂苷和异补骨脂苷。我们课题组前期实验研究发现,补骨脂水提后药渣具有良好的抗骨质疏松作用,并且能够显著抑制环磷酰胺诱导的大鼠外周白细胞减少[4, 5]。已有研究证实补骨脂酚有抗菌、抗氧化、抗肿瘤、消炎、降糖降血脂、祛斑等多种药理作用[9-15],这提示补骨脂酚可能是补骨脂水提后药渣中的主要有效成分。本研究结果显示,补骨脂药渣的体内毒性较生药有显著降低,这提示我们补骨脂在工业大生产过程中产生的大量水提药渣有一定药用价值,在治疗骨质疏松等疾病的中药方剂中,可以考虑将补骨脂水提药渣作为一个新的可用部位。另外,目前已有大量研究对补骨脂酚广泛而有效的药理作用有所认识,从补骨脂水提药渣中提取补骨脂酚,也许是另一个资源利用的思路。
| [1] |
陈莹, 吴玥, 宋金春. 补骨脂化学成分及生物活性研究进展[J]. 实用药物与临床, 2016, 19(9): 1184-1188. |
| [2] |
魏蒙蒙, 王树瑶, 杨维, 等.补骨脂的化学成分及主要毒性研究进展[J/OL].中国实验方剂学杂志: 1-13[2019-02-25].https://doi.org/10.13422/j.cnki.syfjx.20190517.
|
| [3] |
陈月芳, 曹丽霞, 林海, 等. 中药渣和麦麸对模拟矿山酸性废水中Cu2+的吸附[J]. 中国有色金属学报, 2013, 23(6): 1775-1782. |
| [4] |
刘颖, 袁晓美, 毕亚男, 等. 补骨脂对维甲酸诱导的大鼠骨质疏松的治疗[J]. 实验动物科学, 2018, 35(1): 44-47. DOI:10.3969/j.issn.1006-6179.2018.01.009 |
| [5] |
袁晓美, 刘颖, 毕亚男, 等. 补骨脂对环磷酰胺诱导大鼠外周血细胞减少的拮抗作用研究[J]. 实验动物科学, 2017, 34(6): 34-37. DOI:10.3969/j.issn.1006-6179.2017.06.008 |
| [6] |
牟文波, 李慧, 安会苹, 等. 幼年SD大鼠生化指标背景数据的建立和结果分析[J]. 中国药物警戒, 2017, 14(11): 641-645. DOI:10.3969/j.issn.1672-8629.2017.11.001 |
| [7] |
周昆, 代志, 柳占彪, 等. 补骨脂水提物引起的大鼠肝损害[J]. 天津中医药大学学报, 2013, 32(4): 221-224. |
| [8] |
王宇卿, 闫明, 陈文, 等. 补骨脂血清药物化学的初步研究[J]. 中国新药杂志, 2008, 17(5): 396-397. DOI:10.3321/j.issn:1003-3734.2008.05.011 |
| [9] |
Choi JH, Rho MC, LeeSW, et al. Bavachin and isobavachalcone, acylcoenzyme A:cholesterol acyltransferase inhibitor-sfrom Psoraleacorylifolia[J]. Arch Pharm Res, 2008, 31(11): 1419-1423. DOI:10.1007/s12272-001-2126-x |
| [10] |
陈萧萧.补骨脂药渣资源化初步研究[D].合肥: 河南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10475-1016201878.htm
|
| [11] |
Li ZJ, Abulizi A, Zhao GL, et al. Bakuchiol Contributes to the Hepatotoxicity of Psoralea corylifolia in Rats[J]. Phytother Res, 2017, Aug; 31(8): 1265-1272. |
| [12] |
Zhang X, Zhao W, Wang Y, et al. The Chemical Constituents and Bioactivities of Psoralea corylifolia Linn.:A Review[J]. Am J Chin Med., 2016, 44(1): 35-60. |
| [13] |
Kim JE, Kim JH, Lee Y, et al. Bakuchiol suppresses proliferation of skin cancer cells by directly targeting Hck, Blk, and p38MAP kinase[J]. Oncotarget., 2016, Mar 22;7(12): 14616-14627. |
| [14] |
Xin ZL, Wu X, Ji T, et al. Bakuchiol:A newly discovered warrior against organ damage[J]. Pharmacological Research, 2019, 2;141: 208-213. |
| [15] |
Hu XJ, Zhang YB, Zhao ZJ, et al. Metabolic detoxification of bakuchiol is mediated by oxidation of CYP 450s in liver microsomes[J]. Food Chem Toxicol, 2018, 111: 385-392. DOI:10.1016/j.fct.2017.11.048 |
 2019, Vol. 38
2019, Vol. 38