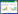文章信息
- 张洪敏, 曹世杰, 邱峰, 张德芹
- ZHANG Hongmin, CAO Shijie, QIU Feng, ZHANG Deqin
- 葛根和葛根素治疗糖尿病及并发症的研究进展
- Research progress on treatment of diabetes mellitus and complications by Puerariaee lobata radix and puerarin
- 天津中医药大学学报, 2019, 38(6): 607-615
- Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(6): 607-615
- http://dx.doi.org/10.11656/j.issn.1673-9043.2019.06.22
-
文章历史
收稿日期: 2019-06-08
2. 天津中医药大学中药学院, 天津 301617
2. Research Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
糖尿病是一种由多种遗传和环境因素引起的常见且多发的慢性非传染性疾病,近年来已经成为继心血管疾病和肿瘤之后的第三大非传染性疾病[1-2],且糖尿病随疾病的发生和发展极易诱发肝脏脂肪变性、肾病、视网膜病变、心脑血管病、神经性病变等多种病变[3-7]。在我国,糖尿病患病人口数长时间居世界首位,预计仍将持续较长时间[8]。因此,防治糖尿病已刻不容缓。葛根为豆科植物野葛[Pueraria lobata(Willd.)Ohwi]的干燥根,含有丰富的异黄酮类化合物,对糖尿病及其并发症有一定的治疗作用,是临床上治疗糖尿病的常用药且用药历史悠久。近年来科研工作者不断探寻葛根或葛根有效成分治疗糖尿病的多种机制,并取得了丰富的成果。本文将对葛根及其主要异黄酮类化合物葛根素对糖尿病及并发症的治疗作用及机制的研究概况进行综述。
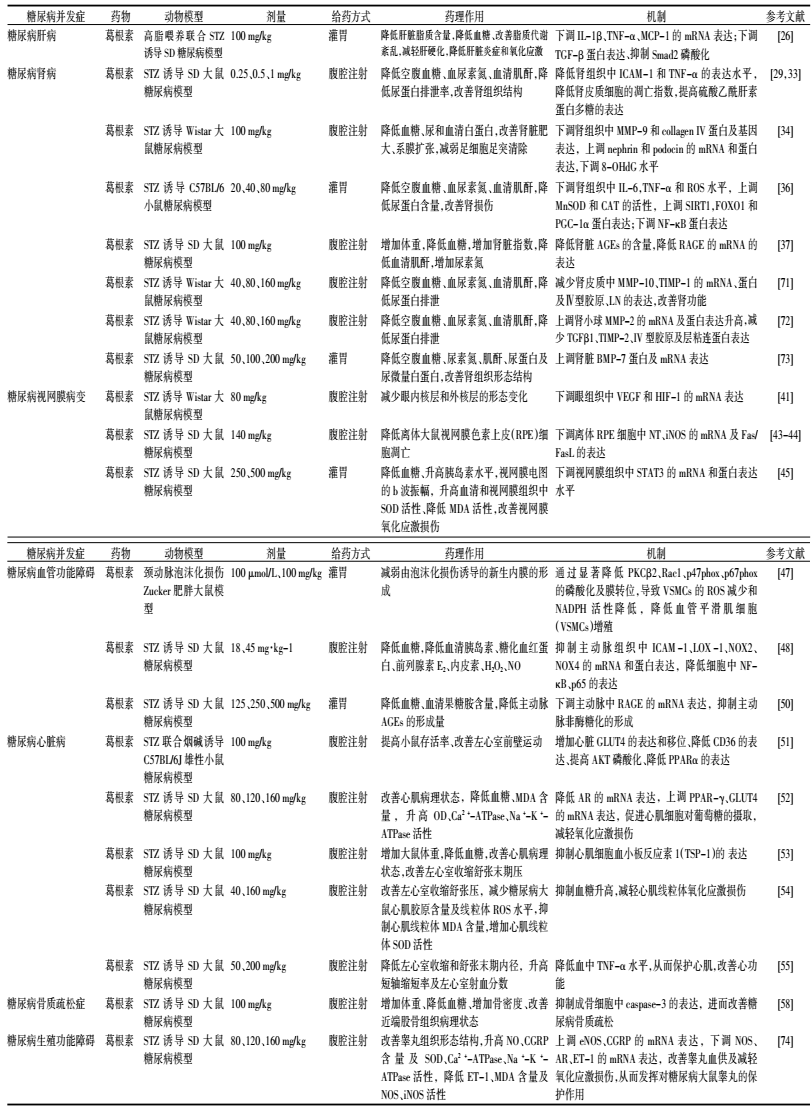
1 葛根和葛根素对糖尿病及并发症的治疗作用及相关机制异黄酮类化合物是葛根中主要成分也是活性成分,是近年来见与文献报道最多的一类化合物,具有多种药理活性,含量达12%[9],主要有葛根素、大豆苷、大豆苷元、3'-羟基葛根素、染料木苷、染料木素等。其中,葛根素因成分含量高、药理活性好受到广泛关注,研究发现葛根提取物或葛根素在糖尿病或糖尿病诱发肝脏脂肪变性、肾病、视网膜病变、心脑血管病、神经性病变、骨质疏松、糖尿病足、生殖系统功能障碍等方面具有一定的治疗效果(见表 1、表 2),本文针对多项研究报道具体探讨如下。
葛根提取物及其主要成分葛根素在多种糖尿病模型中都显示出了明显的降血糖、降血脂、改善胰岛素抵抗的作用。葛根提取物可显著降低C57BL/6J ob/ob小鼠空腹血糖,降低血清总胆固醇和甘油三酯水平,降低STZ诱导糖尿病大鼠的血糖及糖化血红蛋白含量(HbA1c)[10],改善肥胖小鼠的血糖、血脂、胰岛素血、口服糖耐量[11-12]等。
异黄酮类化合物葛根素是葛根中的主要有效成分,近年来,研究发现葛根素可降低高脂饮食及四氧嘧啶诱导的糖尿病胰岛素抵抗大鼠的血糖,降低血中胰岛素水平,提高胰岛素敏感性指数,改善高胰岛素血症,增加肝糖原的含量,改善机体的糖代谢,降低血中总胆固醇和甘油三酯水平,改善血脂[13]。同时,葛根素还可改善链脲佐菌素(STZ)对小鼠的胰腺损伤,上调胰腺中胰岛素受体底物1(IRS-1)和胰岛素样生长因子(IGF-1)的蛋白表达[14],抑制STZ诱导的糖尿病鼠胰岛β细胞的凋亡,提高血清胰岛素含量,其对β细胞的保护作用可能是通过调节磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)途径,进而发挥降血糖改善糖耐量的作用[15];也可以通过上调胰高血糖素样肽-1受体(GLP-1R)和胰十二指肠同源盒因子-1(PDX-1)的表达,增强GLP-1R信号通路的传导的方式保护β细胞[16];还可以通过减轻氧化应激损伤,保护端粒长度进而抑制β细胞凋亡,或增强沉默信息调节因子1(SIRT1)活性,减少解偶联蛋白2(UCP2)表达等途径保护β细胞[17-18]。葛根素能提高肌肉中胰岛素受体(InsR)和过氧化物酶体增殖物激活受体α(PPARα)mRNA的表达[14],提高过氧化物酶体增殖物激活受体γ共激活因子-1α(PGC-1α)表达增强肌肉能量代谢,防止肌肉萎缩[19];提高比目鱼肌中的葡萄糖转运体4(GLUT4)的表达,增强葡萄糖的利用,从而降低血糖[20];促进胰岛素抵抗状态下3T3-L1脂肪细胞的葡萄糖代谢,改善胰岛素抵抗[21]。总之,葛根降糖作用的研究主要集中于改善胰岛素抵抗,保护胰岛β细胞,促进糖代谢,机制侧重于对胰岛素信号通路、胰高血糖素受体信号通路、葡萄糖转运及代谢、减轻β细胞氧化应激损伤等方面的研究。
1.2 改善糖尿病肝脏脂肪变性肝脏是常见的糖尿病病变部位,肝脏脂肪变性是最常见的病变之一,由肝脏脂肪易位堆积等诱发,引起单纯性脂肪肝、脂肪性肝炎甚至肝硬化等。于中医而言,其主要病机即为肝郁脾虚,痰瘀互结或湿热内蕴,郁积于肝[22],因此主要需从肝脾论治本病。糖尿病引起的肝脏脂肪变性常见肝细胞内显著的脂质沉积[以甘油三酯(TG)为主要形式]和肝脏酶的持续异常[23-24]。糖尿病的存在增加了肝脏疾病的风险,有可能发展为非酒精性脂肪性肝炎,肝硬化等[25]。
葛根素能降低高脂饮食联合STZ诱导的糖尿病大鼠肝脏脂质含量,通过调节血糖、改善脂质代谢紊乱来减轻糖尿病肝脂肪变性,减轻肝硬化,通过使核转录因子-κB(NF-κB)信号通路失活抑制氧化应激和炎症,从而下调白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)的mRNA表达,葛根素对糖尿病肝损伤的保护可能与抑制转化生长因子-β(TGF-β)/Smad2信号传导有关[26]。目前葛根或葛根中有效成分对肝脏疾病的研究多为单一性研究肝脏脂肪变性,而对糖尿病合并肝脏脂肪变性的复合病症的研究相对较少,对并发症下糖脂代谢的相关性及其机制的影响尚需深入探讨。
1.3 改善糖尿病肾病糖尿病肾病(DN)是一种主要的Ⅰ型、Ⅱ型糖尿病微血管并发症[27],以肾小球基底膜增厚、系膜扩张、肾小球硬化、肾小管间质纤维化为主要特点[28],该病在国内发病率逐渐增长,但发病机理尚未完全阐明。由于代谢紊乱存在内在复杂性,晚期DN相较于其他肾脏疾病更难治疗,因此,对于糖尿病肾病患者而言进行早期治疗非常重要[29]。
TGF-β1是一种促纤维生长因子,在糖尿病肾病中具有重要作用[30],在肾纤维化发病机理中是一种关键介质[31],高血糖可引起肾脏中的TGF-β1的基因和蛋白高表达[32]。TGF-β1/Smad2信号通路过度激活可导致肾脏中细胞外基质(ECM)聚集,从而直接或间接的导致糖尿病诊断标志物结缔组织生长因子(CTGF)和纤维连接蛋白(FN)的产生[32]。研究表明,葛根素可显著降低STZ诱导的糖尿病大鼠的肾重,降低血清肌酐、尿素氮、尿蛋白、肾小球细胞外基质的水平,降低肾脏TGF-β1、Smad2、CTGF、FN的mRNA和蛋白的表达[29, 32, 33]。已有研究证明基质金属蛋白酶-9(MMP-9)和糖尿病之间存在遗传相关性,在大鼠注射STZ 7天后即糖尿病早期的肾小球中MMP-9的表达量显著升高,当给予葛根素后显著提高足细胞裂隙隔膜蛋白(podocyte slit diaphragm proteins)表达(如肾病蛋白nephrin和膜蛋白podocin),抑制糖尿病肾脏氧化应激的产生和蛋白的亚硝基化,抑制MMP-9 mRNA的表达[34]。SIRT1是研究糖尿病肾病的一种潜在的靶标蛋白[35],有研究表明葛根素也可以通过调控SIRT1/FOXO1信号通路发挥对糖尿病肾病的肾保护作用,明显改善肾小球肥大、肾小球塌陷、肾小球基底膜厚度和管状空泡变性、线粒体损伤[36];降低晚期糖基化终末产物(AGEs)含量、抑制肾脏特异性细胞受体(RAGE)mRNA的表达来改善肾组织损伤[37];免疫组化结果也显示葛根素显著降低胞间黏附分子(ICAM-1)和TNF-α的表达,降低肾皮质细胞的凋亡指数[29]。
1.4 改善糖尿病视网膜病变糖尿病视网膜病变(DR)是糖尿病微血管并发症[38],以视网膜微脉管系统损伤或毛细血管通透性增强等为特点[39]。DR的发展包括非增生性和增生性两个阶段,早期阶段主要涉及血管细胞丢失、血管渗漏和血-视网膜屏障的破坏,随着疾病的发展,新血管逐渐形成,增殖性糖尿病视网膜病变阶段开始[40]。葛根素可以上调视网膜血管内皮生长因子(VEGF)和低氧诱导因子-1(HIF-1α)的基因表达,对STZ诱导的糖尿病大鼠视网膜病变有显著的保护作用[41],而VEGF是一种血管生成和血管通透性因子,在增生性糖尿病性视网膜病变(PDR)患者眼睛的玻璃体和水性液体中的含量显著提高[42];葛根素可以通过Fas/FasL通路介导ONOO-水平下调、抑制诱导型一氧化氮合酶(iNOS)mRNA表达,并减少视网膜色素上皮(RPE)细胞的凋亡[43-44];还能通过下调视网膜组织中信号转导因子和转录激活因子3(STAT3)的表达水平,减少视网膜氧化应激损伤[45],以上表明葛根素可作为治疗糖尿病视网膜病变的潜在药物。
1.5 改善糖尿病血管功能障碍血管的收缩和舒张受血管活性物质(如血管紧张素Ⅱ、ET、PGEs、NO等)调控,STZ诱导的糖尿病大鼠血管活性物质发生变化,随着血糖增高,血管平滑肌增生,主动脉出现病理变化,发生血管功能障碍。葛根素可减弱血管平滑肌细胞(VSMCs)的钙化[46],显著抑制高糖诱导的VSMC增生,减少活性氧(ROS)的产生,降低烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶活性,显著抑制蛋白激酶Cβ2(PKCβ2)和Rac1、p47phox、p67phox蛋白亚基的磷酸化和膜转位,在体动物实验也证实葛根素可减弱Zucker肥胖大鼠泡沫化损伤引起的新生内膜的形成[47],因此,葛根素发挥抗VSMC增生的作用可能是通过PKCβ2/Rac1依赖的ROS通路实现的。进一步通过对STZ诱导糖尿病大鼠模型的主动脉损伤作用机制的研究中发现,葛根素可抑制NADPH氧化酶(NOX2、NOX4)诱导的氧化应激、抑制NF-κB、ICAM-1、NOX2、NOX4的mRNA及蛋白表达来改善糖尿病主动脉损伤[48]。而抑制血红素氧合酶-1(HO-1)蛋白活性可能是葛根素改善急性血管功能障碍的另一种机制[49]。另外葛根素还可以阻止蛋白糖基化的进程,减少血管中晚期糖基化终末产物(AGEs)的形成,下调晚期糖基化终产物受体(RAGE)的表达,进而发挥治疗糖尿病血管并发症的作用[50]。上述研究表明葛根素可能通过调控氧化应激、抗炎、降低糖基化终产物等机制改善血管功能障碍。
1.6 改善糖尿病心脏功能心脏中能量底物的摄取取决于肌纤维膜上脂肪酸和葡萄糖转运体,GLUT4是心脏主要的葡萄糖转运蛋白,分化抗原36(CD36)是脂肪酸转运蛋白,糖尿病使心脏能量代谢受阻,抑制了葡萄糖的消耗而依赖于脂肪酸转运,研究表明葛根素能提高GLUT4蛋白的表达和易位、降低CD36蛋白的表达和易位,提高AKT的磷酸化水平,升高PPARγ的表达,降低PPARα的表达,从而降低心肌损伤、改善糖尿病鼠心脏功能[51-52]。此外,葛根素还能改善STZ诱导糖尿病大鼠的左心室收缩、舒张压等心功能指标,降低心肌细胞中血小板反应素1(TSP-1)mRNA的表达[53];降低血糖、减少糖尿病大鼠心肌胶原含量及心肌线粒体ROS水平,抑制心肌线粒体丙二醛(MDA)含量,增加心肌线粒体超氧化物歧化酶(SOD)活性,降低TNF-α的释放[54, 55]。上述研究提示葛根素能改善糖尿病鼠心肌细胞的高糖损伤和维持心室肌细胞的功能,该机制可能与抑制心肌细胞血小板反应蛋白-1(TSP-1)表达的水平、抑制血糖升高、减轻心肌线粒体氧化应激损伤、抗炎等有关。
1.7 改善糖尿病骨质疏松症糖尿病可通过多种机制影响骨组织,例如高胰岛素血、AGEs沉积、IGF-1降低、高钙尿、肾衰竭、微血管病以及炎症等[56]。也有数据统计表明糖尿病病人更易增加髋骨折风险[57]。研究表明葛根素可以通过改善骨密度,增加成骨细胞数量,下调Caspase-3的mRNA表达来改善糖尿病骨质疏松症[58]。
1.8 改善糖尿病性周围神经病变糖尿病性周围神经病变(DPN)是一种由糖尿病引起的最常见的神经病变之一,约50%的糖尿病病人会发展成DPN[59],临床表现为间歇性或持续性肢体疼痛、灼烧感或斧凿般疼痛[60]。西医对于DPN尚无有效治疗方法,90年代以来,葛根素注射液开始用于治疗DPN,能够改善病人神经传导速率(NCV)指数,下调血浆粘度、纤维蛋白原和糖化血红蛋白指数[60],但目前对葛根治疗DPN的机制研究还较少,尚需深入探究。
1.9 改善糖尿病足糖尿病足(DFU)是糖尿病常见的并发症之一,是糖尿病并发神经、血管病变所引起的下肢病变的总称,它是一种全身性疾病,严重影响患者的生活质量[61-62]。目前在糖尿病足溃疡发病机制上普遍被接受的观点是糖尿病足的三元学说:即糖尿病神经病变、糖尿病缺血病变和局部感染[63]。采用葛根素对DFU患者治疗32 d后观察到血浆中ET、LPO和TXB2水平显著降低,CGRP、SOD和6-K-PGI2水平均有增加,提示葛根素治疗DFU的机理可能是抑制ET的过量分泌,提高CGRP的水平,促进内皮细胞功能的恢复,进而兴奋前列环素(PGI2)合成酶活性,显著提高内皮细胞(EC)生成PGI2,抑制血小板聚集,起到改善微循环的作用[64],而更深入的机制研究有待进一步探索。
1.10 改善糖尿病生殖功能障碍多项研究表明,糖尿病可导致生殖功能障碍和性功能减退[65-66],在糖尿病男性和糖尿病雄性动物中均发现睾酮水平降低,出现睾丸功能障碍和精子生成障碍,导致勃起功能障碍、精子活性减弱及精液减少[67]。糖尿病会导致睾丸组织结构和功能异常,给予葛根素后可观察到睾丸的组织形态结构趋于正常,并能使睾丸组织中NO含量升高,内皮型一氧化氮合酶(eNOS)的mRNA表达量增加,雄激素受体(AR)的mRNA表达降低,SOD、Ca2+-ATPase、Na+-K+-ATPase活性升高,MDA含量降低,提示葛根素能在一定程度上提高机体的抗氧化能力,减轻睾丸氧化应激损伤,另外葛根素还能提高糖尿病大鼠睾丸NO、CGRP含量,下调ET-1的mRNA表达,提示葛根素对维持血管张力、改善血供、预防糖尿病睾丸损伤有一定作用[68]。
2 讨论葛根作为传统中药有着悠久的应用历史,在糖尿病的应用上早已引起人们的重视,葛根或从葛根中得到的多种活性成分已开始应用于糖尿病或其并发症的研究中,并发现了葛根治疗糖尿病的多种途径。而代谢性疾病的病机复杂多样,对单一疾病的研究不能完全解释疾病过程,因此对并发症的研究尤为重要,这对疾病的后续治疗有重要指导意义。目前葛根对糖尿病及多种并发症的研究尚有局限,且葛根中多种成分对糖尿病或并发症的机制研究更是不足,因此,深入研究葛根及其活性成分对糖尿病并发症的作用及机制十分必要,为临床多种途径、多种方式治疗疾病提供科学依据。
| [1] |
孟祥云, 郭树明, 杨丽霞. 中药植物多糖对2型糖尿病胰岛素抵抗的作用机制研究进展[J]. 中国实验方剂学杂志, 2017, 23(8): 220-225. |
| [2] |
Niu J, Xu G, Jiang S, et al. In Vitro Antioxidant activities and anti-diabetic effect of a polysaccharide from Schisandra sphenanthera in rats with type 2 diabetes[J]. Int J Biol Macromol, 2017, 94(Pt A): 154-160. |
| [3] |
Cheng W, Wu P, Du Y, et al. Puerarin improves cardiac function through regulation of energy metabolism in Streptozotocin-Nicotinamide induced diabetic mice after myocardial infarction[J]. Biochem Bioph Res Co, 2015, 463(4): 1108-1114. |
| [4] |
Zhong Y, Zhang X, Cai X, et al. Puerarin attenuated early diabetic kidney injury through down-regulation of matrix metalloproteinase 9 in streptozotocin-induced diabetic rats[J]. PLoS One, 2014, 9(1): e85690. |
| [5] |
Fletcher EL, Phipps JA, Ward MM, et al. Neuronal and glial cell abnormality as predictors of progression of diabetic retinopathy[J]. Curr Pharm Des, 2007, 13(26): 2699-2712. |
| [6] |
Azmi S, Petropoulos IN, Ferdousi M, et al. An update on the diagnosis and treatment of diabetic somatic and autonomic neuropathy[J]. F1000Res, 2019, 8. |
| [7] |
Cusi K, Sanyal AJ, Zhang S, et al. Non-alcoholic fatty liver disease (NAFLD) prevalence and its metabolic associations in patients with type 1 diabetes and type 2 diabetes[J]. Diabetes Obes Metab, 2017, 19(11): 1630-1634. |
| [8] |
陈忠云, 杨叔禹. 中医药改善2型糖尿病胰岛素抵抗的病理生理学机制研究进展[J]. 福建医药杂志, 2017, 39(3): 140-142. |
| [9] |
迟霁菲.葛根化学成分和质量控制方法研究[D].沈阳: 沈阳药科大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10163-2006177489.htm
|
| [10] |
曾明, 张汉明, 郑水庆, 等. 葛根提取物对糖尿病大鼠血糖和血流动力学的影响[J]. 解放军药学学报, 2004(4): 293-294. |
| [11] |
Prasain JK, Peng N, Rajbhandari R, et al. The Chinese Pueraria root extract (Pueraria lobata) ameliorates impaired glucose and lipid metabolism in obese mice[J]. Phytomedicine, 2012, 20(1): 17-23. |
| [12] |
Jung HW, Kang AN, Kang SY, et al. The root extract of Pueraria lobata and its main compound, puerarin, prevent obesity by increasing the energy metabolism in skeletal muscle[J]. Nutrients, 2017, 9(1): 33. |
| [13] |
郑王巧, 宋丽华, 李海菊, 等. 葛根素对Ⅱ型糖尿病大鼠血糖和血脂的影响[J]. 长治医学院学报, 2009, 23(2): 99-101. |
| [14] |
Wu K, Liang T, Duan X, et al. Anti-diabetic effects of puerarin, isolated from Pueraria lobata (Willd.), on streptozotocin-diabetogenic mice through promoting insulin expression and ameliorating metabolic function[J]. Food Chem Toxicol, 2013, 60: 341-347. |
| [15] |
Li Z, Shangguan Z, Liu Y, et al. Puerarin protects pancreatic β-cell survival via PI3K/Akt signaling pathway[J]. J Mol Endocrinol, 2014, 53(1): 71-79. |
| [16] |
Yang L, Yao D, Yang H, et al. Puerarin protects pancreatic β-cells in obese diabetic mice via activation of GLP-1R signaling[J]. Mol Endocrinol, 2016, 30(3): 361-371. |
| [17] |
陈秀芳, 雷康福, 董敏, 等. 葛根素对2型糖尿病大鼠胰腺β细胞损伤的影响[J]. 温州医科大学学报, 2017, 47(12): 859-863. |
| [18] |
F X, X S, L G, et al. Puerarin protects rat pancreatic islets from damage by hydrogen peroxide[J]. Eur J Pharmacol, 2006, 529(1-3): 1-7. |
| [19] |
Jung HW, Kang AN, Kang SY, et al. The root extract of Pueraria lobata and its main compound, puerarin, prevent obesity by increasing the energy metabolism in skeletal muscle[J]. Nutrients, 2017, 9(1): 33. |
| [20] |
Hsu FL, Liu IM, Kuo DH, et al. Antihyperglycemic effect of puerarin in streptozotocin-induced diabetic rats[J]. J Nat Prod, 2003, 66(6): 788-792. |
| [21] |
胡锐, 李宝莉, 赵勤, 等. 葛根素对3T3-L1前脂肪细胞分化及胰岛素抵抗模型糖代谢的影响[J]. 中药药理与临床, 2012, 28(3): 41-43. |
| [22] |
史丽伟, 倪青, 冯玲, 等. 中医对2型糖尿病合并非酒精性脂肪肝的认识和展望[J]. 辽宁中医杂志, 2019, 46(1): 208-212. |
| [23] |
El-Kader SMA. Non-alcoholic fatty liver disease:The diagnosis and management[J]. World J Hepatol, 2015, 7(6): 846. |
| [24] |
孙秀芹. 2型糖尿病合并非酒精性脂肪肝相关因素分析[J]. 中国预防医学杂志, 2019, 20(1): 78-80. |
| [25] |
Mu W, Cheng XF, Liu Y, et al. Potential nexus of non-alcoholic fatty liver disease and type 2 diabetes mellitus:insulin resistance between hepatic and peripheral tissues[J]. Front Pharmacol, 2018(9): 1566. |
| [26] |
Hou B, Zhao Y, Qiang G, et al. Puerarin mitigates diabetic hepatic steatosis and fibrosis by inhibiting TGF-β signaling pathway activation in type 2 diabetic rats[J]. Oxid Med Cell Longev, 2018(2018): 1-13. |
| [27] |
Ma T, Zheng Z, Guo H, et al. 4-O-methylhonokiol ameliorates type 2 diabetes-induced nephropathy in mice likely by activation of AMPK-mediated fatty acid oxidation and Nrf2-mediated anti-oxidative stress[J]. Toxicol Appl Pharm, 2019(370): 93-105. |
| [28] |
Li J, Qu X, Yao J, et al. Blockade of endothelial-mesenchymal transition by a Smad3 inhibitor delays the early development of streptozotocin-induced diabetic nephropathy[J]. Diabetes, 2010, 59(10): 2612-2624. |
| [29] |
Pan X, Wang J, Pu Y, et al. Effect of puerarin on expression of ICAM-1 and TNF-α in kidneys of diabetic rats[J]. Med Sci Monit, 2015, 21: 2134-2140. |
| [30] |
Miyauchi K, Takiyama Y, Honjyo J, et al. Upregulated IL-18 expression in type 2 diabetic subjects with nephropathy:TGF-β1 enhanced IL-18 expression in human renal proximal tubular epithelial cells[J]. Diabetes Res Clin Pract, 2009, 83(2): 190-199. |
| [31] |
Lan H Y, Chung ACK. TGF-β/Smad Signaling in Kidney Disease[J]. Semin Nephrol, 2012, 32(3): 236-243. |
| [32] |
She S, Liu W, Li T, et al. Effects of puerarin in STZ-induced diabetic rats by oxidative stress and the TGF-β1/Smad2 pathway[J]. Food Funct, 2014, 5(5): 944-950. |
| [33] |
Li Q, Xiao Y, Gong H, et al. Effect of puerarin on the expression of extracellular matrix in rats with streptozotocin-induced diabetic nephropathy[J]. Natl Med J India, 2009, 22(1): 9-12. |
| [34] |
Zhong Y, Zhang X, Cai X, et al. Puerarin attenuated early diabetic kidney injury through down-regulation of matrix metalloproteinase 9 in streptozotocin-induced diabetic rats[J]. PLoS One, 2014, 9(1): e85690. |
| [35] |
Zhong Y, Lee K, He JC. SIRT1 is a potential drug target for treatment of diabetic kidney disease[J]. Front Endocrinol (Lausanne), 2018, 9: 624. |
| [36] |
Xu X, Zheng N, Chen Z, et al. Puerarin, isolated from Pueraria lobata (Willd.), protects against diabetic nephropathy by attenuating oxidative stress[J]. Gene, 2016, 591(2): 411-416. |
| [37] |
Shen JG, Yao MF, Chen XC, et al. Effects of puerarin on receptor for advanced glycation end products in nephridial tissue of streptozotocin-induced diabetic rats[J]. Mol Biol Rep, 2009, 36(8): 2229-2233. |
| [38] |
Ren C, Liu W, Li J, et al. Physical activity and risk of diabetic retinopathy:a systematic review and meta-analysis[J]. Acta Diabetol, 2019. |
| [39] |
Dong C, Liu P, Wang H, et al. Ginsenoside Rb1 attenuates diabetic retinopathy in streptozotocin-induced diabetic rats[J]. Acta Cir Bras, 2019, 34(2): e201900201. |
| [40] |
Cheng Y, Yu X, Zhang J, et al. Pancreatic kallikrein protects against diabetic retinopathy in KK Cg-Ay/J and high-fat diet/streptozotocin-induced mouse models of type 2 diabetes[J]. Diabetologia, 2019, 62(11): 1-13. |
| [41] |
Teng Y, Cui H, Yang M, et al. Protective effect of puerarin on diabetic retinopathy in rats[J]. Mol Biol Rep, 2009, 36(5): 1129-1133. |
| [42] |
Adamis AP, Miller JW, Bernal M, et al. Increased vascular endothelial growth factor levels in the vitreous of eyes with proliferative diabetic retinopathy[J]. Am J Ophthalmol, 1994, 118(4): 445-450. |
| [43] |
Hao LN, Wang M, Ma JL, et al. Puerarin decreases apoptosis of retinal pigment epithelial cells in diabetic rats by reducing peroxynitrite level and iNOS expression[J]. Sheng Li Xue Bao, 2012, 64(2): 199-206. |
| [44] |
Hao LN, Zhang YQ, Shen YH, et al. Effect of puerarin on retinal pigment epithelial cells apoptosis induced partly by peroxynitrite via Fas/FasL pathway[J]. Int J Ophthalmol, 2010, 3(4): 283-287. |
| [45] |
Cai Y, Zhang X, Xu X, et al. Effects of puerarin on the retina and STAT3 expression in diabetic rats[J]. Exp Ther Med, 2017, 14(6): 5480-5484. |
| [46] |
Lu Q, Xiang DX, Yuan HY, et al. Puerarin attenuates calcification of vascular smooth muscle cells[J]. Am J Chin Med, 2014, 42(2): 337-347. |
| [47] |
Zhu LH, Wang L, Wang D, et al. Puerarin attenuates high-glucose-and diabetes-induced vascular smooth muscle cell proliferation by blocking PKCβ2/Rac1-dependent signaling[J]. Free Radic Biol Med, 2010, 48(4): 471-482. |
| [48] |
Li W, Zhao W, Wu Q, et al. Puerarin improves diabetic aorta injury by inhibiting NADPH oxidase-derived oxidative stress in STZ-induced diabetic rats[J]. J Diabetes Res, 2016(2016): 8541520. |
| [49] |
Meng XH, Ni C, Zhu L, et al. Puerarin protects against high glucose-induced acute vascular dysfunction:role of heme oxygenase-1 in rat thoracic aorta[J]. Vascul Pharmacol, 2009, 50(3-4): 110-115. |
| [50] |
茅彩萍, 顾振纶. 葛根素对糖尿病大鼠主动脉糖基化终产物的形成及其受体表达的影响[J]. 中国药理学通报, 2004, 20(4): 393-397. |
| [51] |
Cheng W, Wu P, Du Y, et al. Puerarin improves cardiac function through regulation of energy metabolism in Streptozotocin-Nicotinamide induced diabetic mice after myocardial infarction[J]. Biochem Bioph Res Co, 2015, 463(4): 1108-1114. |
| [52] |
陈秀芳, 雷康福, 董敏, 等. 葛根素对糖尿病大鼠心肌损伤的影响[J]. 中国病理生理杂志, 2010, 26(4): 650-655. |
| [53] |
潘振宇, 包兆胜, 吴仲敏, 等. 葛根素对糖尿病心肌细胞的保护及其机制研究[J]. 分子细胞生物学报, 2009, 42(2): 137-144. |
| [54] |
顾掌生, 王大力. 葛根素抗糖尿病大鼠心肌线粒体氧化应激损伤作用研究[J]. 中华中医药学刊, 2010, 28(10): 2197-2200. |
| [55] |
张一弛, 解砚英, 牟艳玲, 等. 葛根素对糖尿病大鼠心功能及血清TNF-α水平的影响[J]. 中国药理学通报, 2011, 27(12): 1700-1704. |
| [56] |
Montagnani A, Gonnelli S, Alessandri M, et al. Osteoporosis and risk of fracture in patients with diabetes:an update[J]. Aging Clin Exp Res, 2011, 23(2): 84-90. |
| [57] |
Janghorbani M, Van Dam RM, Willett WC, et al. Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture[J]. Am J Epidemiol, 2007, 166(5): 495-505. |
| [58] |
Liang J, Chen H, Pan W, et al. Puerarin inhibits caspase-3 expression in osteoblasts of diabetic rats[J]. Mol Med Rep, 2012, 5(6): 1419-1422. |
| [59] |
Tesfaye S, Selvarajah D. Advances in the epidemiology, pathogenesis and management of diabetic peripheral neuropathy[J]. Diabetes-Metab Res, 2012(28): 8-14. |
| [60] |
Wu J, Zhang X, Zhang B. Efficacy and safety of puerarin injection in treatment of diabetic peripheral neuropathy:a systematic review and meta-analysis of randomized controlled trials[J]. J Tradit Chin Med, 2014, 34(4): 401-410. |
| [61] |
Shi R, Lian W, Han S, et al. Nanosphere-mediated co-delivery of VEGF-A and PDGF-B genes for accelerating diabetic foot ulcers healing in rats[J]. Gene Ther, 2018, 25(6): 425-438. |
| [62] |
Li X, Xie X, Lian W, et al. Exosomes from adipose-derived stem cells overexpressing Nrf2 accelerate cutaneous wound healing by promoting vascularization in a diabetic foot ulcer rat model[J]. Exp Mol Med, 2018, 50(4): 29. |
| [63] |
Robert G. Frykberg, 王 玉珍. 糖尿病足溃疡的发病机理:阻碍伤口愈合的因素[J]. 国外医学.内分泌学分册, 2004, 24(5): 296-298. |
| [64] |
杨博华, 葛芃, 陈云祥. 葛根素对糖尿病足患者血管活性物质平衡的影响[J]. 中国中西医结合外科杂志, 2001, 7(5): 8-10. |
| [65] |
Musicki B, Burnett AL. Endothelial dysfunction in diabetic erectile dysfunction[J]. Int J Impot Res, 2007, 19(2): 129-138. |
| [66] |
Bener A, Al-Ansari AA, Zirie M, et al. Is male fertility associated with type 2 diabetes mellitus[J]. Int Urol Nephrol, 2009, 41(4): 777-784. |
| [67] |
Kanter M, Aktas C, Erboga M. Protective effects of quercetin against apoptosis and oxidative stress in streptozotocin-induced diabetic rat testis[J]. Food Chem Toxicol, 2012, 50(3-4): 719-725. |
| [68] |
陈秀芳, 金丽琴, 董敏, 等. 葛根素对糖尿病大鼠睾丸的保护作用[J]. 中国病理生理杂志, 2009, 25(10): 2033-2039. |
| [69] |
Zhang W, Liu C, Wang P, et al. Puerarin improves insulin resistance and modulates adipokine expression in rats fed a high-fat diet[J]. Eur J Pharmacol, 2010, 649(1-3): 398-402. |
| [70] |
黎宇, 罗新新, 严奉东, 等. 葛根上调肝胰岛素抵抗HepG2细胞OB-R, IRS2, GLUT1和GLUT2蛋白调节糖代谢的研究[J]. 中国中药杂志, 2017, 42(10): 1939-1944. |
| [71] |
刘淑霞, 陈志强, 何宁, 等. 葛根素对糖尿病大鼠肾功能及肾组织MMP-10与TIMP-1表达的影响[J]. 中草药, 2004, 35(2): 56-60. |
| [72] |
段惠军, 刘淑霞, 张玉军, 等. 葛根素对糖尿病大鼠肾功能及肾组织MMP-2与TIMP-2表达的影响[J]. 药学学报, 2004, 39(7): 481-485. |
| [73] |
刘圣, 张小力, 余娜, 等. 葛根素对早期糖尿病肾病大鼠肾组织病理变化与BMP-7蛋白及mRNA表达的影响[J]. 中国药房, 2013, 24(3): 196-200. |
| [74] |
陈秀芳, 金丽琴, 董敏, 等. 葛根素对糖尿病大鼠睾丸的保护作用[J]. 中国病理生理杂志, 2009, 25(10): 2033-2039. |
 2019, Vol. 38
2019, Vol. 38