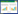文章信息
- 张巍, 邵明亮, 苗同国, 侯桂英, 戴二黑
- ZHANG Wei, SHAO Mingliang, MIAO Tongguo, HOU Guiying, DAI Erhei
- 清热利湿方对脂肪肝细胞PI3K/Ark表达调节研究
- Qingre Lishi Recipe regulate of PI3K/Ark expression in fatty liver cells
- 天津中医药大学学报, 2020, 39(1): 76-81
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(1): 76-81
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.01.17
-
文章历史
收稿日期: 2019-07-28
非酒精性脂肪性肝病(NAFLD)目前是全球范围内重要的公共健康问题。研究显示,亚洲人中脂肪性肝病的发病率约为总人口数量的四分之一[1]。中国NAFLD的发病率逐年增高,已成为仅次于病毒性肝炎威胁人类健康的第二大肝病。过度肥胖、高脂血症、高血压或糖尿病,伴发其他慢性肝炎的NAFLD患者,肝细胞内出现脂肪堆积,可能会进一步发展为肝纤维化,转变为不可逆的肝硬化,甚至肝癌。早期的诊断治疗,生活方式干预是逆转NAFLD的首要选择[2]。NAFLD发生和发展的与营养分解代谢和脂质生物循环有关,因此在此过程中主要的代谢基因、蛋白引起重点关注。线粒体ATP酶(ATPase)具有调节离子平衡功能,是线粒体呼吸链功能损伤的重要标志物,ATPase上调诱发线粒体DNA(mtDNA)异构,为细胞氧化应激损伤中关键环节。磷酸肌醇3-激酶(PI3K)广泛存在的脂质激酶,并控制细胞存活、增殖、蛋白质合成、运输的信号级联反应多种细胞过程,与细胞生长、凋亡、迁移、代谢、肿瘤增殖等发生密切相关。ATP以剂量和时间依赖性方式刺激PI3K的磷酸化[3]。腺苷磷酸酶相关蛋白激酶(Ark)为腺苷单磷酸激活蛋白激酶(AMP)家族成员蛋白激酶(Akt)的下游因子,依赖Akt的磷酸化过程而激活,为细胞营养缺乏条件下Akt的底物,介导细胞的存活﹑增殖和分化。中医药治疗脂肪性肝病所具有独特的优势已为临床熟知,但是以分子靶向为指导的药物治疗机制还未阐明。本次研究拟探讨ATPase与hs-CRP是否协同参与肝细胞损伤氧化应激反应,并对清热利湿方调节肝细胞脂肪变作用与ATPase、hs-CRP、PI3K/Ark信号通路表达关系进一步探讨,以期为脂肪肝的辨证施治提供基础理论支持。
1 研究对象 1.1 实验动物造模选取SD大鼠60只,雌性,12周龄,体质量200~250 g,(许可证号150117)。随机数字表法分为6组,高脂模型组10只、多烯磷脂酰胆碱组10只、清热利湿方(高、中、低)剂量组各10只、正常对照组10只适应性喂养1周。
大鼠脂肪肝实验动物模型采用高脂饲料(基础饲料+2%胆固醇、10%猪油)喂养6周。6周开始清热利湿组灌胃,分成高、中、低剂量分别给予给予0.3 g/(100 g·d),0.1 g/(100 g·d),0.05 g/(100 g·d)。多烯组给予25 mg/(100 g·d)灌胃12周后取材。隔夜禁食,腹腔戊巴比妥麻醉,心脏采血,低速离心制备血清。处死大鼠后取出各组肝脏,留做病理评分部分肝脏10%甲醛固定,其余置-80 ℃冰箱冷冻。
1.2 实验药物清热利湿方主要成分为青黛、郁金、生山楂、泽泻、决明子、茵陈蒿等均购自河北省乐仁堂医药有限公司,经药师鉴定后使用。将原药加双蒸水充分浸泡,在煎药机中熬制,配制成41.667 g/L的溶液备用,冀药制字:Z20051051。超敏急性时相反应蛋白(hs-CRP)、ATPase ELISA试剂盒,PI3K,Ark多克隆抗体购自博士德生物工程有限公司。
2 研究方法 2.1 脂肪肝组织病理判断标准取肝左叶同一部位组织修整后固定、脱水、包埋、制作病理切片。NAFLD的病理学诊断按照NAFLD活动度积分(NAS)评分。1)NAS为半定量评分系统规定,肝细胞脂肪变(F):0分(< 5%);1分(5%~33%);2分(34%~66%);3分(> 66%)。2)小叶内炎症(20倍镜计数坏死灶):0分,无;1分(< 2个);2分(2~4个);3分(> 4个)。3)肝细胞气球样变:0分,无;1分,少见;2分,多见。
2.2 血清hs-CRP,ATPase表达观察取离心后血清1 mL,观察各实验组大鼠血清hs-CRP及ATPase活性,按ELISA试剂盒说明分别检测。各实验组血脂、肝功能比较采用自动化分析仪检测甘油三脂(TG),胆固醇(TC)及肝功能(ALT/AST/GGT)判断脂肪肝细胞炎症活动程度。
2.3 Western blot检测脂肪肝细胞PI3K/Ark取肝组织5 g加入磷酸盐缓冲溶液(PBS)漂洗匀浆迅速碾磨。加入组织裂解液RIPA约500 μL,冰上作用20~30 min,4 ℃离心,12 000 r/min离心15 min。吸取2 μL的上清,测定蛋白浓度。其余上清与蛋白(4:1的比例)加入缓冲液,瞬时离心放入-20 ℃冰箱冻存备用。
SDS-聚丙烯酰胺凝胶加入20 μg蛋白样品,浓缩胶电泳(恒流28 mA,约1 h)。分离胶电泳15 V/cm(100/120 V)指示剂至分离胶底部时完毕。在转膜缓冲液中将裁下的凝胶、NC膜浸泡10 min,从负极到正极按照顺序将纤维帕、3块滤纸、PAGE胶、膜、3块滤纸逐层铺好,并且加转膜缓冲液,转膜(100 V/200 mA)1 h。封闭液封闭1 h。一抗(PI3K)/Ark)4 ℃过夜。滴加1×三乙醇胺缓冲溶液(TBS)稀释的HRP二抗(1:800),37 ℃,1 h后ECL发光显色。
数据处理通过伯乐凝胶成像系统Gel Doc XR+ Image tool图像分析软件读取目的条带上测得的激光光密度扫描值,以各组β-actin条带的扫描值标化其相应蛋白表达量。
3 统计分析应用SPSS 20.0统计软件统计处理。实验数据以均数±标准差(x±s)表示,组间两两比较若方差齐采用LSD法,若方差齐采用Duunett’s T3法。以P<0.05为差异有统计学意义。
4 结果 4.1 常规病理检查结果比较12周模型组常规苏森精-伊红(HE)染色,低倍光镜下观察以脂变细胞占肝小叶的1/2~2/3或2/3以上,细胞增大或肿胀,胞浆内充满脂滴空泡,肝窦狭窄、极度狭窄甚至闭塞,为造模成功。从低倍镜下模型组观察发现,高脂模型组肝细胞呈现肿胀,气球样变,伴有中度脂肪变性,呈现脂肪变改变。按照脂肪肝程度评分(F),高脂模型组(5.30±0.14)分,对照组0分,多烯磷脂酰胆碱组(2.51±0.13)分,清热利湿低剂量组(4.30±0.51)分,清热利湿中剂量组(3.61±0.73)分,清热利湿高剂量组(2.17±0.15)分。经多烯磷脂酰胆碱、清热利湿方治疗,脂肪性变性程度下降,肝细胞脂肪变评分明显改善,见图 1。
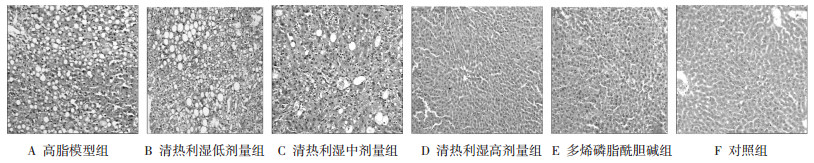
|
| 图 1 清热利湿方对各组脂肪肝细胞作用观察(低倍镜100×) |
从图 2可见模型组转氨酶(ALT)TC的改变具有相关性(Y=0.026 4X+1.699 4),谷氨酰转移酶(GGT)与TG具有相关性(Y=0.102X-1.351 2)。表 1可见,清热利湿可以有效减低ALT、TC、TG水平,显著改善肝功能。其中清热利湿高剂量组与高脂模型组ALT、TC、TG比较差异具有统计学意义(P<0.05)。清热利湿中剂量组与模型组谷氨酰转移酶(GGT)、TG比较差异具有统计学意义(P<0.05)。
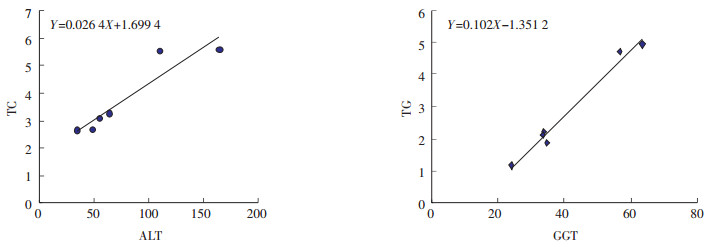
|
| 图 2 脂肪肝大鼠血清肝功能与血脂水平相关性观察 |
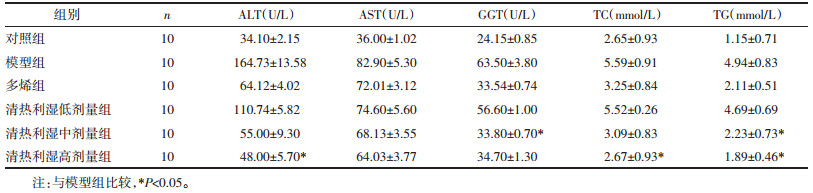
从表 2中可以发现,高脂模型组hs-CRP明显升高,ATP显著下降,hs-CRP与ATP水平具有负相关(Y=-2.528 7X+29.347)见图 3。高脂模型组hs-CRP与清热利湿高剂量组比较差异具有统计学意义(P<0.05)。清热利湿高剂量组ATP与高脂模型组比较差异具有统计学意义(P<0.05),其他组别两两比较无显著差异。
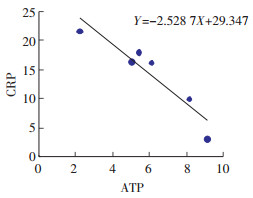
|
| 图 3 脂肪肝大鼠血清hs-CRP与ATP相关性 |
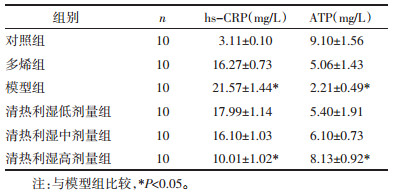
根据血清检测结果,选用模型组、多烯组、清热利湿高剂量组、清热利湿中剂量组、清热利湿低剂量组、进一步进行表达蛋白印迹实验。图 4,表 3实验结果可以看出,对照组PI3K,Ark表达较低,模型组PI3K,Ark表达量较高,高剂量组与模型组比较PI3K,Ark表达差异具有统计学意义。
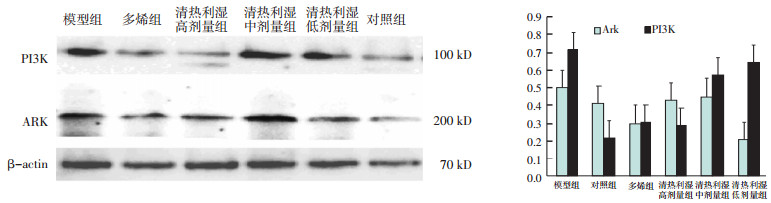
|
| 图 4 清热利湿方对各实验组PI3K/Ark表达比较 |
NAFLD的发病基础非常复杂,主要包括遗传因素、饮食因素、胰岛素抵抗、脂肪因子及炎症因子参与和肠道激素的改变等因素[4-5]。脂肪肝按照传统医学辨证属于“肥气”“积证”“痞满”“胁痛”,本病的主要病机为本虚标实。本虚主要是肝阴不足,脾肾气虚;标实主要为痰浊内蕴夹瘀,致使痰瘀互结而发病[6]。诱因往往起于“过食肥甘厚味”导致慢性营养过剩,久坐不动的生活方式促进新陈代谢失衡。脾虚湿滞,脾虚则运化功能失调,出现以脾胃健运失衡,饮食腐熟不及,脾之清气不升,胃之浊气不降,久则损脾碍胃,脾胃之腐熟、运化功能进一步受损[7]。肝疏泄功能失职,情志亦会随之发生变化,水谷精微输布失调,内生痰湿,“痰证”“痰浊”“痰癖”痰湿瘀阻互结,痹阻肝脏脉络而形成脂肪肝,壅塞于肝,形成痰血阻滞,日久生热,湿热内蕴,阻滞气机运行,肝失调达,痰浊聚于肝,日久加重则成肝癖,终致“肝壅”“胁痛”等症[8-9]。
临床脂肪肝的治疗主要是降脂,增加维生素的摄入量和控制饮食脂肪肝的治疗还需要兼顾肝脏病变、血脂异常、肥胖、胰岛素抵抗以及糖尿病。本院在临床治疗中强调审证求因,辨证论治,重视去除根本患病因素,研制出清热利湿方治疗脂肪肝。清热利湿方中选用青黛、茵陈蒿利胆清热健脾,柴胡疏肝理气,郁金活血行气解郁,凉血利胆,茯苓、泽泻燥湿化痰,各方相互配伍具有清热祛湿消痰,健脾消积降脂,发挥益气活血、祛瘀消痰之功。经过近5年临床应用观察,取得肯定的治疗效果。
药理学研究证实,青黛粉治疗实验性高脂动物,可降低肝中52% TG。青黛所含的丰富的磷脂酰胆碱促进肝中脂肪的氧化作用,显著降TG,阻止TC在肝内沉积,降低肝内脂质含量,发挥对实验性动脉粥样硬化模型性有降脂作用[10]。何首乌主要成分二苯乙烯苷对过氧化玉米所致大鼠脂肪肝动物模型有效,明显对抗肝功能损害,肝中过氧化脂质含量。决明子蛋白质和蒽酯苷成分,降低高脂血症大鼠的TC、TG和低密度脂蛋白胆固醇(LDL-C)[11]。泽泻影响内源性胆固醇代谢及抑制肝内TG的合成,影响与TC有关的酶选择性抑制外源性TG、TC的吸收而抑制脂肪肝。由于中医病机把握准确,治法严谨,遣方用药合理,临床观察中发现清热利湿方能促进肝脏循环,抑制外源性胆固醇的吸收,改善肝脏脂肪代谢,达到治疗脂肪肝的目的[12]。
线粒体的能量代谢体系是脂肪性肝病的靶点之一。细胞内线粒体功能是依据独立的DNA编码多肽,合成脂类氧化磷酸化系统所需成分,以及细胞活动必须的能量ATP。线粒体对DNA损伤的修复能力弱,很容易被氧化应激损伤[13]。NAFLD模型出现肝细胞线粒体脂质过氧化和细胞能量失衡,释放大量的hs-CRP及自由基,引起PI3K/Ark信号途径激活,引发肝脏的细胞凋亡,进一步激活肝脏星状细胞,从而产生肝细胞的炎症、坏死、纤维化、氧化应激游离原子团产生,以至聚集氧化产物清除失衡。肝细胞中线粒体内氧化反应率的提高,引起活性氧数量增加直接导致ATP酶形态学改变,脂肪动员障碍,发生代谢紊乱。脂肪性肝病细胞中存在巨型线粒体通过电镜检查得以证实。ATPase基因编码ATP合成酶,ATP酶复合物的重要组成部分。细胞的损害和参与反应的活性氧增加导致ATP的消耗。本实验结果显示随着对大鼠肝细胞的损伤逐渐加重,大鼠肝细胞线粒体ATPase减低。清热高剂量组与模型组大鼠肝细胞ATP表达存在明显差异,清热利湿方治疗后,明显提高表达水平,说明清热利湿方可以调节肝细胞脂质氧化损伤,减低肝细胞炎症程度,ATP合成增强。同时脂肪肝模型大鼠血清中CRP呈现异常升高,清热利湿方治疗后炎症过氧化损伤明显缓解。结果提示清热利湿方通过降低过氧化损伤因子以及提高抗氧化损伤双向调节脂肪肝细胞的病理状态,具有治疗作用。
PI3K信号通路(胰岛素受体底物/磷脂酰肌醇-3-激酶/蛋白激酶B,IRS/PI3K/Akt)是胰岛素信号通路中的经典通路。已有大量研究表明该信号通路调控机体的营养代谢活动,促使机体糖原、脂肪和蛋白质的合成[14]。随着脂肪酸β-氧化的减少脂肪生成增加导致肝细胞中TG的积累,其与活性氧水平的增加相结合,导致脂肪性肝炎患者的胰岛素抵抗。线粒体应激和损伤促进细胞死亡,肝纤维化,炎症和对病毒感染的先天免疫反应。肝组织中观察到超微结构线粒体损伤,线粒体动力学改变,呼吸链复合物活性降低以及合成三磷酸腺苷的能力受损。PI3K/Ark信号途径激活在脂类异常、氧化代谢导致损伤中发挥重要作用。PI3K通路激活引起磷酸化,可以激活线粒体ATP钾通道开放,减少钙离子通道开放,抑制线粒体Caspase-3的活化二者协同作用抑制肝细胞的凋亡[15]。
实验结果可以看出,模型组及实验各组呈现不同程度PI3K/Ark表达升高,清热利湿方治疗可以有效改善PI3K/Ark表达,抑制肝细胞炎症活动,与线粒体功能相关联。清热利湿方通过调节肝细胞线粒体功能,改善肝细胞PI3K/Ark由于脂类代谢异常形成的过氧化损伤,降低炎性介质CRP,促进肝细胞功能的恢复,具备一定的治疗效果。笔者将进一步分析清热利湿方中的有效成分,深入的研究其治疗作用机制,促进临床的应用推广。
| [1] |
SWETA M H, MICHELLE S, MILLER R O, et al. Kinetic and structural analyses reveal residues in phosphoinositide 3-kinase α that are critical for catalysis and substrate recognition[J]. The Journal of Biological Chemistry, 2017, 292(33): 13541-13550. |
| [2] |
肖阳, 侯云鹤, 尹鑫, 等. 人参皂苷Rg1干预非酒精性脂肪肝模型大鼠肝细胞的凋亡[J]. 中国组织工程研究, 2019, 23(3): 384-390. XIAO Y, HOU Y H, YIN X, et al. Ginsenoside Rg1 intervention on hepatocyte apoptosis in rats with nonalcoholic fatty liver[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(3): 384-390. |
| [3] |
中华中医药学会脾胃病分会. 非酒精性脂肪性肝病中医诊疗专家共识意见(2017)[J]. 临床肝胆病杂志, 2017, 33(12): 2270-2274. Spleen and Stomach Disease Branch of Chinese Association of Traditional Chinese Medicine. Consensus opinion on diagnosis and treatment of non-alcoholic fatty liver disease (2017)[J]. Journal of Clinical Hepatobiliary Disease, 2017, 33(12): 2270-2274. |
| [4] |
侯海青, 蔡美娟, 王文. 代谢综合征对非酒精性脂肪肝患者肝脏脂肪含量的影响及相关因素[J]. 中国老年学杂志, 2019, 39(1): 81-84. HOU H Q, CAI M J, WANG W. Effects of metabolic syndrome on liver fat content and related factors in patients with nonalcoholic fatty liver[J]. Chinese Journal of Gerontology, 2019, 39(1): 81-84. |
| [5] |
戴宁, 曾民德, 李继强, 等. 复方中药抑制非酒精性脂肪肝肝细胞色素P450ⅡE1表达的实验研究[J]. 中国中西医结合杂志, 2016, 10(6): 453-455. DAI N, ZENG M D, LI J Q, et al. Experimental study on inhibition of cytochrome P450ⅡE1 expression in nonalcoholic fatty liver by compound Chinese medicine[J]. Chinese Journal of integrated traditional and Western medicine, 2016, 10(6): 453-455. |
| [6] |
PINAR U L, NUR Z G, ABDULLA Y E. Extracellular ATP activates eNOS and increases intracellular NO generation in Red Blood Cells[J]. Clinical Hemorheology and Microcirculation, 2018, 68(1): 89-101. |
| [7] |
余佳珍, 邓琳琳. 血清转氨酶与血脂水平检验用于脂肪肝诊断的作用研究[J]. 临床检验杂志(电子版), 2019, 8(1): 15-17. YU J Z, DENG L L. Study on the role of serum transaminase and lipid level test in the diagnosis of fatty liver[J]. Journal of Clinical Examination (Electronic Edition), 2019, 8(1): 15-17. |
| [8] |
李玲, 查敏, 张兰予. 胰高血糖素样肽-1通过Foxo1/3调控肝细胞脂质代谢研究[J]. 中华内科杂志, 2019, 58(1): 39-42. LI L, CHA M, ZHANG L Y. Study on the regulation of glucagon like peptide-1 on lipid metabolism of hepatocytes by FoxO1/3[J]. Chinese Journal of Internal Medicine, 2019, 58(1): 39-42. |
| [9] |
YANG L, ZHOU Y, SONG H, et al. Jiang-Zhi granules decrease sensitivity to low-dose CCl induced liver injury in NAFLD rats through reducing endoplasmic reticulum stress[J]. BMC Complement Altern Med, 2019, 19(1): 2641-2642. |
| [10] |
JIA M Y, YAN S, MIN W, et al. Regulatory effect of a Chinese herbal medicine formula on non-alcoholic fatty liver disease[J]. World J Gastroenterol, 2019, 25(34): 5109-5119. |
| [11] |
JIAN T, YU C, DING X, et al. Hepatoprotective effect of seed coat of euryale ferox extract in non-alcoholic fatty liver disease induced by high-fat Diet in Mice by Increasing IRs-1 and Inhibiting CYP2E1[J]. J Oleo Sci, 2019, 68(6): 581-589. |
| [12] |
ZHENG Y, WANG M, ZHENG P, et al. Systems pharmacology-based exploration reveals mechanisms of anti-steatotic effects of Jiang Zhi Granule on non-alcoholic fatty liver disease[J]. Sci Rep, 2018, 8(1): 1598-018. |
| [13] |
WENG S, ZHOU J, CHEN X, et al. Prevalence and factors associated with nonalcoholic fatty pancreas disease and its severity in China[J]. Medicine (Baltimore), 2018, 97(26): 11293-11301. |
| [14] |
陈欣, 张俊富, 苏文弟, 等. 自拟中药治疗脾虚痰湿型非酒精性脂肪性肝炎的临床研究[J]. 中西医结合肝病杂志, 2018, 28(2): 82-84. CHEN X, ZHANG J F, SU W D, et al. Clinical study on the treatment of non-alcoholic fatty hepatitis of spleen deficiency and phlegm dampness type with self-designed Chinese medicine[J]. Journal of liver diseases with integrated Chinese and Western medicine, 2018, 28(2): 82-84. |
| [15] |
WANG G E, LI Y F, ZHAI Y J, et al. Theacrine protects against nonalcoholic fatty liver disease by regulating acylcarnitine metabolism[J]. Metab Clin Exp, 2018, 85(8): 227-239. |
 2020, Vol. 39
2020, Vol. 39