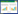文章信息
- 周雅婷, 刘颖, 毕亚男, 袁晓美, 宋蕾, 周昆
- ZHOU Yating, LIU Ying, BI Yanan, YUAN Xiaomei, SONG Lei, ZHOU Kun
- 淫羊藿水提物及提取药渣的抗骨质疏松药效比较研究
- Comparative study on anti-osteoporosis efficacy of epimedium water extract and its residue
- 天津中医药大学学报, 2020, 39(1): 87-91
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(1): 87-91
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.01.19
-
文章历史
收稿日期: 2019-07-25
2. 内蒙古农业大学, 呼和浩特 010018;
3. 天津市中药药理学重点实验室, 天津 301617
2. Inner Mongolia Agricultural University, Hohhot 010018, China;
3. Tianjin Key Laboratory of Traditional Chinese Medicine Pharmacology, Tianjin 301617, China
骨质疏松症(OP)表现为骨量减少、骨的微观结构退化,并且骨的脆性增加及易于发生骨折[1],是最常见的骨骼疾病之一。近10年来,中国患骨质疏松的中老年人数逐年增多,约占总人口数的23%,已居世界首位[2-3]。作为严重威胁中老年人健康的常见骨病,骨质疏松的防治已成为社会关注和科学研究的焦点之一。
淫羊藿性温,味甘、辛,具有祛风除湿,补肾壮阳的功效,主要治疗肾阳不足、风湿痹痛和骨痿。现代药理学研究表明,淫羊藿能够提高免疫力、增强性功能、抗肿瘤、降血糖、抗炎、治疗骨质疏松等[4]。淫羊藿总黄酮是淫羊藿属植物中的主要活性成分[5],其有效成分主要使用水提、醇提等方法提取,提取后剩余药渣部分往往被丢弃。本研究针对淫羊藿水提后剩余药渣部分的药效展开研究,并与水提物药效进行比较,考察水提后剩余的药渣对于雌性大鼠骨质疏松的疗效,为淫羊藿水提取后药渣的再利用、提高药材利用率提供一定的实验研究基础。
1 材料 1.1 实验动物SPF级雌性SD大鼠60只,体质量190~210 g,由北京华阜康生物科技有限公司提供,动物合格证号:SCXK(京)2014-0004。动物饲养于中国医学科学院放射医学研究所,饲养温度20~25 ℃,湿度40%~60%,自然光照,所用饲料为天津市华荣实验动物科技有限公司生产全价颗粒饲料,饮用自来水。
1.2 受试药物淫羊藿药材,购自河北春开制药股份有限公司,批号160501423,产地为四川,鉴定为箭叶淫羊藿。
淫羊藿水提物及药渣均由天津药物研究院许浚副研究员团队制备提供。简单来说,投料6 kg淫羊藿药材,先用11倍水煎煮1 h、再用8倍水煎煮1 h,水提物喷雾干燥获得水提物粉末800 g。水提后的剩余部分晒干,获得药渣4.8 kg,药渣经粉碎后过150目筛备用。经测定,每克水提物中含淫羊藿苷97.28 mg、宝藿苷19.46 mg;每克药渣中含淫羊藿苷7.45 mg、宝藿苷9.12 mg。
1.3 试剂和仪器骨钙素(OC)、Ⅰ型胶原N端前肽(P1NP)、Ⅰ型前胶原交联C末端肽(CTX1)ELSIA试剂盒,均为USCN产品;谷草转氨酶(AST)、谷丙转氨酶(ALT)、血清总胆固醇(TC)、甘油三酯(TG)和葡萄糖(GLU)全自动生化仪试剂盒,购自北京中生北控生物科技股份有限公司;水合氯醛,分析纯,天津市光复精细化工研究所产品;注射用青霉素纳,中诺药业(石家庄)有限公司产品;氯化钠注射液,安徽双鹤药业责任有限公司产品;甲醛溶液,分析纯,天津市风船化学试剂科技有限公司产品。
AE200S电子分析天平(上海梅特勒-托利多仪器有限公司)、Micro 17 R高速离心机(美国,Thermo)、WK-200B小型高速粉碎机(青州市富尔康制药机械有限公司)、VivaCT 40骨密度仪(瑞士,SCANCO Medical AG)、7020全自动生化仪(日本,Hitachi)、InfiniteM200多功能读板仪(瑞士,TECAN)。
2 方法 2.1 模型制备雌性SD大鼠适应性饲养30 d后,随机选取50只,腹腔注射10%水合氯醛溶液(0.6 mL/100 g)麻醉,行双侧卵巢摘除手术,术后消毒并连续2 d腹腔注射8万单位青霉素。
2.2 分组及给药造模12周后,将剩余10只未去势雌鼠作为对照组,将50只去势大鼠随机分为模型组、水提物1 g/kg组(以生药量计,下同)、水提物0.5 g/kg组、药渣1 g/kg组、药渣0.5 g/kg组,每组10只,组间大鼠体质量无统计学差异(P > 0.05)。各组大鼠按照1 mL/100 g灌胃给药,每日1次,连续灌胃8周,对照组及模型组给予相应体积的饮用水。每日观察大鼠的精神状态及采食饮水等生活状况,每周称质量并记录。
2.3 实验数据采集 2.3.1 血液样本的收集与处理最后1次给药结束后,用10%水合氯醛溶液麻醉大鼠,腹主动脉取血,3 500 r/min离心10 min,吸取血清分装于1.5 mL离心管中,使用7020全自动生化仪检测血清中AST、ALT、TC、TG和GLU含量,并用ELISA试剂盒测定OC、CTX1、P1NP含量。
2.3.2 胫骨的分离与处理分离左侧胫骨,剔净附着于胫骨上的肌肉及结缔组织,采用10%甲醛溶液固定,并置于透明离心管中备用。采用VivaCT 40对左侧胫骨进行CT扫描,然后利用软件Scanco Medical version 6.0对胫骨的总体积(TV)、骨体积(BV)、骨表面积(BS)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)和骨小梁分离度(Tb.Sp)进行分析。
2.4 统计学分析结果采用平均值±标准差(x±s)表示,组间比较采用t检验,以P<0.05为差异具有统计学意义。
3 结果 3.1 各组大鼠体质量、肝系数、肾系数和子宫系数的测定与对照组相比较,模型组大鼠的体质量、肾质量、子宫质量、肝系数、肾系数和子宫系数均有统计学差异(P < 0.05或P < 0.01)。与模型组相比,水提物0.5 g/kg组和药渣0.5 g/kg组的肝脏质量有统计学差异(P < 0.05);水提物0.5 g/kg组的肾脏质量显著降低(P < 0.05),体重、子宫质量及脏器系数虽有变化但无统计学差异(P > 0.05),见表 1。
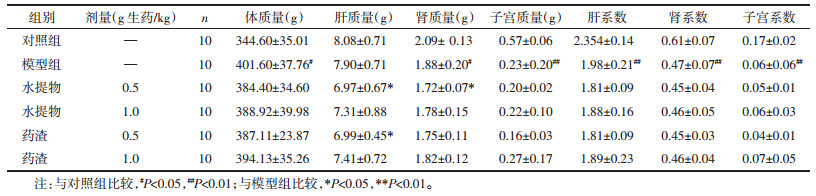
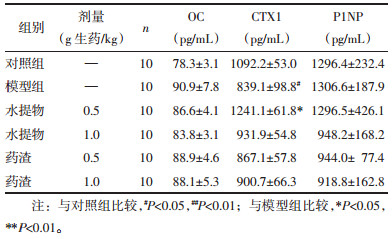
模型组大鼠的血清CTX1含量较对照组显著降低(P < 0.05),给予水提物0.5 g/kg治疗后血清CTX1显著升高(P < 0.05);模型组的OC和PINP的水平有所升高但无统计学差异(P > 0.05),淫羊藿水提物和药渣干预后可使其水平降低,见表 2。血清生化标志物检测结果显示,相比模型组,1.0 g/kg和0.5 g/kg剂量水提物及1.0 g/kg药渣组的ALT含量均明显升高(P < 0.05),0.5 g/kg药渣组的ALT含量有所升高,但无统计学差异(P > 0.05)。各给药组的TC与TG含量均比模型组升高(P < 0.05或P < 0.01),AST和GLU含量变化未见统计学差异(P > 0.05),但有升高趋势,见表 3。
图 1可见,模型组的TV、BV、BS和Tb.N较对照组显著降低(P < 0.05或P < 0.01),同时Tb.Th和Tb.Sp显著升高(P < 0.01)。给予不同剂量的水提物和药渣后,各给药组的TV、BS均比模型组显著升高(P < 0.05或P < 0.01),且BS的分析结果显示,0.5 g/kg药渣的改善效果优于0.5 g/kg水提物组(P < 0.01)。1.0 g/kg剂量水提物及1.0 g/kg和0.5 g/kg剂量药渣可明显升高Tb.N同时降低Tb.Th(P < 0.05或P < 0.01),且0.5 g/kg药渣的效果优于0.5 g/kg水提物组(P < 0.01)。此外,1.0 g/kg药渣可显著升高BV值同时降低Tb.Sp值(P < 0.05)。
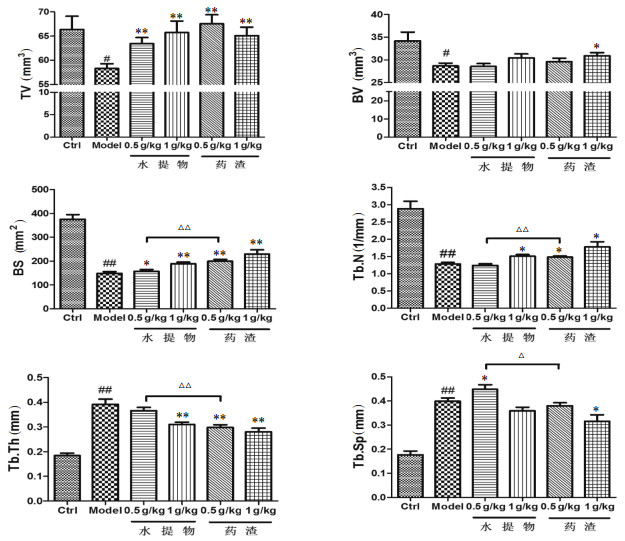
|
| 与对照组比较,#P < 0.05,##P < 0.01;与模型组比较,*P < 0.05,**P < 0.01;药渣组与水提组比较,△P < 0.05,△△P < 0.01 图 1 淫羊藿给药8周对各组大鼠胫骨骨微结构的影响 |
本研究采用的去势法是应用广泛的模拟绝经后骨质疏松骨代谢的动物模型[6],相较于对照组,造模后去势雌鼠的子宫指数有显著的下降,其原因在于去势后大鼠的雌激素水平降低导致子宫产生萎缩,该现象与文献报道相符[7],淫羊藿给药各组子宫系数并未见明显恢复,提示淫羊藿对骨质疏松的治疗作用也许并不依赖于雌激素样作用。
血清中生化指标可较为灵敏地反映骨质疏松症骨代谢情况,并先于骨密度的变化[8],本研究中与对照组相比,血清PINP和OC水平有升高趋势、但无统计学差异,而骨吸收标志物CTX1明显降低,与通常认为绝经后雌激素缺乏导致女性骨转换加速、骨吸收超过骨形成而导致骨质疏松的观点有所不同,这也可能与动物本身个体差异以及其所处骨质疏松阶段的不同有关,同时也有一些研究显示大鼠血清相关指标未见统计学差异[9-10]。但总的来说,淫羊藿水提物/药渣可使去势动物血清OC、P1NP、CTX1向对照组动物的正常水平进行调节。
骨形态计量学指标既能直观反应骨组织结构的好坏,又能客观反应骨代谢情况的变化[11],本研究主要检测胫骨的TV、BV、BS、Tb.N、Tb.Th和Tb.Sp。骨形态计量学数据显示双侧卵巢切除后12周,与对照组比较,模型组胫骨的TV、BV、BS和Tb.N均显著下降,同时Tb.Th和Tb.Sp均显著上升,证实造模成功。给药后各项指标均有所改善,表明淫羊藿水提物和药渣可明显改善骨微结构;且就BS、Tb.N、Tb.Th和Tb.Sp的改善效果来看,0.5 g/kg药渣的效果优于0.5 g/kg水提物。
鉴于近年来对中药安全性的关注,同时也因为有文献提及淫羊藿的肝毒性问题[12],本实验中进行了更多的血清生化指标检测。结果发现去势雌性大鼠连续使用淫羊藿水提物/药渣2个月后,ALT和AST均有所升高,且在1.0 g/kg和0.5 g/kg剂量水提物以及1.0 g/kg药渣干预下ALT水平变化显著,而在雄性去势动物上并未发现类似现象[13],提示长期使用淫羊藿可能对雌激素缺乏大鼠的肝功能造成影响,但ALT和AST升高幅度并不高、而肝脏系数也未见明显升高或降低,因此这种ALT水平的升高是否与淫羊藿引起肝脏损害有关,尚待进一步研究确认。
由于醇提取对各种成分的转移率明显高于水提取,本研究提示在中成药生产工艺中,可以考虑更多的采用醇提代替水提,可能更有利于发挥药效。药渣是中药及中成药经过既定提取方式提取后的剩余物,按照常规会作为废弃物进行处理。近年来,中药渣的循环再利用引起了重视,相关研究主要集中在中药渣堆肥育苗、栽培食用菌、做动物饲料、生产沼气等方面[14]。实际上,在实际提取中,由于提取工艺和有效成分转移效率的原因,药渣也可能具有药效作用。药典中淫羊藿药材推荐用量为6~10 g,折合大鼠用量约为0.54~0.90 g/kg,本研究结果证明了淫羊藿药渣1.0 g/kg和0.5 g/kg剂量对去势造成的雌性大鼠骨质疏松有一定疗效,总体治疗效果不低于水提物,且对BS、Tb.N、Tb.Th和Tb.Sp的改善效果优于同等剂量水提物组。这提示,常规水提取后的药渣有再利用价值,不应直接作为工业废弃物处理,应进一步研究其作用和再利用方式,例如,从淫羊藿药渣中提取单体活性成分等。
| [1] |
OHTA H, SOLANKI J. Incorporating bazedoxifene into the treatment paradigm for postmenopausal osteoporosis in Japan[J]. Osteoporos Int, 2015, 26(3): 849-863. DOI:10.1007/s00198-014-2940-x |
| [2] |
LIU G M, XU C J, KONG N, et al. Age-Related differences in microstructure, density and biomechanics of vertebral cancellous cone of Chinese males[J]. Aging Male, 2012, 15(4): 233-239. DOI:10.3109/13685538.2012.724739 |
| [3] |
STERLING R S. Gender and Race/Ethnicity differences in hip fracture incidence, morbidity, mortality, and function[J]. Clin Orthop Relat Res, 2011, 469(7): 1913-1918. DOI:10.1007/s11999-010-1736-3 |
| [4] |
房凌云. 淫羊藿的药理作用及临床应用进展[J]. 智慧健康, 2017, 3(21): 25-27. FANG L Y. Pharmacological action and clinical application progress of Epimedium[J]. Smart Healthcare, 2017, 3(21): 25-27. DOI:10.3969/j.issn.2096-1219.2017.21.011 |
| [5] |
袁航, 曹树萍, 陈抒云, 等. 淫羊藿的化学成分及质量控制研究进展[J]. 中草药, 2014, 45(24): 3630-3640. YUAN H, CAO S, CHEN S Y, et al. Progress in chemical composition and quality control of epimedium[J]. Chinese Herbal Medicines, 2014, 45(24): 3630-3640. DOI:10.7501/j.issn.0253-2670.2014.24.024 |
| [6] |
SAVILLE P D. Changes in Skeletal mass and fragility with castration in the rat; A model of osteoporosis[J]. J Am Geriatr Soc, 1969, 17(2): 155-166. DOI:10.1111/j.1532-5415.1969.tb03169.x |
| [7] |
NAKAMUTA H. The ovariectomized animal model of postmenopausal bone loss][J]. Nihon Rinsho, 2004, 62(Suppl 2): 759-763. |
| [8] |
崔轶, 李军, 郭海, 等. 骨质疏松模型的评价方法研究进展[J]. 中国骨质疏松杂志, 2013, 19(4): 416-420. CUI Y, LI J, GUO H, et al. Research progress on evaluation methods of osteoporosis model[J]. Chinese Journal of Osteoporosis, 2013, 19(4): 416-420. DOI:10.3969/j.issn.1006-7108.2013.04.024 |
| [9] |
郁桦, 常萍, 陈蓓旖, 等. 大豆异黄酮和牛初乳复合制剂对去卵巢大鼠骨质疏松症的改善和抗氧化作用[J]. 食品工业科技, 1-10. YU H, CHANG P, CHEN P Y, et al. The improvement and antioxidant effect of soybean isoflavone and bovine colostrum on osteoporosis in ovariectomized rats[J]. Science and Technology of Food Industry, 1-10. |
| [10] |
常波伦, 柴仪, 李倩, 等. 生骨密骨方对骨质疏松大鼠血清骨密度及血清标志物的影响[J]. 河北中医药学报, 2018, 33(2): 1-3. CHANG B L, CHAI Y, LI Q, et al. Effect of shenggumigu Recipe on serum bone density and serum markers in osteoporosis rats[J]. Journal of Hebei Traditional Chinese Medicine and Pharmacology, 2018, 33(2): 1-3. |
| [11] |
邢磊, 焦颖华, 耿丽华, 等. 仙灵骨葆治疗骨质疏松大鼠:血清学及骨组织形态计量学评价[J]. 中国组织工程研究与临床康复, 2011, 15(15): 2786-2789. XING L, JIAO Y H, GENG L H, et al. Xianlinggubao in the treatment of osteoporosis in rats:serological and histomorphometric evaluation[J]. Chinese Journal of Tissue Engineering Research, 2011, 15(15): 2786-2789. DOI:10.3969/j.issn.1673-8225.2011.15.030 |
| [12] |
张林, 张晶璇, 范琼尹, 等. 均匀设计结合多元回归分析用于淫羊藿对大鼠肝毒性的影响[J]. 中国实验方剂学杂志, 2018, 24(6): 189-197. ZHANG L, ZHANG J X, FAN Q Y, et al. Effects of Epimedium on liver toxicity in rats by uniform design combined with multiple regression analysis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(6): 189-197. |
| [13] |
刘颖, 毕亚男, 许浚, 等. 淫羊藿药渣对去势雄性大鼠的壮骨作用[J]. 药物评价研究, 2017, 40(12): 1682-1687. LIU Y, BI Y N, XU J, et al. Bone strengthening effect of Herba Epimedii dregs on castrated male rats[J]. Drug Evaluation Research, 2017, 40(12): 1682-1687. |
| [14] |
杨冰, 丁斐, 李伟东, 等. 中药渣综合利用研究进展及生态化综合利用模式[J]. 中草药, 2017, 48(2): 377-383. YANG B, DING F, LI W D, et al. Research progress of comprehensive utilization of traditional Chinese medicine residue and ecological comprehensive utilization mode[J]. Chinese Herbal Medicines, 2017, 48(2): 377-383. |
 2020, Vol. 39
2020, Vol. 39