文章信息
- 王志强, 许娟, 赵志红, 曹丽娟, 李希凡, 李天祥
- WANG Zhiqiang, XU Juan, ZHAO Zhihong, CAO Lijuan, LI Xifan, LI Tianxiang
- 不同产地丹参药效组分变化规律研究
- Study on the change regularity of the effective components of Salvia miltiorrhiza in different habitats
- 天津中医药大学学报, 2020, 39(1): 92-97
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(1): 92-97
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.01.20
-
文章历史
收稿日期: 2019-10-17
2. 天津市南开医院药学部, 天津 300100;
3. 天津盛实百草药业有限公司, 天津 300301
2. Department of Pharmacy, Tianjin Nankai Hospital, Tianjin 300100, China;
3. China Medico Corporation, Tianjin 300301, China
丹参为唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根和根茎,始载于《神农本草经》并列为上品,拥有两千多年应用历史,为常用的大宗药材[1]。本品性微寒,味苦;归心、肝经,具有活血祛瘀、通经止痛、清心除烦、凉血消痈的功效[2]。临床研究表明,丹参除在治疗心脑血管疾病方面发挥重要作用外,还具有降血压、降血脂、抗氧化、改善记忆力、抗肿瘤、抗炎、保肝、扩冠等药理活性[3-5]。
目前,丹参野生资源锐减,无法满足市场,市场供应以栽培品为主。中国四川、陕西、山东、河南、河北、山西等地广泛引种栽培[6]。当前市场上不同产地的栽培品丹参广泛流通,质量参差不齐。现行2015版《中华人民共和国药典》丹参项下的质控指标仅有丹参酮ⅡA类(丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ)和丹酚酸B,但现代药理学研究表明丹参主要功效成分除了丹参酮ⅡA类和丹酚酸B外,丹酚酸A、丹参素、原儿茶醛、丹参酮ⅡB、异隐丹参酮等丹参酚酸类和丹参酮类成分[7-8]也作用明确。
为全面考察、分析不同产地丹参药材的整体质量,查阅相关文献[9-10],总丹参酮和总丹酚酸为丹参活血祛瘀、凉血消痈、清心除烦的主要物质基础,丹参酮ⅡA类和丹酚酸B是丹参通经止痛的功效成分,其中总丹参酮表现出抗炎、抗肿瘤的生物活性,总丹酚酸具有抗心肌损伤的功效,丹参酮ⅡA类可以扩张冠动脉,丹酚酸B抗动脉粥样硬化,总浸出物为丹参发挥整体药效的总物质基础。因此,本研究以总丹酚酸、总丹参酮、丹酚酸B、丹参酮ⅡA类等4类药效组分作为丹参品质评价的指标成分,总浸出物作为丹参质量考察的整体成分,对收集的不同产地丹参样品进行系统考察,以期阐明不同产地间丹参药效组分的变化规律。
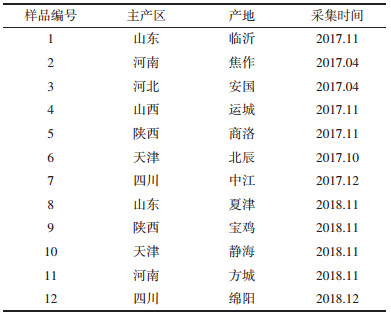
1 实验材料 1.1 样品来源7产区12个产地的丹参样品(见表 1),经天津中医药大学李天祥教授鉴定为唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根及根茎。除去样品的泥沙与杂质,待样品干燥后粉碎过3号筛,备用。
高效液相色谱仪(配置B05型高压梯度泵、UV 1000型全波段可编程紫外可见检测器、CSChrom Plus色谱工作站、美国Alltech科技有限公司),UV-6100型紫外可见分光光度计(上海美普达有限公司),远红外快速干燥箱(上海贺德实验设备有限公司),二列四孔智能水浴锅(河南省巩义市仪器有限责任公司),调温电热套(山东省鄄城永兴仪器厂),SB25-12DT超声波清洗机(宁波新芝生物科技股份有限公司),FA 2104电子天平(200 g,上海舜宇恒平科技仪器有限公司)。
1.3 试剂硝酸铝(分析纯,天津市大茂化学试剂厂),氢氧化钠(分析纯,天津市江天化工技术有限公司),亚硝酸钠(分析纯,天津市江天化工技术有限公司)。丹参酮ⅡA对照品(北京鼎国昌盛技术有限公司,MUST-1103301),丹酚酸B对照品(北京鼎国昌盛技术有限公司,MUST-15081916)。甲酸(色谱纯,天津市光复精细化工研究所),磷酸(色谱纯,天津市光复精细化工研究所),甲醇(色谱纯,天津市康科德科技有限公司),甲醇(分析纯,天津市江天化工技术有限公司),95%乙醇(分析纯,天津市江天化工技术有限公司),无水乙醇(分析纯,天津市富宇精细化工有限公司),乙腈(色谱纯,天津市康科德科技有限公司),娃哈哈纯净水(天津娃哈哈食品有限公司)。
2 实验方法 2.1 供试品溶液的制备 2.1.1 总丹参酮精密称定0.5 g丹参粉末于100 mL锥形瓶中,加入40 mL甲醇后称定质量,用70 ℃水浴回流1 h,取下擦干瓶壁水分放冷后补足减失质量,摇匀,滤过,精密量取0.2 mL续滤液于10 mL容量瓶中用甲醇定容至刻度,即得供试品溶液,然后于268 nm处测吸光度。
2.1.2 总丹酚酸精密称定丹参粉末0.2 g于100 mL锥形瓶中,加入80%甲醇溶液40 mL,于80 ℃水浴回流1 h,趁热过滤,滤液放冷后转移至50 mL容量瓶中,用80%甲醇溶液定容至刻度,摇匀后取0.3 mL于10 mL棕色容量瓶中,依次加入5%亚硝酸钠溶液0.5 mL,振荡摇匀,然后加入10%硝酸铝溶液0.5 mL,振荡摇匀,反应5 min中后用1 mol/L氢氧化钠溶液定容至刻度,摇匀后于496 nm处测吸光度。
2.1.3 丹参酮ⅡA类(丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ)取丹参样品粉末约0.3 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定质量,超声处理(功率140 W,频率42 kHz)30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.1.4 丹酚酸B取丹参样品粉末0.15 g,精密称定,置具塞锥形瓶中,精密加入80%甲醇溶液50 mL,密塞,称定质量,超声处理(功率140 W,频率42 kHz)30 min,放冷,再称定质量,用80%甲醇溶液补足减失的质量,摇匀,滤过,精密量取续滤液1 mL,移至10 mL容量瓶中,加80%甲醇溶液定容至刻度,摇匀,滤过,取续滤液,即得。
2.1.5 总浸出物精密称定丹参样品粉末2 g,置100 mL锥形瓶中,精密加稀乙醇(50%)50 mL,密塞,称定质量,静置1 h后,连接回流冷凝管,加热至沸腾,并保持微沸1 h。放冷后,取下锥形瓶,密塞,擦干锥形瓶表面水分,再称定质量,用稀乙醇补足减失的质量,摇匀,用干燥滤器滤过,精密量取滤液25 mL,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105 ℃干燥3 h,然后置干燥器中冷却30 min,迅速精密称定质量。以干燥品计算供试品中浸出物的含量(%)。
2.2 标准对照品溶液制备 2.2.1 总丹参酮取丹参酮ⅡA对照品适量,精密称定,置棕色容量瓶中,加甲醇制成0.1 mg/mL的溶液,即得。
2.2.2 总丹酚酸取丹酚酸B对照品适量,精密称定,置棕色容量瓶中,加80%甲醇溶液制成0.32 mg/mL的溶液,即得。
2.2.3 丹参酮ⅡA类取丹参酮ⅡA对照品适量,精密称定,置棕色容量瓶中,加甲醇制成0.1 mg/mL的溶液,即得。
2.2.4 丹酚酸B取丹酚酸B对照品适量,精密称定,加80%甲醇溶液制成0.28 mg/mL的溶液,即得。
2.3 色谱条件 2.3.1 丹参酮ⅡA类色谱条件色谱柱Agilent ZORBAX Eclipse Plus C18柱(4.6 mm×250 mm,5 μm);柱温25 ℃;进样量10 μL;流动相:乙腈(A)-0.02%磷酸溶液(B);流速1.0 mL/min;梯度洗脱0~6 min、61% A;6~20 min、61%~90% A;20~20.5 min、90%~61% A;20.5~25min、61% A;检测波长270 nm。
2.3.2 丹酚酸B色谱条件色谱柱Agilent ZORBAX Eclipse Plus C18柱(4.6 mm×250 mm,5 μm);柱温25 ℃;进样量10 μL;流动相:乙腈(A)-0.1%磷酸溶液(B)(22:78);检测波长286 nm;流速1.2 mL/min。
2.4 方法学考察 2.4.1 线性关系考察分别精密量取“2.2”项下总丹参酮、总丹酚酸、丹参酮ⅡA类、丹酚酸B对应对照品溶液适量制备系列梯度对照品溶液,然后分别用紫外分光光度计测吸光度,液相色谱仪测峰面积,以吸光度或峰面积为纵坐标,对照品浓度为横坐标,拟合标准曲线,结果见表 2。
分别精密量取各对照品溶液适量按照上述各自对应供试品的测定条件连续测定6次,计算得总丹参酮、总丹酚酸的吸光度RSD分别为0.13%、0.17%,丹参酮ⅡA类、丹酚酸B的峰面积RSD分别为0.83%、0.65%,表明仪器精密度良好。
2.4.3 重复性实验依据上述供试品制备方法制备四种药效组分各自对应的供试品溶液各6份,按照对应的测定方法分别进行测定,结果总丹参酮、总丹酚酸吸光度RSD分别为2.45%、0.52%,丹参酮ⅡA类、丹酚酸B峰面积RSD分别为1.04%、0.52%,表明各方法重复性良好。
2.4.4 稳定性实验分别取总丹参酮和总丹酚酸的供试品溶液适量,每间隔10 min测1次吸光度,连续测定1 h,计算得1 h内总丹参酮和总丹酚酸吸光度RSD分别为1.92%、0.93%,表明总丹参酮和总丹酚酸供试品溶液在1 h内基本稳定。分别取丹参酮ⅡA、丹酚酸B供试品溶液适量,注入液相色谱仪,分别在2、4、6、8、10、12 h测定峰面积,结果丹参酮ⅡA、丹酚酸B峰面积RSD分别为1.49%、2.62%,表明丹参酮ⅡA类、丹酚酸B供试品溶液在12 h内基本稳定。
2.4.5 回收率实验分别精密称定丹参样品各6份,加入各方法相对应的对照品适量,按“2.1”项下各方法制备对应供试品溶液,然后进行含量测定,计算得总丹参酮、总丹酚酸、丹参酮ⅡA类、丹酚酸B加样回收率分别为97.83%、100.1%、94.38%、100.9%,RSD分别为2.10%、1.84%、1.91%、2.86%,表明各方法可行。
2.5 丹参酮ⅡA、丹酚酸B对照品和供试品色谱图丹含酮ⅡA、丹酚酸B对照品和供试品色谱图见图 1。

|
| 1-丹参酮ⅡA;2-丹酚酸B 图 1 丹参对照品(A、B)和样品(C、D)HPLC色谱图 |
取丹参样品按“2.1”项下供试品制备及测量方法,重复3次,结果取算术平均值,用Excel和SPSS软件统计分析。
3 实验结果及分析由表 3数据可知,不同产地丹参各药效组分含量有较大差异。基于7个产区12个产地药材各药效组分的平均含量,山东临沂丹参总丹参酮含量最高,除与陕西商洛、四川中江、天津北辰样品无显著性差异外,与其他产地样品相比有显著性差异。河南方城丹参中丹参酮ⅡA类、四川中江丹参总丹酚酸和丹酚酸B含量最高,与其他产地丹参样品相比均有显著性差异,且这3个产地丹参的药典指标成分含量均高于规定标准。其次,山东夏津,陕西宝鸡、商洛,天津北辰、静海所产丹参丹参酮ⅡA类、丹酚酸B含量也均符合药典标准,质量相对较优。基于上述,市场上认为山东临沂、四川中江、河南方城所产丹参质量较优具有一定合理性。
基于药典指标成分丹参酮ⅡA类(不低于0.25%)和丹酚酸B(不低于3.0%)的含量,焦作、安国、运城3个产地丹参中丹参酮ⅡA类含量低于药典限量水平。绵阳1个产地丹参中丹参酮ⅡA类和丹酚酸B含量均不合格。不合格品占所收集样品的1/3,其中丹参酮ⅡA类含量不达标为药材不合格的主要原因。各产地样品丹参酮ⅡA类的含量在0.037%-0.65%之间,最高者是最低者17倍以上,波动较大。丹酚酸B含量在2.99%~8.95%之间,最高者约是最低者3倍。说明当前市场上丹参质量参差不齐,并存在一定量的不合格药材。
基于总丹参酮含量,各样品在0.92%~2.20%之间波动,最高者是最低者2倍以上,各产地间差异相对较小。基于总丹酚酸含量,各样品在3.90%~9.57%之间波动,各产地间波动明显。从总浸出物含量来看,山西运城最高,为68.32%,陕西商洛最低,为54.39%,其含量差异达13.91%,各产地间丹参代谢物质积累量存在一定差异。说明产地不同,丹参功效物质含量不同。
4 结论不同产地丹参药效组分含量存在较大差异,其中指标成分丹参酮ⅡA类含量波动尤为明显,是导致丹参质量不合格的主要原因。河北、河南、山西、四川的部分产地有不合格品存在,均为指标成分丹参酮ⅡA类含量低于药典标准。河南方城、山东临沂、陕西商洛、四川中江作为丹参的道地产区,所产丹参质量相对较优。丹参生态适应性很强,可广泛引种,由于不同产地的大气环境、土壤因子、水热条件等存在差异,研究发现,非道地产区引种栽培后的质量存在不合格问题,因此,丹参非道地产区引种的合理性应值得高度关注。
5 讨论 5.1 优质丹参产区确立依据及丹参药效组分特点历代本草中记载的丹参产地有“桐柏山川谷及泰山、河东州郡及随州”,对相关地名进行考证即为当今的河南方城、山东临沂、陕西商洛、湖北随县等地,可认为这些地区是丹参古时的优质产区,以野生资源为主。现今丹参野生资源急剧减少,供应以栽培为主,山东、山西、陕西、四川、河南、河北等地均规模种植,全国销售。其中,山东临沂、陕西商洛、河南方城从古至今一直是丹参的主要分布区,被认为是优质丹参产区。四川中江丹参引种历史最长,现今也作为优质丹参产区之一。实验结果表明,山东临沂、陕西商洛、四川中江、河南方城丹参作为当今比较公认的优质丹参资源,表现为其总浸出物含量均超过50%,其总丹参酮含量远高于其他产地丹参,丹参酮ⅡA类、总丹酚酸和丹酚酸B均处于较高水平。
5.2 产地生态因素对药材外观品相和丹参药效组分变化有一定影响不同产地丹参药效组分的变化特点体现了中药内在品质形成与产地生态因素的相关性。山西运城丹参总浸出物含量较高,但各药效组分含量较低,可能是样品受当地冬季寒冷少雪,春季气温多变、干燥,夏季高温高湿,秋季多阴雨的气候条件影响。河北安国、河南焦作两产地样品丹酚酸类成分含量较高,但丹参酮ⅡA类成分含量低于药典标准,与两地样品均为春季采收可能不是丹参的最佳采收期有关。四川绵阳所产丹参质量不符合药典标准,可能是样品产地受北亚热带山地湿润季风气候影响(温湿适宜、降雨充沛)。此外,绵阳样品与中江样品外观形态明显不同,推测与栽培管理及引种品种相关。
结合药材外观性状来看,丹参药效组分含量可能与丹参药材外观性状有一定关联性,具体表现为:1)丹参根条越少或主根越粗(河南焦作、河北安国、四川中江、山西运城丹参样品)丹参酚酸类成分含量较高;丹参根条越多或主根越细(山东临沂、陕西商洛、山东夏津、河南方城、陕西宝鸡、天津静海、天津北辰丹参样品)丹参酮ⅡA类成分含量较高;2)丹参根条表面越红(山东临沂、陕西商洛、河南方城丹参)丹参酮ⅡA类成分含量较高。丹参根部从上至下水溶性成分含量呈降低趋势,脂溶性成分含量呈升高趋势,水溶性成分上部含量较高,脂溶性成分下部含量较高。丹参根部越红其药效组分含量越高,颜色变化对丹参脂溶性成分含量变化的影响远大于水溶性成分。分析其原因,丹参酚酸类和丹参酮类可能是丹参生长受到胁迫后而产生的次生代谢产物,其对丹参维持细胞稳态、对抗环境变化具有重要意义。丹参酚酸类作为水溶性成分在导管中转运,所以木质部中含量较高,而丹参酮类作为脂溶性成分,在韧皮部中输送较多,并向表皮细胞转移,增加细胞质的浓度来对抗干旱、盐胁迫等造成的水分散失,结果皮部含量较高。对于粗壮、分支少的丹参其木质部占比较大,丹参酚酸类成分含量较高,而分支多的丹参其根条相对较细,皮部占比大,导致丹参酮类成分含量较高。
5.3 丹参异地引种栽培具可行性,但品质形成机制有待进一步研究除山东临沂、陕西商洛、四川中江、河南方城丹参各药效组分累积量较高外,陕西宝鸡、山东夏津、天津北辰及静海丹参也具有了优质丹参的一些特点,其丹参酮ⅡA类、丹酚酸B含量均高于药典标准,说明丹参异地栽培具有可行性。丹参品质形成除了与产地气候环境相关,种源、栽培管理、初加工也是重要影响因素,关于丹参内在品质形成机制还有待深入研究。
丹参在中国分布较广,引种地区较多,本研究收集样品因产地及批次有限,考察结果存在一定的局限性,有待今后进一步补充、完善。
| [1] |
宋振巧, 王建华, 陈为序, 等. EST-SSR分析不同产地丹参的遗传多样性[J]. 核农学报, 2014, 28(2): 193-199. SONG Z Q, WANG J H, CHEN W X, et al. Genetic diversity analysis of Salvia Miltiorrhiza Bge from different habitats by EST-SSR markers[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(2): 193-199. |
| [2] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社, 2015. National Commission of Chinese Pharmacopoeia. Pharmacopoeia of the people's Republic of China[S]. Beijing: Chinese Medical Science and Technology Press, 2015. |
| [3] |
李巧玉, 刘杨, 包华音. 近5年丹参化学成分及药理作用研究进展[J]. 食品与药品, 2014, 16(2): 145-146. LI Q Y, LIU Y, BAO H Y. Progress on pharmaceutical effects and chemical constituents of Salvia Miltiorrhiza in recent five years[J]. Food and Drug, 2014, 16(2): 145-146. |
| [4] |
高丽娜, 崔元璐, 延阔, 等. 丹参红花配伍研究进展[J]. 中草药, 2016, 47(4): 9. GAO L N, CUI Y L, YAN K, et al. Advances in studies on compatibility of Salviae Miltiorrhizae Radix et Rhizoma and Carthamii Flos[J]. Chinese Traditional and Herbal Drugs, 2016, 47(4): 9. |
| [5] |
赵志芳. 丹参对心血管疾病治疗的研究进展[J]. 海峡药学, 2016, 28(5): 4. ZHAO Z F. Research progress of Salvia miltiorrhiza in the treatment of cardiovascular diseases[J]. Strait Pharmaceutical Journal, 2016, 28(5): 4. DOI:10.3969/j.issn.1006-3765.2016.05.002 |
| [6] |
李天祥, 常广璐, 李国辉, 等. 丹参培育中的关键问题和对策[J]. 时珍国医国药, 2015, 26(12): 3008-3010. LI T X, CHANG G L, LI G H, et al. Key problems and Countermeasures in the cultivation of Salvia miltiorrhiza[J]. Lishizhen Medicine and Materia Medica Research, 2015, 26(12): 3008-3010. |
| [7] |
王艳梅, 曹俊岭. 丹参中酚酸类化合物的化学和药理研究进展[J]. 世界中医药, 2016, 11(6): 1126-1130. WANG Y M, CAO J L. Chemical and Pharmacological Studies of Phenolic Acids in Salvia Root[J]. World Journal of Traditional Chinese Medicine, 2016, 11(6): 1126-1130. DOI:10.3969/j.issn.1673-7202.2016.06.051 |
| [8] |
袁媛, 吴芹, 石京山, 等. 丹参及其主要成分保肝作用的研究进展[J]. 中国中药杂志, 2015, 40(4): 588-593. YUAN Y, WU Q, SHI J S, et al. Advance in studies on hepatoprotective effect of Salvia miltiorrhiza and its main components[J]. China Journal of Chinese Materia Medica, 2015, 40(4): 588-593. |
| [9] |
张乙川. 对丹参化学成分及临床药理的研究进展[J]. 中国医药指南, 2015, 13(11): 214-215. ZHANG Y C. Research progress on chemical constituents and clinical pharmacology of Salvia miltiorrhiza[J]. Guide of China Medicine, 2015, 13(11): 214-215. |
| [10] |
王冰瑶, 吴晓燕, 樊官伟. 丹参素保护心血管系统的药理作用机制研究进展[J]. 中草药, 2014, 45(17): 2571-2575. WANG B Y, WU X Y, FAN G W. Pharmacologic mechanism for protective effects of danshensu on cardiovascular system[J]. Chinese Traditional and Herbal Drugs, 2014, 45(17): 2571-2575. DOI:10.7501/j.issn.0253-2670.2014.17.027 |
 2020, Vol. 39
2020, Vol. 39