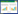文章信息
- 吕任尧, 郑曙琴
- LYU Renyao, ZHENG Shuqin
- 基于数据挖掘和网络药理学的肥胖用药规律及潜在作用分析
- A study of the medication rule for obesity and its potential role based on data mining and network pharmacology
- 天津中医药大学学报, 2020, 39(1): 103-110
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(1): 103-110
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.01.22
2. 辽宁中医药大学附属医院, 沈阳 110032
2. Liaoning Hospital of Traditional Chinese Medicine, Shenyang 110032, China
肥胖指体内脂肪过多积累和(或)分布异常,常伴体质量增加,是由多种因素互相作用所引起的慢性代谢性疾病[1]。中医学中,本病最早记载于《黄帝内经》,属中医“肥满”“膏人”“脂人”“肥人”等范畴,常伴有头晕乏力、神疲懒言、少动气短等症状。研究显示[2],在过去30 a中,全球肥胖率急剧增加,成年肥胖患者约有5亿之多,全世界儿童和青少年患病率也在逐渐增加。此外长期肥胖还可增加中风、高血压、肝胆疾病、2型糖尿病、冠心病、脑血管病、及某些肿瘤等相关疾病的风险,严重影响人类的生活质量与身体健康[3]。因此,对于肥胖的研究与治疗具有非常重要的临床意义。然而目前肥胖的西医治疗仍充满波折,如肥胖药物治疗的最紧迫的未解答的问题是它们在长期内的表现如何,加之西医减肥药物缺乏大众的广泛接受,人们对于西医减肥药物安全性的担忧仍普遍存在[4]。相比于西药治疗肥胖的种种困难,中医在整体观念的指导下,运用阴阳、五行、脏象、经络等学说对肥胖患者进行辨证论治的个体化治疗,为临床治疗肥胖做出了重要的贡献。今为求更加系统,更加直接的总结中医药对于肥胖治疗的用药规律以及高频的药物作用机制,本文通过数据挖掘的方式对中药治疗肥胖用药规律进行总结,并对高频药物进行进行KEGG通路分析,通过网络分析筛选出关键靶点,探索其发挥药效的可能机制,为临床中药治疗肥胖提供依据。
1 资料与方法 1.1 数据来源及检索方式以计算机与人工相结合的方式进行检索,应用计算机以“中医药”或“中药”或“中医”与“肥胖”“肥满”“脂人”“肥人”“膏人”“单纯性肥胖”“肥胖症”等关键词与自由词相组合检索中国知识资源总库(CNKI)、万方数据资源系统、中国生物医学文献数据库(CBMdisc)、中文科技期刊全文数据库(VIP)关于中医药治疗肥胖的相关文献,检索时间:1999年1月—2018年12月。将检索到的文献逐篇下载,以人工筛查的方式收录其中符合本文排除与纳入标准的期刊文献共143篇及其中符合排除与纳入标准的中药组方148首。
1.2 纳入标准1)文献第一诊断均为单纯性肥胖。2)文献中所使用的中药组方具有明确的药物组成。3)文献中认定此组方服之结局良好。4)收录组方均为中医内服汤药。5)多篇文献中同一组方只纳入1篇,药物组成仅选取主方(基本方)。
1.3 排除标准1)非单纯中药治疗文献。2)动物实验、文献综述、文献评价、Meta分析等非临床试验。3)同一数据在不同期刊中重复报道的文献。4)治疗结局不明确文献。5)组方药物不完整文献。
1.4 数据标准化与录入 1.4.1 数据标准化参照人民卫生出版社第3版《中药学》及2015版《中华人民共和国药典》对组方中的中药名称进行规范,如“仙灵脾”统一规范为“淫羊藿”;“生地黄”统一规范为“地黄”。
1.4.2 数据录入根据纳入与排除标准对收录文献进行严格筛选,提取符合标准中药组方的药物信息,录入Microsoft Excel 2016软件,以无序分类变量二项分类的方式,双人录入,横坐标为药物名称,纵坐标为组方ID,将单个组方中出现的药物在相应单元格记为“1”,否则记为“0”,建立“中药治疗肥胖数据库”。
1.5 统计方法利用Excel 2016对整理的方剂进行数据录入。关联规则分析采用Apriori算法,最低支持度设为0.1,最低置信度设为0.8,分别取支持度、置信度、提升度排序前6的规则进行整理。聚类分析采用K-means和层次聚类的方法,其中聚类数目通过Gap统计量确定,距离度量采用欧式距离。主成分分析通过变量的协方差矩阵找出方差最大化的新线性组合,作为原始变量的主成分以最大限度解释原始变量,分别取贡献度最大的前20个主成分作为用药的主要规律进行分析。本研究所有数据挖掘分析基于R3.5.2。
1.6 网络药理学分析使用BATMAN-TCM系统预测高频药物所含化学成分,并获取对应靶点;把这些靶点与Genecard数据库中检索到的肥胖相关靶点相映射并取交集,将其作为治疗肥胖的潜在作用靶点;将上述靶点导入STRING 11.0数据库中,构建PPI网络,对其进行网络拓扑分析,筛选出高频药物治疗肥胖病的核心靶点,并上传至DAVID 6.8数据库进行KEGG通路分析,通过数据库检索、文献验证,获取高频药物治疗肥胖病的重要通路。
2 结果 2.1 中药频次统计在录入的148个中药组方中,共涉及中药172味。结果显示,使用频率≥10%的药物共21种,依次为茯苓(56.75%),泽泻(50%),白术(43.93%),山楂(39.86%),半夏(27.03%),大黄(27.03%),决明子(26.35%),甘草(25.68%),荷叶(25%),陈皮(24.32%),苍术(23.65%),黄芪(21.62%),枳实(16.89%),丹参(16.89%),厚朴(14.86%),薏苡仁(13.51%),山药(12.84%),柴胡(12.16%),党参(11.49%),桂枝(10.81%),防己(10.81%)。见图 1。
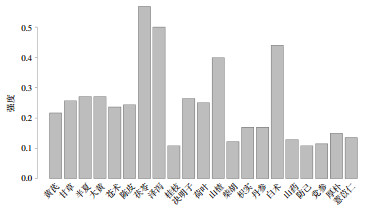
|
| 图 1 中药治疗肥胖主要药物统计 |
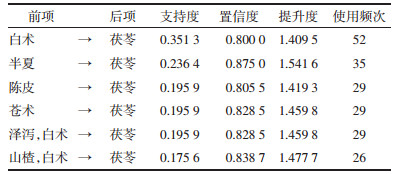
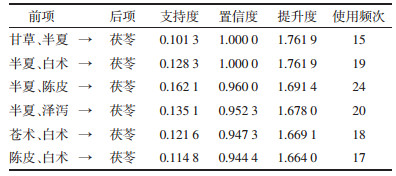
关联规则结果显示,以支持度由高到低排序的药对依次为白术与茯苓,半夏与茯苓,陈皮与茯苓,苍术与茯苓,泽泻、白术与茯苓,山楂、白术与茯苓,见表 1。以置信度由高到低排序的药对依次为甘草、半夏与茯苓,半夏、白术与茯苓,半夏、陈皮与茯苓,半夏、泽泻与茯苓,苍术、白术与茯苓,陈皮、白术与茯苓,见表 2。以提升度由高到低序的药对依次为陈皮、茯苓与半夏,泽泻、丹参与山楂,丹参与山楂,茯苓、泽泻、丹参与白术,甘草、半夏与茯苓,半夏、白术与茯苓,见表 3。关联规则分析网络化展示见图 2。
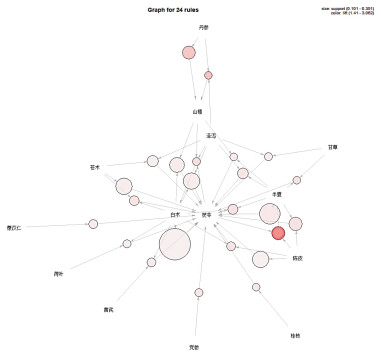
|
| 图 2 中药治疗肥胖关联规则分析网络化展示 |
采用K-means和层次聚类的方法,其中聚类数目通过Gap统计量确定,距离度量采用欧式距离。对所有药物进行聚类分析,两种聚类方法得出结果几乎一致,结果见图 3。其中以层次聚类的方法对药物进行聚类,形成2个聚类药物群:第1组包含的药物有:泽泻、茯苓、白术、山楂、荷叶、丹参、半夏、陈皮、苍术、厚朴、薏苡仁、黄芪、甘草。第2组药物较为繁杂,其又分为两组,其中有代表性的一组主要包含的药物有:大黄、枳实、柴胡、白芍、生姜、大枣、黄芩、黄连。
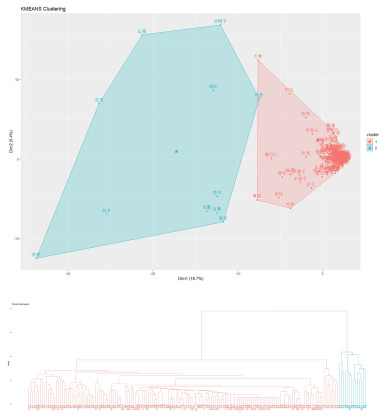
|
| 图 3 中药治疗肥胖聚类分析结果展示图 |
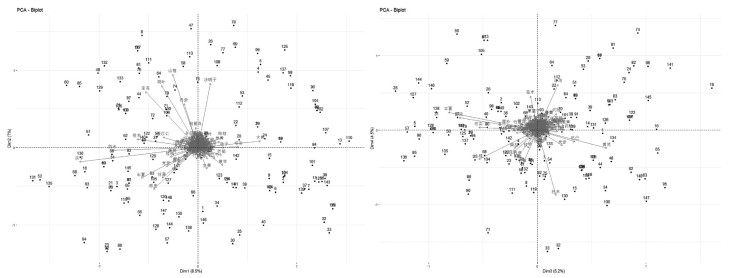
前4个维度主成分贡献图如图 4,分别取主成分中高于评价贡献的中药变量作为此维度的代表用药,其中维度1方差贡献率为8.5%,主要包含的药物有:茯苓、白术、大黄、苍术、半夏、泽泻、等维度2方差贡献率为7%,主要包含的药物有:山楂、决明子、荷叶、泽泻、丹参等,维度3方差贡献率为5.2%,主要包含的药物有:半夏、陈皮、黄芪、山楂、枳实、防己、厚朴等,维度4方差贡献率为4.5%,主要包含的药物有:白术、泽泻、甘草、苍术、山楂、丹参、决明子等。前4个维度中药和方剂间关系的双标图见图 5。
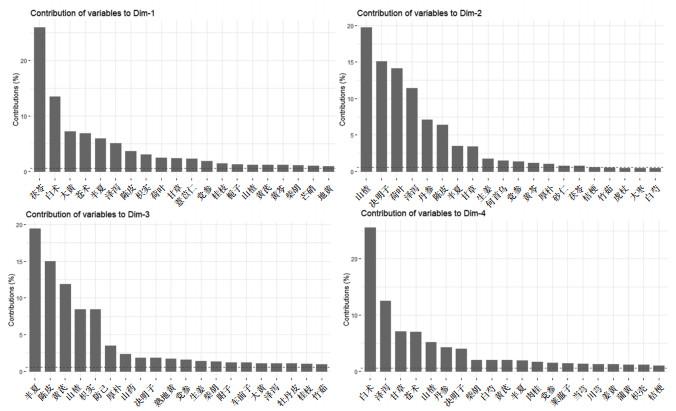
|
| Dim-1:维度1;Dim-2:维度2;Dim-3:维度3;Dim-4:维度4 图 4 中药治疗肥胖主成分分析前4个维度主成分贡献图 |
|
| 空间上相聚越近的变量,正相关程度越高;距离原点越远说明该变量越重要 图 5 中药治疗肥胖主成分分析前4个维度中药和方剂间关系的双标图 |
在BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/)中以“Fu Ling”为关键词,“Score cutoff”设置为30,“Adjusted P-value”设置为0.05,检索出茯苓中所含化合物17种,包括Choline、Dehydroeburicoicacid、Ergosterol、Pachymic Acid、Beta-Amyrin Acetate、P-Hydroxybenzyl Alcohol等,同时获取这些化合物对应靶点230个。
2.5.2 肥胖相关靶点检索以“obesity”为关键词,在Genecard数据库(http://www.genecards.org/)中检索obesity相关靶点,与BATMAN-TCM数据库预测靶点相映射并取交集,共获得茯苓治疗治疗肥胖病的靶点90个。
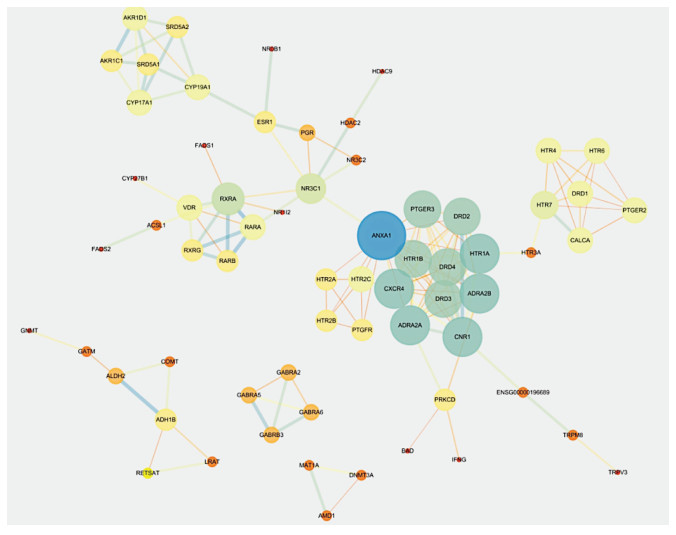
2.5.3 蛋白质-蛋白质相互作用(PPI)网络构建将上述获得的90个潜在作用靶点导入STRING 11.0数据库(https://string-db.org/),限定物种为人,设定最高置信度0.9,获得蛋白质与蛋白质相互作用关系,结果存储为TSV格式,保留文件中node 1和node 2信息并导入Cytoscape 3.6.0软件,对其进行网络拓扑分析,筛选网络中连接度Degree排名前10的靶点,作为茯苓治疗肥胖病的核心靶点。见图 6,其中节点的大小表示Degree值的大小,节点大小越大,代表Degree值越大。边的粗细表示Combine score,边越粗Combine score值越大。
|
| 图 6 蛋白质-蛋白质相互作用(PPI)图 |
将获得的靶点上传至DAVID 6.8(https://david.ncifcrf.gov/summary.jsp)数据库中,保留P<0.05的通路,将这些通路与CTD数据库(http://ctdbase.org/)中obesity相关通路进行匹配,并检索文献进行验证,选取与肥胖病关系最密切的通路作为茯苓治疗肥胖病的重要通路。KEGG通路分析结果得到32条信号通路,其中与肥胖病关系密切的通路20条。见表 4。
历代医籍很早就对肥胖这一病症的病因病机及治疗进行了详细的论述。《素问·通评虚实论》曰:“肥贵人,则膏粱之疾也。”将引起肥胖的主要原因归之于饮食不节。《黄帝内经》不单从病因方面对肥胖进行了讨论,并且对肥胖的病位给与了明确的论述,指出肝、脾、肾三脏与肥胖的发生息息相关[5]。随着中医学的发展,众多名家都对肥胖的病机提出详细而深入的理论创新。包括元·朱震亨在《丹溪心法》《格致余论》,清代喻昌在《医门法律》以及张聿青在《张聿青医案》中对于肥胖的论述,3位医家均认为“肥人多痰多湿”,将肥胖的关键病机归之于痰湿,总结了对于肥胖病人应以健脾利湿化痰为治疗大法[6]。诚如清·陈世铎于《石室秘录》中所言:“肥人多痰,乃气虚也。虚则气不能运行,故痰生之”,并且进一步论述了治疗肥胖需补脾胃之气,并补命门之火,指出气虚乃肥胖之病机,气足则痰自消矣。清·王清任所著的《医林改错》中载:“元气既虚,必不能达于血管,血管无气,必停留而淤”,阐明气虚血瘀亦为肥胖之重要病机。国医大师王琦[7]在前人经验指导下结合临床实践,强调肥胖应从“气虚”“痰湿”“血瘀”3个方面综合调治,为中药治疗肥胖提供了坚实的理论依据。
通过对中医药治疗肥胖组方的用药频次分析发现,使用频率较高的药物有茯苓、泽泻、白术、山楂、半夏、大黄、决明子、甘草、荷叶、陈皮、苍术、黄芪、枳实、丹参、厚朴、薏苡仁等。以上药物中茯苓、白术、陈皮、苍术、黄芪、薏苡仁,均为燥湿健脾之常用药。半夏、陈皮、厚朴均为燥湿化痰之要药。泽泻利水渗湿、泄热、化浊降脂,甘草既可燥湿又可化痰,枳实兼具消积与化痰之功效。现在研究证明[8-12],具有化瘀消脂作用的山楂、大黄、决明子、荷叶、丹参对于肥胖的治疗效果较为显著。研究结果可见,健脾利湿化痰为中药治疗肥胖主要治则,这与中医学对于“肥人多痰湿”“肥人多气虚”的理论相呼应。
关联规则结果显示,白术与茯苓,半夏与茯苓的支持度最高,分别为0.35和0.23,反映了这两对药物在治疗肥胖的组方中出现的概率最大。显示这两药对在临床治疗肥胖中最为常用。其中白术与茯苓配伍,白术健脾益气,燥湿利水,茯苓利水渗湿健脾,两者共奏健脾化湿之功。半夏燥湿化痰,降逆止呕,消痞散结,与茯苓相配伍,茯苓长于健脾渗湿,半夏长于燥湿化痰,两药合用标本兼治,显示两药对在临床的治疗肥胖中最为常用。按置信度的排序,甘草、半夏与茯苓,半夏、白术与茯苓为最高,均为1。从置信度反映的前项后项药物同时出现的次数占前项药物出现次数的比例来看,临床上中药治疗肥胖,甘草、半夏与半夏、白术两组药对常与茯苓同时使用。以提升度来分析,陈皮、茯苓与半夏的正相关性为最高(提升度为3),说明半夏在应用陈皮、茯苓这对药物治疗肥胖的组方中的使用频率提升2倍。不难发现上述3组结果同样体现了燥湿健脾化痰这一治则在治疗肥胖过程中的重要性,因痰由湿生,湿责之于脾,从而理气健脾以袪痰,标本兼邪而不伤正。提示临床中治疗肥胖多以具有益气健脾,燥湿化痰功效的药物互相配伍使用。
基于以层次聚类的方法对药物进行聚类,结果显示,第1组以健脾渗湿药和燥湿化痰药加之具有祛瘀消脂作用的山楂、丹参、荷叶为主。从病机角度对肥胖进行探究,本病的病机往往相互影响相互转化,脾虚日久,脾不升清,运化失司,水谷精微失于输布,则易聚湿生痰,故而肥胖。脾气亏虚,气虚推动无力,血行不畅而瘀滞,气不为用则气郁,或痰湿内停,阻碍气血运行均可致气滞血瘀,进而发为肥胖。以第1组药物之功效进行总结分析,益气健脾,燥湿化痰,祛瘀消脂为肥胖的常用治法,为大多数肥胖患者治疗所共用。第2组药物由于个体差异的不同,药物加减亦不同,药物较为繁杂,故选取较为有代表性的一组进行讨论,选出的药物组为大柴胡汤的基础组方。仝小林教授[13]古方今用,应用大柴胡汤治疗肥胖取得了显著疗效,佐证了以大柴胡汤为基础方,运用消膏降浊、消积导滞、化痰通腑之法,对于治疗肥胖的肯定意义,对临床治疗肥胖用药具有一定的参考作用。采用K-means聚类的方法与以层次聚类的方法对药物进行聚类的结果几乎相同,在此不再赘述。
主成分分析中,从双标图分析得到,茯苓、白术、泽泻、山楂、半夏、陈皮、荷叶、决明子、苍术、大黄、丹参、黄芪等药物在中药治疗肥胖的组方用药中更为重要。由主成分贡献图中分析得到,维度1包含的药物以健脾利水为主要功效。维度2包含药物中山楂、荷叶、泽泻、丹参均有化瘀的功效。维度3包含的药物以化痰为主要共性。维度4包含的药物中白术、甘草、苍术均可益气健脾,泽泻、山楂、丹参,均可化瘀。有研究结果表明[14],肥胖主要病机为痰湿、血瘀、气虚等证。上述结果亦与国医大师王琦提出的肥胖应从“气虚”“痰湿”“血瘀”3个方面综合调治这一理论相符合。
通过网络药理学方法分析高频药物茯苓治疗肥胖的潜在作用机制,结果发现茯苓治疗肥胖涉及多通路、多靶点。其中筛选出的靶点排名较高的有ANXA1,HTR1A,CXCR4,ADRA2B,CNR1,ADRA2A,HTR1B,PTGER3,DRD2等,提示这些靶点可能是茯苓发挥治疗肥胖作用的核心靶点。如AnxA1水平与BMI,腰围和腰臀比呈正相关,与急性期蛋白,C-反应蛋白(CRP)和脂肪细胞因子瘦素的血浆浓度呈负相关,且通过实验得出ANXA1是小鼠肥胖的重要调节因子,可能是通过调节脂解和(或)糖皮质激素水平这一机制来进行[15-16]。DAVID 6.8数据库进行通过KEGG通路分析结果得到32条信号通路,其中与肥胖病关系密切的通路20条,涉及5-羟色胺能突触、TRP通道的炎症介质调节、脂肪细胞因子信号通路、胰岛素抵抗、胰岛素信号通路等。如中枢神经递质5-羟色胺通过交感神经/副交感神经系统调节食欲并控制代谢器官,外周神经递质5-羟色胺以自分泌/旁分泌或内分泌方式调节葡萄糖代谢,胰岛素抗性和能量消耗来调节肥胖[17]。大量证据表明[18],脂肪细胞因子在健康受试者的代谢稳态中起着关键作用,而这些因素的缺陷,由肥胖和脂肪细胞功能障碍引起,是肥胖周围疾病群发病机制中的一个核心组成部分。如代谢调节中最有效的脂肪细胞因子之一的瘦素通过向其他器官,尤其是下丘脑,发送营养状况信号,经下丘脑产生调节食物摄入和能量消耗的神经肽和神经递质来调节体质量[19]。上述结果均表明茯苓对治疗肥胖具有潜在的研究价值,为进一步深入研究其作用机制提供参考与方向。
综上所述,本研究采用数据挖掘和网络药理学的方法对中药治疗肥胖的用药规律及高频药物茯苓治疗肥胖的潜在作用机制进行了多角度的探析,为临床中药治疗肥胖提供了可靠的用药参考,也为更深一步的探究中药治疗肥胖的作用机制提供了新的方向与数据支撑。由于数据库和数据库之间内在的复杂性与信息的不完善以及化合物之间的相互作用的不确定性,故研究预测的结果具有一定的局限性,需要构建复杂网络进行进一步的深入挖掘及验证。
| [1] |
中华医学会内分泌学分会肥胖学组. 中国成人肥胖症防治专家共识[J]. 中华内分泌代谢杂志, 2011, 27(9): 711-717. Chinese Medical Association Endocrinology Branch Obesity Group. Chinese adult obesity prevention expert consensus[J]. Chinese Journal of Endocrinology and Metabolism, 2011, 27(9): 711-717. DOI:10.3760/cma.j.issn.1000-6699.2011.09.003 |
| [2] |
GARVEY W T, MECHANICK J I, BRETT E M, et al. American association of clinical endocrinologists and American college of endocrinologists clinical practice guidelines for comprehensives for comprehensive medical care of patients with obesity -executive summary-executive summary[J]. Endocrine Practice Official Journal of the American College of Endocrinology & the American Association of Clinical Endocrinologists, 2016, 22(Suppl 3(aop)): 1. |
| [3] |
BRAY G A, HEISEL W E, AFSHIN A, et al. The science of obesity management:An endocrine society scientific statement[J]. Endocrine Reviews, 2018, 108: 235-248. |
| [4] |
CEFALU W T, BRAY G A, HOME P D, et al. Advances in the science, treatment, and prevention of the disease of obesity:reflections from a diabetes care editors' expert forum[J]. Diabetes Care, 2015, 38(8): 1567. DOI:10.2337/dc15-1081 |
| [5] |
王姬. 中医对肥胖认识研究的发展概况[J]. 中国中医药现代远程教育, 2017, 15(11): 152-154. WANG J. A Survey of the Development of TCM understanding of obesity[J]. Chinese Medicine Modern Distance Education of China, 2017, 15(11): 152-154. DOI:10.3969/j.issn.1672-2779.2017.11.067 |
| [6] |
舒晴, 喻松仁, 王萍. 从中医体质角度探讨肥胖的形成机制[J]. 江西中医药, 2017, 48(2): 8-9, 15. SHU Q, YU S R, WANG P. Discussion on the formation mechanism of obesity from the perspective of TCM constitution[J]. Jiangxi Journal of Traditional Chinese Medicine, 2017, 48(2): 8-9, 15. |
| [7] |
杨玲玲, 倪诚, 李英帅, 等. 王琦治疗肥胖经验[J]. 中医杂志, 2013, 54(21): 1811-1813. YANG L L, NI C, LI Y S, et al. WANG Qi's experience in treating obesity[J]. Journal of Traditional Chinese Medicine, 2013, 54(21): 1811-1813. |
| [8] |
许勤伟, 黄胜, 吴传东, 等. 山楂治疗氯氮平所致肥胖高脂血症疗效观察[J]. 海南医学, 2016, 27(6): 883-885. XU Q W, HUANG S, WU C D, et al. Therapeutic effect of hawthorn on obesity hyperlipidemia induced by clozapine[J]. Hainan Medical Journal, 2016, 27(6): 883-885. DOI:10.3969/j.issn.1003-6350.2016.06.008 |
| [9] |
王晓宇.大黄复方治疗单纯性肥胖症的初步研究[D].成都: 四川师范大学, 2009. WANG X Y. Preliminary study on the treatment of simple obesity with rhubarb compound[D]. Chengdu: Sichuan Normal University, 2009. |
| [10] |
马兰军, 李峰, 李波. 决明子对肥胖大学生部分形态和生理指标干预效果的实验研究[J]. 时珍国医国药, 2009, 20(1): 41-43. MA L J, LI F, LI B. Experimental study on the intervention effect of cassia seed on partial morphological and physiological indexes of obese college students[J]. Lishizhen Medicine and Materia Medica Research, 2009, 20(1): 41-43. DOI:10.3969/j.issn.1008-0805.2009.01.021 |
| [11] |
关章顺, 吴俊, 喻泽兰, 等. 荷叶水提物对人体高脂血症的降脂效果研究[J]. 郴州医学高等专科学校学报, 2003(3): 3-6. GUAN Z S, WU J, YU Z L, et al. Study on the lipid-lowering effect of lotus leaf water extract on human hyperlipidemia[J]. Journal of Chenzhou Medical College, 2003(3): 3-6. DOI:10.3969/j.issn.1673-498X.2003.03.002 |
| [12] |
邵致格, 胡曼菁, 孙桂菊. 丹参预防肥胖大鼠早期代谢异常的实验研究[J]. 福建中医药, 2005(2): 37-39. SHAO Z G, HU M J, SUN G J. Experimental study on prevention of early metabolic abnormality in obese rats by Salvia Miltiorrhiza[J]. Fujian Journal of Traditional Chinese Medicine, 2005(2): 37-39. |
| [13] |
周强, 赵锡艳, 逄冰, 等. 仝小林教授运用大柴胡汤治疗代谢性疾病验案解析[J]. 环球中医药, 2012, 5(10): 754-757. ZHOU Q, ZHAO X Y, PANG B, et al. Professor Xiao Lin's application of Da Chaihu decoction in the treatment of metabolic diseases[J]. Global Traditional Chinese Medicine, 2012, 5(10): 754-757. DOI:10.3969/j.issn.1674-1749.2012.10.013 |
| [14] |
史兴洲, 郑曙琴. 中成药治疗肥胖症用药规律研究[J]. 江西中医药, 2014, 45(5): 12-13. SHI X Z, ZHENG S Q. Study on the rule of Chinese medicine in the treatment of obesity[J]. Jiangxi Journal of Traditional Chinese Medicine, 2014, 45(5): 12-13. |
| [15] |
Attenuation of plasma annexin A1 in human obesity[J]. The FASEB Journal, 2013, 27(1): 368-378.
|
| [16] |
AKASHEH R T, PINI M, PANG J. Increased adiposity in annexin A1-deficient mice[J]. PloS one, 2013, 8(12): e82608. DOI:10.1371/journal.pone.0082608 |
| [17] |
OH C M, PARK S, KIM H. Serotonin as a New Therapeutic Target for Diabetes Mellitus and Obesity[J]. Diabetes & Metabolism Journal, 2016, 40(2): 167-187. |
| [18] |
CAO H. Adipocytokines in obesity and metabolic disease[J]. Journal of Endocrinology, 2014, 220(2): T47. DOI:10.1530/JOE-13-0339 |
| [19] |
FRIEDMAN J M, HALAAS J L. Leptin and the regulation of body weight in mammals[J]. Nature, 1998, 395: 6704. |
 2020, Vol. 39
2020, Vol. 39