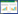文章信息
- 薄颖异, 张玥辉, 杨柳, 崔洁, 王文全, 侯俊玲
- BO Yingyi, ZHANG Yuehui, YANG Liu, CUI Jie, WANG Wenquan, HOU Junling
- 甘草地上部分总黄酮不同提取方法及其抗氧化活性研究
- The research on different extraction methods of total flavonoids of the aerial part of Glycyrrhiza uralensis and the antioxidant activity of total flavonoids
- 天津中医药大学学报, 2020, 39(2): 145-151
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 145-151
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.02.06
-
文章历史
收稿日期: 2019-12-24
2. 中国医学科学院北京协和医学院药用植物研究所, 北京 100193;
3. 中药材规范化生产教育部工程研究中心, 北京 100102
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China;
3. Engineering Research Center of GAP for Chinese Crude Drugs, Ministry of Education, Beijing 100102, China
甘草又名国老,《中华人民共和国药典》中记载为豆科植物甘草(Glycyrrhiza uralensis Fisch.)、胀果甘草(Glycyrrhiza inflata Bat.)或光果甘草(Glycyrrhiza glabra L.)的干燥根和根茎[1]。甘草据史料记载,最早产于东北三省,现多集中分布在西北、东北、华北地带,主要是以新疆、内蒙古自治区,甘肃等地为主要产区[2-4]。甘草应用于古方当中已有近千年。更有“十方九草”、“无草不成方”之说,故称“国老”。
甘草传统入药部位是根及根茎,但其地上部分资源同样丰富,据文献报道适当割取地上部分有利于根及根茎活性物质的积累[5-6];且其黄酮类活性成分具有诸多药理活性,例如抗氧化[7-8]、抑制肿瘤细胞和癌细胞的生长和发展[9-10]、雌性激素样作用,对前列腺炎,病原微生物感染、肝损伤、消化系统疾病、痉挛及变态反应等症状具有良好疗效[11-14]。
为进一步开发利用新资源,全面高效的提取方法的研究必不可少,因黄酮类化合物结构和种类的多样性,提取方法也是多种多样,常见的有溶剂提取法[15]、超声提取法[16-17]、浸渍法[18]、超临界萃取[19]等方法;然而国内提取方法研究大多局限于实验室,并未涉及实际生产领域。
在此背景下,研究首次将工厂提取方法与实验室提取方法进行对比考察,并因其成分多样,故加入不同提取溶剂提取进一步对比研究;工厂提取方法常见为回流提取,实验室提取方法常见有水煎煮,超声提取,回流提取,故本实验将一同比较上述提取方法;为了全面对比甘草地上部分活性成分,根据相似相溶原理,提取溶剂的选择按照极性由大到小设计为乙醇,正丁醇,乙酸乙酯,石油醚;本实验以总黄酮提取率作为评价指标,并通过体外抗氧化活性评价了甘草地上部分总黄酮的1,1-二苯基苦基苯肼(DPPH)清除能力及还原力,从而筛选出最适提取方法及提取溶剂,为后续甘草地上部分开发利用奠定理论基础,提供切实可行的提取方案。
1 材料与方法 1.1 实验原材料甘草地上部分来自甘肃省酒泉市瓜州县河东乡2018年9月采收的甘草地上部分,材料由中国医学科学院药用植物研究所王文全教授鉴定为甘草(Glycyrrhiza uralensis Fisch.,也称乌拉尔甘草)的干燥地上部分;采收样品经自然阴干和磨粉机粉碎,然后过40目筛常温干燥器内贮存备用。
1.2 实验试剂水(娃哈哈集团有限公司);甲醇(美国FISHER公司,色谱纯);乙腈(美国FISHER公司,色谱纯);甲醇(分析纯,北京化工厂);乙醇(分析纯,北京化工厂);正丁醇(分析纯,北京化工厂);乙酸乙酯(分析纯,北京化工厂);石油醚(分析纯,北京化工厂);氢氧化钾(分析纯,北京化工厂);槲皮素(色谱纯,上海源叶生物科技有限公司);DPPH(东京化成工业株式会社生产);磷酸缓冲液(0.2 mol/L,pH 6.6,上海源叶生物科技有限公司);铁氰化钾(分析纯,上海源叶生物科技有限公司);三氯乙酸(分析纯,罗恩试剂);三氯化铁(分析纯,北京百灵威科技有限公司)。
1.3 实验仪器40目标准检验筛(筛孔直径0.45 mm,北京祥宇伟业仪器设备有限公司);CP224C电子天平(奥豪斯上海仪器有限公司);BJ-150型粉碎机(德清拜杰电器有限公司);KH-500DE型数控超声波清洗器(北京鑫科奥科技有限公司);UV-2600紫外可见分光光度计(尤尼柯上海仪器有限公司);精宏DZF-6050真空干燥箱(上海和呈仪器制造有限公司);鼓风干燥箱(天津市泰斯特仪器有限公司101-2AB);湘仪H1650离心机(长沙湘仪离心机仪器有限公司)。
1.4 数据处理软件实验数据采用SAS9.3采用软件分析,多组间比较采用单因素方差分析,组间两两比较采用LSD法,P < 0.05表示差异有统计学意义。
2 实验方法 2.1 总黄酮提取率测定 2.1.1 对照品制备精密称取槲皮素标准品0.022 2 g,以少量甲醇溶解,后定容于100 mL棕色容量瓶中,配制成浓度为0.222 0 mg/mL的标准溶液,4 ℃冰箱冷藏保存[20-21]。
2.1.2 标准曲线制备分别精密量取0.2、0.4、0.6、0.8、1.2和1.8 mL的槲皮素溶液于10 mL容量瓶中,甲醇补足至2 mL,加入10%氢氧化钾(KOH)溶液1mL,充分摇匀,静置5 min,用娃哈哈纯净水定容至刻度,充分摇匀后于400 nm处测定吸光度值。以吸光度A为纵坐标,槲皮素浓度C为横坐标,用EXCEL绘制标准曲线,得回归方程:Y=30.473X-0.011(r2=0.999 4),结果表明槲皮素浓度在0.259~1.211 mg/mL范围内呈现良好的线性关系。
2.1.3 总黄酮提取率测定精密称取总黄酮提取物0.100 0 g,适量甲醇溶解并定容于10 mL容量瓶中。精密量取提取物溶液0.25 mL于10 mL容量瓶中,按照2.1.2中方法进行显色并测定其吸光度,根据上述标准曲线计算总黄酮提取率。
2.1.4 总黄酮提取率计算公式
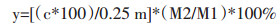
|
其中y代表总黄酮提取率(mg/g),c代表提取物浓度(mg/mL),m代表称取的提取物的量(mg),M2代表提取后所得提取物的量(mg),M1代表提取原药材的量(g)。
2.2 不同提取方法对比 2.2.1 水煎煮提取精密称取甘草地上部分粉末5.000 0 g于100 mL圆底烧瓶中,温度100 ℃,液料比10:1,提取时间90 min,提取2次。过滤,合并滤液,干燥,称质量。计算出膏率及总黄酮提取率。重复3次。
2.2.2 实验室回流醇提精密称取甘草地上部分粉末5.000 0 g于100 mL圆底烧瓶中,提取温度75 ℃,液料比10:1,70%乙醇溶液,提取时间90 min,提取2次。过滤,合并滤液,干燥,称质量。计算出膏率及总黄酮提取率。重复3次。
2.2.3 实验室超声醇提精密称取甘草地上部分粉末5.000 0 g于100 mL锥形瓶中,提取温度75 ℃,功率500 W,70%乙醇溶液,液料比10:1,提取时间30 min,提取2次。过滤,合并滤液,干燥,称质量。计算出膏率及总黄酮提取率。重复3次。
2.2.4 工厂回流醇提称取甘草地上部分粗粉50.000 kg,提取温度75 ℃,液料比6:1,70%乙醇溶液,提取时间90 min,提取2次。过滤,合并滤液,干燥,称质量。计算出膏率及总黄酮提取率。
2.3 提取溶剂考察[22]精密称取甘草地上部分粉末8.000 0 g于100 mL锥形瓶中浸渍,液料比10:1,提取时间24 h,提取1次,分别使用无水乙醇、正丁醇、乙酸乙酯、石油醚进行提取。过滤,合并滤液,干燥,称质量。计算出膏率及总黄酮提取率。重复3次。
2.4 体外抗氧化能力测定 2.4.1 DPPH清除能力的测定准确称取一定量的甘草地上部分提取物物粉末,分别加入相应量的甲醇配制成0.1、0.2、0.3、0.4和0.5 mg/mL的待测样品溶液。准确称取DPPH试剂45 mg,以无水乙醇溶解至1 000 mL容量瓶,充分摇匀,即得0.045 mg/mL DPPH溶液,避光低温保存。分别取1 mL待测样品溶液和3 mL DPPH溶液混合摇匀,室温且避光反应30 min,于517 nm波长下测定其吸光度值。以待测液溶剂为空白对照,记为A空白;1 mL待测样品溶剂和3 mL DPPH溶液混合物,记为A对照;1 mL待测样品溶液和3 mL DPPH溶液,记为A样;计算样品自由基清除率[23-24]。
清除率=[A空白-(A样-A对照)]/A空白
2.4.2 还原力的测定准确称取一定量的甘草地上部分提取物物粉末,分别加入相应量的甲醇配制成0.2、0.4、0.6、0.8和1.0 mg/mL的待测样品溶液。分别取待测样品溶液1 mL和2 mL浓度为0.2 mol/L的磷酸缓冲溶液(pH=6.6)和1 mL的1%铁氰化钾溶液,得混合物A,在50 ℃水浴保温20 min,然后加入2 mL的10%三氯乙酸溶液,在3 000 r/min条件下离心15 min。取上清液2 mL,加入2 mL蒸馏水及0.5 mL的0.1%三氯化铁溶液,得混合待测物B,于700 nm波长下测吸光度[25-26]。
吸光度值越大,样品的还原力越强。
3 结果与分析 3.1 不同提取方法对甘草地上部分总黄酮提取率的影响水煎煮作为最原始的提取方法,具有设备简单,溶剂易得的优点;超声提取作为实验室常用的提取方法,能够快速破坏植物的细胞,加速药材在提取溶剂中的溶解,提取效率高;回流提取作为传统常规提取方法,与水煎煮相比,不易挥发,且能充分提取,生产时常常采取此方法。工厂提取设备巨大,投料较为粗放,无法控制是否会有茎和果实等杂质,且料液比及温度等条件都难以达到实验室内的精细条件,从而活性成分的提取会受到相应的影响。
总黄酮提取率由高至低依次为回流实验室醇提 > 实验室超声醇提 > 回流工厂醇提 > 水煎煮法。出膏率由高至低依次为回流实验室醇提 > 实验室超声醇提 > 回流工厂醇提 > 水煎煮法,见表 1。
实验室超声醇提与实验室回流醇提之间没有显著性差异,但两者所用时间差距明显,后续实验可根据目的进行方法选择;实验室回流醇提与工厂回流醇提具有显著性差异,证明工厂生产提取与实验室提取有一定差距,具有一定的损失;水煎煮法的出膏率高、黄酮提取率低,表明其提取的大多为大极性物质,多糖和蛋白质类杂质比较多,应用价值不高;而其余3种提取方法所得提取物较水煎煮法相比成分更加全面均匀。数据表明实验室超声提取或回流提取提取效果较好。
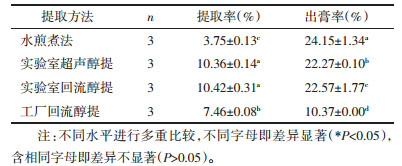
3.2 不同提取溶剂对甘草地上部分总黄酮提取率的影响按照相似相溶原理,极性越大的试剂越能提取出极性大的物质,反之亦然。
总黄酮提取率由高至低依次为乙酸乙酯提取 > 正丁醇提取 > 乙醇提取 > 石油醚提取,每组数据之间均有显著性差异。出膏率由高至低依次为乙醇提取 > 正丁醇提取 > 乙酸乙酯提取 > 石油醚提取,每组数据之间均有显著性差异,见表 2。
数据表明,乙醇能提出较多的黄酮但也能提出部分多糖,所以造成黄酮提取率较低,结合出膏率数据,总黄酮量较高;正丁醇和乙酸乙酯的黄酮提取率较高,但出膏率一般,且有机试剂价格高,有毒性。石油醚结合总黄酮提取率和出膏率数据,提取得到的黄酮类活性成分非常少,不予考虑。综上,考虑经济效益及安全性,选择乙醇比较恰当。
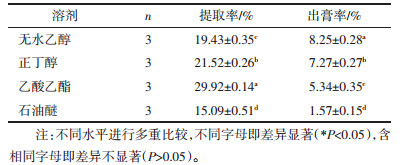
3.3 体外抗氧化能力测定结果分析 3.3.1 DPPH清除能力结果分析DPPH自由基是一种稳定的自由基,自由基清除剂与DPPH的单电子配对,随其浓度降低颜色会逐渐褪色,颜色越浅,吸光度越小,表明DPPH清除率越高,抗氧化能力越强。
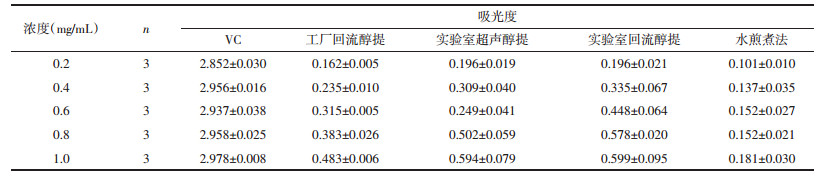
如表 3所示,以VC作为对照品,随着浓度依次递增,VC和不同提取方法所得受试物的DPPH清除能力也随之增强,呈现先上升后平稳的趋势。在所有受试物中,VC作为对照品,其DPPH清除能力最强;工厂回流醇提较实验室超声或回流相比稍高,或许因其提取量大,混合不均匀,导致取样部分黄酮浓度稍高,或与其实验本身有关,DPPH极易氧化,造成数据不稳;水煎煮法所得黄酮提取率最低,相同浓度下所含黄酮量最少,其DPPH清除能力最弱。
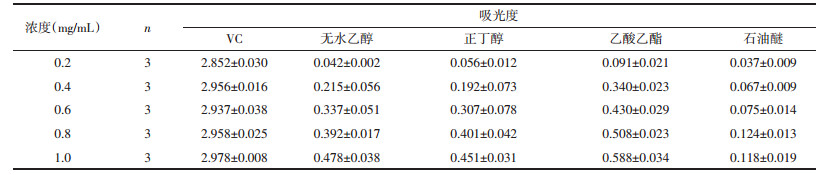
如表 4所示,以VC作为对照品,随着浓度依次递增,VC和不同提取溶剂所得受试物的DPPH清除能力也随之增强,呈现先上升后平稳的趋势。在所有受试物中,乙酸乙酯提取受试物的DPPH清除能力基本与VC相当,乙醇与正丁醇稍低;与上述水煎煮法同理,石油醚提取受试物的DPPH清除能力最弱。
还原力可以在某些方面代表物质的抗氧化能力,现被广泛应用于抗氧化活性相关研究中[27]。
K3Fe(CN)6+样品→K4Fe(CN)6+样品氧化物
K4Fe(CN)6+Fe3+→Fe4[Fe(CN)6]3
在700 nm波长条件下测定其吸光度值,吸光度值越大,样品的还原力越强。
如表 5所示,以VC作为对照品,随着浓度依次递增,VC还原力基本稳定;不同提取方法所得受试物的还原力也随之增强,呈现先上升后平稳的趋势。在所有受试物中,VC作为对照品,其还原力最强;实验室回流醇提与实验室超声醇提基本相当,工厂回流醇提稍差;水煎煮法所得黄酮提取率最低,相同浓度下所含黄酮量最少,其还原力最弱。
如表 6所示,以VC作为对照品,随着浓度依次递增,VC还原力基本稳定;不同提取溶剂所得受试物的还原力也随之增强,呈现先上升后平稳的趋势。在所有受试物中,VC的还原力最强;样品中乙酸乙酯同样是还原力最强的,正丁醇和乙醇稍低;与上述水煎煮法同理,石油醚提取受试物的还原力最弱。
文章通过对比不同提取方法及不同提取溶剂,以总黄酮提取率及抗氧化活性为评价指标,优选出提取效果较好的提取方法和提取溶剂。实验室超声醇提和实验室回流醇提效果较好,可根据实际情况进行选择;考虑经济效益及安全性,最适提取溶剂为乙醇;所得黄酮提取物都具有一定的抗氧化活性,且存在量效依赖关系。
若可以着重研究这几种方法或者试剂所得提取物的成分及含量区别,可以更好地开展分类黄酮的富集,不同类别的黄酮的抗氧化活性可以进一步研究,以此做到具有针对性的抗氧化剂的开发,为药食两用甘草植物资源的开发利用奠定理论基础,可将其广泛应用于其他相关领域。
| [1] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社, 2015. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[S]. Beijing: China Medical Science and Technology Publishing House, 2015. |
| [2] |
刘洋洋, 刘春生, 曾斌芳, 等. 甘草种质资源研究进展[J]. 中草药, 2013, 44(24): 3593-3598. LIU Y Y, LIU C S, ZENG B F, et al. Research progress on germplasm resources of Glycyrrhiza uralensis[J]. Chinese Traditional and Herbal Drugs, 2013, 44(24): 3593-3598. |
| [3] |
青梅, 俞腾飞, 徐为峰, 等. 不同产地乌拉尔甘草种子发芽率及出苗率的测定[J]. 内蒙古农业大学学报(自然科学版), 2014, 35(3): 53-56. QING M, YU T F, XU W F, et al. A determination and research about different regions of the seed germination and emergence rate of Glycyrrhiza uralensis[J]. Journal of Inner Mongolia Agricultural University (Natural Science Edition), 2014, 35(3): 53-56. |
| [4] |
李海华, 青梅, 于娟, 等. 甘草的研究进展[J]. 内蒙古医科大学学报, 2015, 37(2): 199-204. LI H H, QING M, YU J, et al. Research progression of Glycyrrhiza uralensis[J]. Journal of Inner Mongolia Medical University, 2015, 37(2): 199-204. |
| [5] |
贾世山, 邱桂芬. 甘草地上部分的活性成分和资源利用[J]. 中草药, 1994, 25(2): 106-107. JIA S S, QIU G F. Active ingredients and resource utilization in the Aerial Parts of Glycyrrhiza uralensis[J]. Chinese Traditional and Herbal Drugs, 1994, 25(2): 106-107. |
| [6] |
周彪, 万传星. 甘草地上部分化学成分研究[J]. 中草药, 2016, 47(1): 21-25. ZHOU B, WAN C X. Chemical constituents from aerial parts of Glycyrrhiza uralensis[J]. Chinese Traditional and Herbal Drugs, 2016, 47(1): 21-25. |
| [7] |
崔誉蓉, 陈朋, 刘军花, 等. 4种甘草黄酮类化合物抗氧化构效关系研究[J]. 时珍国医国药, 2010, 21(12): 3041-3043. CUI Y R, CHEN P, LIU J H, et al. Structure-activity relationship of four flavones from Glycyrrhiza uralensis[J]. Lishizhen Medicine and Materia Medica Research, 2010, 21(12): 3041-3043. |
| [8] |
罗丽平, 李艳静, 张慧, 等. HPLC-Q-TOF MS/MS偶联DPPH添加法测定甘草黄酮类成分体外代谢产物的抗氧化活性[J]. 中国新药杂志, 2013, 22(21): 2547-2552. LUO L P, LI Y J, ZHANG H, et al. Determination of antioxidant activity in licorice vitro metabolites by DPPH spiking coupled with HPLC-Q-TOF MS/MS[J]. Chinese Journal of New Drugs, 2013, 22(21): 2547-2552. |
| [9] |
TANG S N, HUANG W, JI S, et al. Prenylated flavonoids from Glycyrrhiza uralensis as promising anti-cancer agents:a preliminary structure-activity study[J]. Journal of Chinese Pharmaceutical Sciences, 2016, 25(1): 23-29. |
| [10] |
张敏, 李晶晶. 甘草黄酮类化合物对CDK1的抑制活性及体内外抗肝癌活性[J]. 中国药科大学学报, 2018, 49(1): 72-78. ZHANG M, LI J J. Effect of licorice flavonoids as CDK1 inhibitors against liver cancer in vitro and in vivo[J]. Journal of China Pharmaceutical University, 2018, 49(1): 72-78. |
| [11] |
张琳, 赵梓邯, 于冰莉, 等. 甘草地上部分对慢性前列腺炎大鼠的影响[J]. 中成药, 2019, 41(6): 1407-1410. ZHANG L, ZHAO Z H, YU B L, et al. Effects of the Aerial Parts of Glycyrrhiza uralensis on rats with chronic prostatitis[J]. Chinese Traditional Patent Medicine, 2019, 41(6): 1407-1410. |
| [12] |
赵梓邯, 张琳, 杨柳, 等. 甘草地上部分的安全性评价[J]. 中国实验方剂学杂志, 2019, 25(3): 74-80. ZHAO Z H, ZHANG L, YANG L, et al. Safety evaluation of over-ground parts of Glycyrrhiza uralensis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(3): 74-80. |
| [13] |
郭忠军, 麻常娟. 甘草地上部分黄酮研究概况[J]. 航空航天医药, 2005, 16(1): 62-64. GUO Z J, MA C J. An overview of studies on flavonoids in the Aerial Parts of Glycyrrhiza uralensis[J]. Aerospace Medicine, 2005, 16(1): 62-64. |
| [14] |
WANG R, ZHANG C Y, BAI L P, et al. Flavonoids derived from liquorice suppress murine macrophage activation by up-regulating heme oxygenase-1 independent of Nrf2 activation[J]. International Immunopharmacology, 2015, 28(2): 917-924. |
| [15] |
热娜古丽·热依木, 盛磊, 伊力亚尔·尼加提, 等. 响应面法优化瘤果黑种草子总黄酮的提取工艺及体外抗肿瘤活性研究[J]. 西北药学杂志, 2019, 34(5): 590-596. RENAGULI R, SHENG L, YILIYAER N, et al. Optimization of the extraction process of total flavonoids from Nigellaglandulifera preynet Sint by response surface method and study on its in vitro antitumor activity[J]. Northwest Pharmaceutical Journal, 2019, 34(5): 590-596. |
| [16] |
杜银香, 张建伟, 胡泽华, 等. 华中枸骨叶总黄酮超声提取工艺的优化及其抑菌作用[J]. 中成药, 2019, 41(9): 2200-2203. DU Y X, ZHANG J W, HU Z H, et al. Optimization of ultrasonic extraction of total flavonoids from Ilex centrochinensis leaves and its bacteriostasis[J]. Chinese Traditional Patent Medicine, 2019, 41(9): 2200-2203. |
| [17] |
王飞, 樊金拴, 冯慧英, 等. 青扦针叶总黄酮超声提取及抗氧化活性[J]. 西北林学院学报, 2016, 31(1): 243-249. WANG F, FAN J S, FENG H Y, et al. Ultrasound assisted extraction and antioxidant activities of total flavonoids in the needles of Picea wilsonii[J]. Journal of Northwest Forestry University, 2016, 31(1): 243-249. |
| [18] |
周彪.乌拉尔甘草与胀果甘草地上部分化学成分研究[D].阿拉尔: 塔里木大学, 2015. ZHOU B. Chemical constituents from the Aerial Parts of Glycyrrhiza uralensis and Glycyrrhiza inflata[D]. Aral City: Tarim University, 2015. |
| [19] |
付玉杰, 施晓光, 刘晓娜, 等. 超临界CO2提取甘草地上部分总黄酮[J]. 植物研究, 2007, 27(3): 372-375. FU Y J, SHI X G, LIU X N, et al. Supercritical CO2 extraction of flavonoids from the aerial parts of Glycyrrhiza uralensis[J]. Bulletin of Botanical Research, 2007, 27(3): 372-375. |
| [20] |
程新宇, 韩亚男, 康雪芳, 等. 甘草地上部分总黄酮含量测定方法的筛选[J]. 中医药信息, 2015, 32(2): 1-5. CHENG X Y, HAN Y N, KANG X F, et al. Selection of content determination methods of total flavonoids of the aerial part of licorice[J]. Information on Traditional Chinese Medicine, 2015, 32(2): 1-5. |
| [21] |
张鲁, 张媛, 王文全, 等. 甘草地上部分总黄酮提取工艺优化及抗氧化活性研究[J]. 辽宁中医药大学学报, 2018, 20(4): 55-59. ZHANG L, ZHANG Y, WANG W Q, et al. Optimization of extraction process and antioxidative activity of total flavonoids in the aerial parts of Glycyrrhiza uralensis[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2018, 20(4): 55-59. |
| [22] |
范靖然.乌拉尔甘草地上部分的化学成分与生物活性研究[D].北京: 北京中医药大学, 2019. FAN J R. Study on chemical constituents and biological activities of the Aerial Parts of Glycyrrhiza uralensis Fisch[D]. Beijing: Beijing University of Chinese Medicine, 2019. |
| [23] |
康雪芳, 李红丽, 王文全, 等. 甘草地上部分脂溶性总黄酮抗氧化活性研究[J]. 环球中医药, 2016, 9(5): 567-570. KANG X F, LI H L, WANG W Q, et al. Evaluation of the antioxidant activity of fat-soluble flavonoids in aerial parts of Glycyrrhiza uralensis Fisch[J]. Global Traditional Chinese Medicine, 2016, 9(5): 567-570. |
| [24] |
刘艳红, 许海燕, 彭修娟, 等. 响应面分析法优化秦皮多酚超声提取工艺及体外抗氧化活性研究[J]. 西北药学杂志, 2019, 34(5): 574-579. LIU Y H, XU H Y, PENG X J, et al. Optimization of extraction technology of polyphenols from Fraxini cortex by response surface method and study its antioxidant activity in vitro[J]. Northwest Pharmaceutical Journal, 2019, 34(5): 574-579. |
| [25] |
黄仁术, 胡晓梦, 何惠利. 大别山野葛根异黄酮超声辅助提取工艺的响应面优化与还原力测定[J]. 中国药学杂志, 2015, 50(1): 51-57. HUANG R S, HU X M, HE H L. Optimization of ultrasonic-assisted extraction techniques of isoflavones from wild Pueraria lobata in Dabie Mountain by response surface methodology and reducing power measurement[J]. Chinese Pharmaceutical Journal, 2015, 50(1): 51-57. |
| [26] |
罗秋水, 杜华英, 熊建华, 等. 葛根异黄酮类化合物提取工艺优化及其抗氧化活性研究[J]. 中国食品学报, 2015, 15(2): 104-110. LUO Q S, DU H Y, XIONG J H, et al. Optimization of extraction process and antioxidant activity of isoflavones from Radix puerariae[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(2): 104-110. |
| [27] |
SANCHEZ M C. Review:methods used to evaluate the free radical scavenging activity in foods and biological systems[J]. Food Science and Technology International, 2002, 8(3): 121-137. |
 2020, Vol. 39
2020, Vol. 39