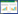文章信息
- 胡文仲, 许云, 李光亚, 张童燕, 姜楠, 高常柏
- HU Wenzhong, XU Yun, LI Guangya, ZHANG Tongyan, JIANG Nan, GAO Changbai
- 5/6肾切除联合ISO制备心肾综合征大鼠模型方法初探
- Preliminary study on the method of preparing cardiorenal syndrome rat model by 5/6 nephrectomy combined with ISO
- 天津中医药大学学报, 2020, 39(2): 199-202
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 199-202
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.02.18
-
文章历史
收稿日期: 2019-11-20
2. 天津中医药大学第二附属医院, 天津 300250
2. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
随着医疗技术发展, 心力衰竭与肾脏病患者生存率不断提高, 心肾疾病之间的紧密关系逐渐被发现。临床治疗心肾综合征手段有限, 利尿与超滤为主要治疗措施。为探索中医药治疗心肾共损状态的作用机制, 心肾综合征实验模型不可或缺。目前常见的造模方法可分为手术法与药物注射法两类[1], "5/6肾切除术制备心肾综合征大鼠模型"是经典的制备心肾综合征模型方法之一, 由肾功能衰竭导致心衰也符合心肾综合征发病机制之一, 但通过单一方法制备心肾综合征大鼠模型往往花费时间较长。查阅相关文献, 课题组最终选择异丙肾上腺素(ISO)作为本次研究方向, ISO属非选择性β受体激动剂, 可显著加快心率, 提高心肌收缩力, 若是大剂量长时间使用, 可直接诱导心肌损伤[2]。因此课题组选择在肾切除术后低剂量、短时间联用ISO, 以达到缩短肾功能衰竭导致心力衰竭自然病程的目的, 且不会直接诱导致心肌损伤, 该法可较高程度模拟心肾综合征疾病过程。
1 材料与方法 1.1 主要实验材料 1.1.1 动物情况清洁级SD雄性大鼠20只, 体质量(150±10) g, 均购自北京维通利华实验动物技术有限公司。
1.1.2 耗材与仪器ISO(SIGMA)、戊巴比妥钠、注射用青霉素钠、注射器(1、5、20 mL)、注射用水、碘伏、明胶海绵、无菌纱布、毛细采血管、促凝离心管、移液枪(100~1 000 μL)、10%中性甲醛溶液等。瑞士Sunrise全自动酶标仪、HH-4恒温水浴锅、RT-3000自动洗板机(深圳雷杜)、Eppendorf 5427R台式高速冷冻离心机等。
1.1.3 检测试剂大鼠尿素氮(BUN)酶联免疫吸附(ELISA)检测试剂盒、大鼠脑钠尿肽(BNP)ELISA检测试剂盒、大鼠血肌酐(Cr)ELISA检测试剂盒, 均由武汉纯度生物科技有限公司提供。
1.2 实验方法 1.2.1 分组及造模方法将20只雄性SD大鼠随机分为2组, 正常组9只, 手术组11只, 正常组大鼠不做处理, 手术组大鼠均按"两次手术法"行5/6肾切除术, 手术1周后连续2 d(间隔24 h)皮下注射异丙肾上腺素(分别为2.5、1.5 mg/kg)制备心肾综合征模型:1)一期手术(左肾2/3切除):大鼠称体质量并记录后, 以2%戊巴比妥钠35 mg/kg腹腔注射麻醉。麻醉成功后, 将大鼠俯卧位固定在大鼠手术台上, 从左侧腹缓慢向背部推及肾脏, 确定手术区位置, 手术区域备皮、碘伏消毒。距左脊肋角1.5 cm处做2 cm左右的长切口, 再次从腹侧向背侧推挤肾脏, 使左肾视野充分暴露。用镊子钝性分离左肾周围脂肪层, 剥离肾包膜、肾上腺及肾蒂, 充分游离肾蒂并用血管钳夹闭, 再用弯剪分别从左肾上下极弧形切除部分肾组织, 共切除2/3左肾, 随即使用明胶海绵压迫两侧切口15~20 s, 松开血管钳并用无菌纱布压迫止血, 待无新鲜出血, 将剩余肾脏及周围组织还纳体内, 明胶海绵无需取出, 可自行吸收。缝合前在腹腔内注入青霉素钠8万单位。由内而外逐层缝合肌肉层及皮肤, 0.9%氯化钠注射液、碘伏先后清洁切口及手术区域, 术后大鼠先单笼饲养并观察生命体征, 待大鼠完全苏醒后再放入饲养笼混养。2)二期手术(右肾全切):于一期手术1周后行右肾全切术, 大鼠称体质量、麻醉、固定、消毒步骤同上, 距右脊肋角1.5 cm处做1.5~2 cm的切口, 暴露右肾并分离周围组织、肾包膜、肾上腺及肾蒂, 使肾蒂完全游离, 用血管钳夹闭肾蒂, 4-0手术线分别结扎血管钳内、外侧肾蒂, 手术剪行右肾全切, 观察10~15 s, 确认切口无活动性出血后, 腹腔内注入8万单位青霉素钠, 由内而外逐层缝合, 术后单笼饲养并观察生命体征。两次手术共约切除双肾总质量的5/6。3)大鼠于手术1周后背部皮下注射ISO, 连续2 d(间隔24 h)注射, 注射量分别为2.5、1.5 mg/kg, 注射后常规食水饲养6周。
1.2.2 血清采集及检测方法大鼠采用眼框内静脉丛取血法取血。血液收集完毕后静置20 min, 3 500 r/min离心10 min, 移液枪采集血清并做好标记。采用ELISA试剂盒检测。
1.2.3 病理组织采集及观察方法观察6周后处杀所有存活大鼠, 解剖并分离心脏及肾脏(空白组大鼠留取左肾), 将其置于10%中性甲醛溶液中固定, 常规石蜡包埋、切片、苏木精-伊红(HE)染色, 在光镜下观察心肌细胞, 肾小球、肾小管、肾间质及肾血管情况, 心肌细胞体积、心肌排列情况、有无充血、水肿、细胞增殖和炎性浸润、硬化、玻璃样变性、纤维组织增生等病理变化。病理观察由天津中医药大学第二附属医院病理科完成。
1.3 统计学方法采用SPSS 22.0统计软件进行实验数据分析, 符合正态分布的计量资料使用均数±标准差(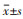
造模后, 手术组大鼠活动力与空白组相比明显减弱, 反应较慢, 多喜蜷缩, 活动后喘息明显, 耳廓苍白, 体毛松散、干枯少光泽, 被毛生长速度明显迟于空白组大鼠, 摄食量减少, 大便成形或稀溏; 空白组大鼠活动灵敏, 反应积极, 体毛茂密、整齐有光泽, 耳廓红润, 进食水正常, 大便正常。
2.2 两组大鼠血清学比较空白组与手术组BNP、Cr水平在统计学上有统计学差异(P < 0.05), BUN水平无统计学差异。见表 1。
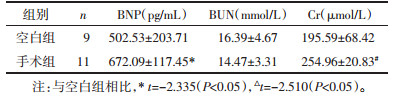
造模前两组大鼠体质量相比无明显差异, 造模后、造模6周后手术组大鼠体质量较空白组均明显降低, 两组体质量之间比较有统计学差异(P < 0.05), 两组心脏质量指数之间比较有统计学差异(P < 0.05)。心脏质量指数=心脏湿质量/体质量(心脏称质量前需用滤纸吸干多余血液, 减去周围血管及其他软组织), 可反映心脏代偿性增大情况, 心功能受损严重程度与心肌代偿性肥大成正相关, 见表 2。
空白组大鼠心肌细胞大小正常, 分布均匀, 排列整齐, 细胞外基质少且不明显; 手术组大鼠心肌细胞弥漫性肥大增粗, 心肌纤维排列紊乱不均匀, 心肌轻度充血, 可见明显的心肌细胞肿胀, 部分心外膜下心肌细胞间质水肿明显, 结果与心力衰竭动物模型文献报道[3-4]相一致。见图 1。
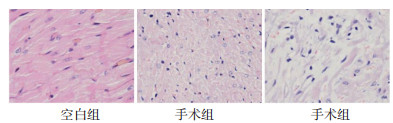
|
| 图 1 两组大鼠心肌组织HE染色(×400) |
空白组肾小球、肾小管及肾间质组织结构正常, 未见增生、变性及炎症细胞浸润; 手术组肾盂轻度扩张, 肾间质可见弥漫多灶性淋巴细胞少量浆细胞浸润, 局部纤维组织轻度增生, 部分肾小球扩大充血、部分肾小管肿胀、肾小管内可见蛋白管型, 局部皮质浅层可见灶性楔形凹陷区, 凹陷区肾小管萎缩, 间质内可见较多淋巴细胞浸润, 纤维组织增生玻璃样变, 与相关文献报道[5-6]描述一致, 见图 2。
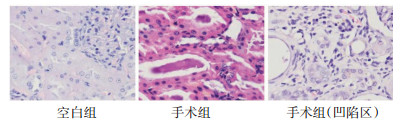
|
| 图 2 两组大鼠肾组织HE染色(×400) |
目前公认的心肾综合征共分为5型, 本实验采用了5/6肾切除联合ISO皮下注射制备心肾综合征大鼠模型, 模拟肾衰竭导致心力衰竭的过程, 较符合IV型心肾综合征发病机制。5/6肾切除造模法是直接使用手术方式切除大部分肾组织, 残余肾脏代偿, 负荷量明显增大[5], 在高灌注、高滤过状态下可代偿性增大, 最终导致肾功能不全。肾功能衰竭造模过程中, 合适的麻醉药物及剂量是缩短手术时间的捷径之一, 课题组参考《实验动物学》中介绍的麻醉方法[6], 选择2%戊巴比妥钠35 mg/kg腹腔注射麻醉, 该剂量麻醉效果良好, 注射后1.5~3 min左右起效, 可维持麻醉时间30 min以上, 起效时间短, 作用时间适中, 符合肾切除术所需麻醉程度, 可供同道参考。在理论上, 5/6肾切除大鼠肾衰模型制备后, 若给予足够时间即可导致心肌损伤[8], 这是最理想的心肾综合征模型, 但在时间有限的条件下, 选择联用ISO加速大鼠心功能不全的建立。因ISO可加快心脏泵速, 增加心肌耗氧, 使得心肌运动疲劳。因此课题组选择在肾切除术后低剂量、短时间联用ISO, 以达到缩短肾功能衰竭导致心力衰竭自然病程的目的, 且不会直接诱导致心肌损伤, 该法可较高程度模拟心肾综合征疾病过程, 而且皮下注射方式较温和, 药物作用缓慢, 可在保证大鼠存活的基础上同时加速心功能不全模型的建立。大鼠5/6肾切除联合异丙肾造模方案可靠, 造模后可观察到心肾综合征大鼠活动力减弱、喘憋, 体毛干枯无光泽, 体质量增长速度较正常大鼠缓慢, 一般情况符合心肾综合征表现, 肾功能主要指标Cr、心功能主要指标BNP及心肾组织病理均较空白组有明显改变。关于心肾综合征造模方法国内外尚无统一标准, 利用该联合方法成模时间短、操作难度低, 是一种简捷高效的心肾综合征造模方法, 可以为心肾综合征动物实验提供模型基础, 为课题组进一步探讨心肾综合征疾病的药物治疗及机制研究提供了新的途径。本研究目的在于制备适合临床治疗所需的心肾综合征大鼠模型, 且手术组大鼠的心肾共损状态表现明显, 与空白组比较存在统计学差异。但该法由于不完全模拟慢性肾衰竭导致心力衰竭的自然病程, 可能不适用于研究该病早期发展变化规律, 而对于心肾综合征已发展为心肾共损状态时的药物治疗评价及机制研究较为合适。另外建议将该模型应用于药物研究时, 严格遵循上述操作流程, 异丙肾上腺素注射方式及剂量均已提及, 若延长注射ISO时间, 可能会影响对观察项造成影响, 因有研究发现ISO以剂量依赖的方式损害心室功能[9]。
| [1] |
王蕾, 郝迪, 李旭, 等. 心肾综合征动物模型研究进展[J]. 中国药理学通报, 2013(11): 22-24. WANG L, HAO D, LI X, et al. Research progress in animal models of cardiorenal syndrome[J]. Chinese Pharmacological Bulletin, 2013(11): 22-24. |
| [2] |
梁娟, 刘越, 尹新华. 异丙肾上腺素所致心肌损伤动物模型的研究进展[J]. 中国实验动物学报, 2019, 27(01): 116-120. LIANG J, LIU Y, YIN X H. Research progress of animal models of myocardial injury induced by isoproterenol[J]. Acta Laboratorium Animalis Scientia Sinica, 2019, 27(1): 116-120. |
| [3] |
李梅秀, 田国忠, 欧叶涛, 等. 大鼠阿霉素慢性心衰模型的制备与心衰指标的判定[J]. 解剖学研究, 2005, 27(3): 176-178. LI M X, TIAN G Z, OU Y T, et al. The establishment of a chronic heart failure model by adrinmycin and the judgement of the indexes[J]. Anatomy Research, 2005, 27(3): 176-178. DOI:10.3969/j.issn.1671-0770.2005.03.006 |
| [4] |
马家宝, 黄丽贞, 韦丽富, 等. 磨盘草石油醚部位改善异丙肾上腺素致大鼠心力衰竭的研究[J]. 中华中医药杂志, 2016, 31(7): 2745-2748. MA J B, HUANG L Z, WEI L F, et al. Research on the effects of petroleum ether extract of abutilon indicum on improving heart failure of rats induced by isoproterenol[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2016, 31(7): 2745-2748. |
| [5] |
沙朝晖, 付平, 周莉, 等. 大鼠5/6肾切除慢性肾功能衰竭动物模型的实验研究[J]. 四川动物, 2006, 25(3): 632-634. SHA Z H, FU P, ZHOU L, et al. White rat animal model of renal failure by 5/6 nephrectomize[J]. Sichuan Journal of Zoology, 2006, 25(3): 632-634. DOI:10.3969/j.issn.1000-7083.2006.03.053 |
| [6] |
宋伟, 李明哲, 关佳楠, 等. 真武汤对肾阳虚肾衰模型大鼠肾脏病理影响[J]. 中国中医基础医学杂志, 2011, 17(12): 1336-1337. SONG W, LI M Z, GUAN J N, et al. Effect of Zhenwu Tang on kidney pathology of renal failure with kidney-yang deficiency syndrome in rats[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2011, 17(12): 1336-1337. |
| [7] |
秦川.实验动物学[M].北京: 人民卫生出版社, 2010: 264-276. QIN C. Laboratory Animal Sciences[M]. Beijing: People's Medical Publishing House, 2010: 264-276. |
| [8] |
张道友, 杨利才, 汪枫, 等. 缬沙坦及苯那普利对慢性肾衰竭大鼠心肌病变的治疗作用[J]. 中国药理学通报, 2008, 24(12): 1599-1603. ZHANG D Y, YANG L C, WANG F, et al. The treatmengt effect of angiotensin Ⅱ receptor antagonist and angiotensin converting enzyme inhibitor on cardiac damage in rats with chronic renal failure[J]. Chinese Pharmacological Bulletin, 2008, 24(12): 1599-1603. DOI:10.3321/j.issn:1001-1978.2008.12.015 |
| [9] |
GRIMM D, ELSNER D, SCHUNKERT H, et al. Development of heart failure following isoproterenol administration in the rat:role of the renin-angiotensin system[J]. Cardiovascular Research, 1998, 37(1): 91-100. |
 2020, Vol. 39
2020, Vol. 39